超聲引導下微波消融術用于甲狀腺良性結節對甲狀腺功能及結節體積水平的影響分析
商百良
(遼寧省盤錦市中心醫院普外科,遼寧 盤錦 124000)
甲狀腺良性結節指甲狀腺腺瘤、炎癥性結節、腫瘤性結節及結節性甲狀腺腫等疾病,一般良性結節不會影響甲狀腺功能,部分患者頸部腫大,導致聲音嘶啞,甚至影響正常呼吸[1]。臨床予甲狀腺激素抑制劑、放射、手術等治療方法,除手術外,其他方式療程較長,臨床應用受限[2]。手術切除甲狀腺結節創傷較大,影響患者術后恢復。經皮穿刺微波消融術是微創手術方式,微波消融針可直插病變組織內部,經熱、冷刺激,使病灶內部蛋白質發生凝固和壞死,從而達到治療作用[3]。本研究旨在分析超聲引導下微波消融術治療甲狀腺良性結節對患者甲狀腺功能、結節體積水平產生的影響,現報道如下。
1 資料與方法
1.1 臨床資料 選取本院2018年3月至2020年3月收治的120例甲狀腺良性結節患者作為研究對象,隨機分為觀察組與對照組,每組60例。對照組男22例,女38例;平均年齡(45.5±4.2)歲;結節數78枚,囊性結節12枚,實性結節45枚,囊實混合結節21枚;結節體積1.2~10.3 cm3,平均體積(5.17±3.64)cm3。觀察組男23例,女37例;平均年齡(44.8±4.3)歲;結節數79枚,囊性結節13枚,實性結節46枚,囊實混合結節20枚;結節體積1.2~10.2 cm3,平均體積(5.16±3.64)cm3。兩組臨床資料比較差異無統計學意義,具有可比性。所有患者均對本研究知情同意并自愿簽署知情同意書。本研究已通過本院倫理委員會審核批準。
納入標準:經彩超確診為甲狀腺結節;甲狀腺功能正常;免疫抗體正常;甲狀腺直徑0.45~4.2 cm。排除標準:甲狀腺惡性腫瘤者;甲狀腺亢進者;凝血功能障礙者;嚴重臟器衰竭者。
1.2 方法 對照組給予腹腔鏡切除術,術前氣管插管全麻,仰臥位,頸部稍伸,墊高肩部,充分暴露手術視野。經由胸乳入路,切口10 mm,分別于雙側乳暈取兩個5 mm操作孔,將30 ml 0.9%氯化鈉溶液與2滴腎上腺素混合,通過注射器注于胸前壁操作區皮下深筋膜。剝離至皮下深筋膜層,置管后建立CO2氣腹,維持氣腹壓力0.8 kPa,置10 mm腹腔鏡,經鏡下操作,使用電凝鉤分離下皮疏松結締組織。超聲刀切開頸白線,游離甲狀腺,保持甲狀旁腺組織的完整,切除病灶,經觀察孔取出,最后縫合處理。
觀察組于超聲引導下行微波消融術治療,仰臥位,墊高肩部,稍后屈,微仰頭部,保持頸部過伸狀態,充分暴露頸部。顯示頸前區,超聲檢查后確定結節病灶位置、范圍。術中監測心率、血壓及血氧飽和度等指標,開放靜脈通路。消毒、鋪巾后,經超聲引導,對肘靜脈團注造影劑,經超聲觀察結節、周圍血流灌注的變化。注射2%利多卡因局麻,范圍包括皮膚至甲狀腺外包膜穿刺通路,避免溫度過高產生不適感。經超聲觀察結節前、結節后、上下左右各路徑情況,選擇液體隔離帶法穿刺,取30~40 ml 0.9%NaCl注射液分離甲狀腺后包膜、食管間隙,分離周圍甲狀腺與后包膜、喉返神經等區域,尤其是結節鄰近頸動脈、喉返神經等結構,形成5 mm液體隔離帶,保護周邊組織神經。術中避開大神經、血管,選擇合適進針方向及位置。進針路徑遵循從遠至近、從深至淺的原則。經頸外側朝內側穿刺,頸中線外側穿刺外下象限結節,消融時需注意穿刺路徑。插入微波消融針,微波功率25~30 W,消融時間1 min。結節過多可采用多次進針方式進行消融治療;結節過大需進行多面、多點消融方式治療;囊實性結節可使用注射器抽吸囊液,也可使用聚桂醇硬化劑沖洗囊腔,再使用微波消融針消除其他成分和囊壁。氣化回聲覆蓋結節后,注入造影劑,觀察結節消融狀態,如造影劑顯影,需再次對此區域進行消融治療,至無造影劑顯影為標準,手術結束。
1.3 觀察指標 術后6個月,采用全自動免疫分析儀檢測兩組血清游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)和促甲狀腺激素(TSH)水平;通過彩超觀察并記錄結節體積水平。采用視覺模擬疼痛評分法(VAS)評價兩組術后8、24、48 h疼痛情況,0分表示無疼痛感,1~3分表示疼痛輕,4~6分表示中度疼痛,7~9分表示疼痛嚴重,10分表示疼痛劇烈不能忍受。比較兩組術后甲狀旁腺損傷、甲狀腺結節破裂發生率。
1.4 統計學方法 采用SPSS 19.0統計學軟件分析數據,計量資料以“±s”表示,采用t檢驗,計數資料以[n(%)]表示,采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 兩組術后甲狀腺功能、結節體積比較 觀察組FT3、FT4水平均低于對照組,FSH水平高于對照組,結節體積小于對照組,差異均有統計學意義(P<0.05),見表1。
表1 兩組術后甲狀腺功能、結節體積水平比較(±s)Table1 Comparison of postoperativethyroid function and nodule volumebetween the two groups(±s)
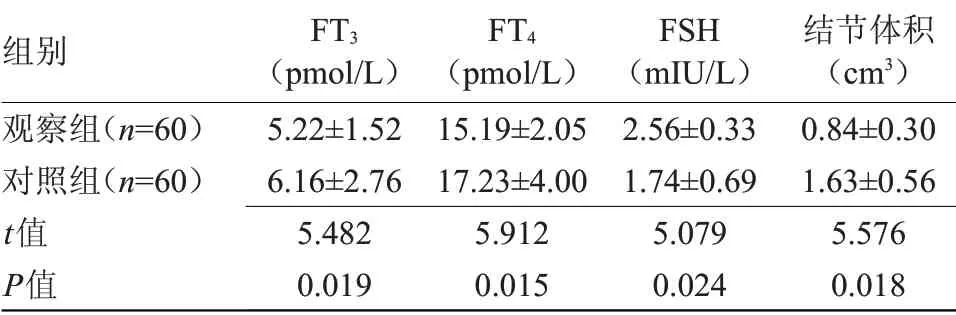
表1 兩組術后甲狀腺功能、結節體積水平比較(±s)Table1 Comparison of postoperativethyroid function and nodule volumebetween the two groups(±s)
注:FT3,游離三碘甲狀腺原氨酸;FT4,游離甲狀腺素;TSH,促甲狀腺激素
組別觀察組(n=60)對照組(n=60)t值P值FT3(pmol/L)5.22±1.52 6.16±2.76 5.482 0.019 FT4(pmol/L)15.19±2.05 17.23±4.00 5.912 0.015 FSH(mIU/L)2.56±0.33 1.74±0.69 5.079 0.024結節體積(cm3)0.84±0.30 1.63±0.56 5.576 0.018
2.2 兩組術后疼痛評分比較 術后8、24、48 h,觀察組VAS評分均低于對照組,差異有統計學意義(P<0.05),見表2。
表2 兩組術后疼痛評分比較(±s,分)Table2 Comparison of postoperative pain scoresbetween the two groups(±s,scores)
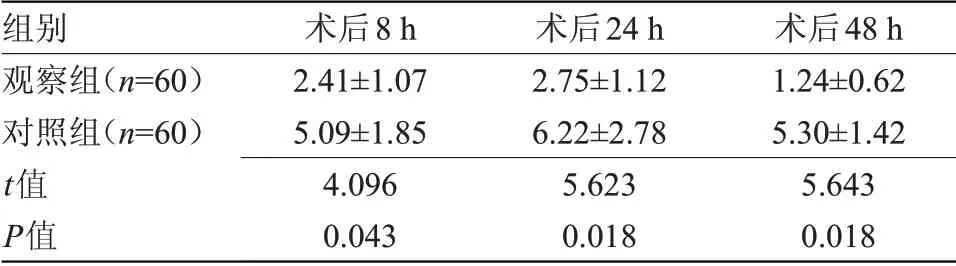
表2 兩組術后疼痛評分比較(±s,分)Table2 Comparison of postoperative pain scoresbetween the two groups(±s,scores)
組別觀察組(n=60)對照組(n=60)t值P值術后8 h 2.41±1.07 5.09±1.85 4.096 0.043術后24 h 2.75±1.12 6.22±2.78 5.623 0.018術后48 h 1.24±0.62 5.30±1.42 5.643 0.018
2.3 兩組術后并發癥發生率比較 觀察組術后發生甲狀旁腺損傷1例,并發癥發生率為1.7%(1/60);對照組術后發生甲狀旁腺損傷1例,甲狀腺結節破裂2例,術后并發癥發生率為5%(3/60),兩組比較差異無統計學意義(χ2=1.035,P=0.309)。
3 討論
多數結節性甲狀腺腫是在單純彌漫性甲狀腺腫基礎上,由于病情反復進展,上皮細胞過度增生,病情惡變進展為惡性腫瘤。甲狀腺受損后,影響正常生活,破壞內環境。為避免甲狀腺結節惡化,感覺受損,多實施手術切除治療。傳統開放手術切口較大,易損傷喉返神經,影響頸部美觀和預后[4-6]。與腹腔鏡手術效果相比,微波消融術實施后,不影響患者甲狀腺功能,注射氯化鈉注射液后,可形成隔離帶,保護甲狀腺正常功能,避免功能受阻。微波消融時剖開結節周圍的血管、神經和氣管等外側組織,能避免周圍二次受損,減少并發癥發生。消融術使用微波針灼燒結節血管,可阻斷血液供應,避免術中大出血,降低手術操作難度[7]。
超聲引導下微波消融術是甲狀腺外科微創新型技術,經超聲引導鎖定甲狀腺病灶,微波消融針穿刺病灶,經物理高熱輔助,使病變組織脫水、凝固至變性、壞死。通過新陳代謝,由機體自行吸收,達到清除病灶的作用[8]。微波消融術以針孔微術操作,能減輕患者創面疼痛,減少瘢痕,且不會損傷甲狀腺正常組織。微波消融術可確保頸部外觀美觀度,保證甲狀腺正常功能,改善患者預后[9]。
本研究結果顯示,觀察組FT3、FT4水平低于對照組,FSH水平高于對照組,結節體積小于對照組,差異均有統計學意義(P<0.05),表明超聲引導下微波消融術治療甲狀腺良性結節能增強甲狀腺功能,縮小結節體積。術后8、24、48 h,觀察組VAS評分均低于對照組,差異有統計學意義(P<0.05)。兩組并發癥發生率比較差異無統計學意義,提示超聲引導下微波消融術定位精準,能減小患者受傷創面面積,減輕患者疼痛感,減少并發癥發生。與余慶林[10]研究結果一致。需注意的是,微波消融術操作時,需控制適宜的消融功率和時間,一旦發生過度消融,結節組織會產生嚴重的焦化反應,導致術后組織吸收發生障礙,吸收時間過長,影響甲狀腺機體功能恢復,而消融時間不足易導致恢復期結節再次復發,需二次手術治療。高齡患者對手術耐受能力較差,應選擇適宜治療方式,如間歇性消融治療,分階段完成手術,保護甲狀腺組織,維持動脈血液正常供應。
綜上所述,超聲引導下微波消融術治療甲狀腺良性結節效果顯著,可促進患者甲狀腺腺體功能恢復正常狀態,緩解患者疼痛感,改善預后,值得臨床推廣應用。

