小鼠睪丸組織玻璃化保存的初步實驗研究
譚 佳 郭瑩瑩 周新麗
(上海理工大學生物熱科學研究所 上海 200093)
近50年來,男性精子數量呈大幅下降趨勢[1],且男性不育癥的患病率已接近10%[2],這引發了人們對現代環境影響生育的擔憂。男性不育可能是由多種潛在因素造成的,包括精子產生和精子傳遞缺陷。其中,非梗阻性無精癥是影響男性生殖健康最為嚴重的一類表型,目前尚缺乏使患者恢復生精功能的治療手段。此外,醫療手段的進步使青少年癌癥患者的整體生存率提高,但放化療對其生育力的損傷在一定程度上是不可逆的,男性兒童癌癥幸存者的不孕不育率已達到46%[3]。由于精液冷凍僅適用于青春期后的患者,對于還未產生精子的青春期前男孩并不適用。已有研究證實對青春期前的女孩進行卵巢組織的冷凍保存,并在成年時移植,可恢復其生育能力[4]。那么,對于無法取精的不育患者,或者患有癌癥需放化療的精液中未產生精子的青春期前男孩,將其睪丸組織進行冷凍也是潛在的保存生育力的方法。冷凍復蘇后的睪丸組織可自體移植,重建生精過程,使患者恢復生育力而自然生育。
睪丸組織的低溫保存方法主要有慢速冷凍法與玻璃化冷凍法,兩者的主要區別在于冷凍保護劑(cryoprotectant, CPA)的濃度和使用的冷卻速率。在慢速冷凍保存中,即使在最佳冷卻速率下,仍不可避免細胞外冰晶帶來的機械損傷。而在玻璃化凍存中,細胞及高濃度保護劑溶液以足夠快的冷卻速率降溫,從而形成玻璃態,理論上避免了胞內外結晶引起的冰晶損傷。但睪丸組織由于體積較大,且細胞的滲透特性不一,與單個細胞(如精子)相比,玻璃化保存也更具挑戰性。目前,關于成人和青春期前小鼠睪丸組織玻璃化凍存的研究尚不完善,且有學者指出玻璃化凍存可能誘導細胞損傷,導致細胞活力降低、誘導細胞凋亡、DNA完整性喪失等[5]。
玻璃化凍存在冷凍前需要加載較高濃度的CPA,由于睪丸組織自身對水及保護劑的滲透能力較低,若加載時間過短,保護劑無法滲透至生精小管內部;若加載時間過長,將導致組織表層的精原細胞長期暴露于保護劑溶液中,使其受到較大的滲透損傷和毒性損傷[6]。因此,為了在滲透作用與毒性作用之間找到平衡,最大限度地提高保護劑對睪丸組織的保護作用,需要對睪丸組織玻璃化冷凍所使用的保護劑種類、濃度及加載時間進行優化。C. Yildiz等[7]對比了三種不同濃度及加載時間的一日齡新生小鼠的整個睪丸組織玻璃化凍存效果,分別為:1)G. Rahimi等[8]的凍存方法:一步法添加保護劑,體積分數為40%的EG+體積分數為18%的Ficoll+0.35 mol/L蔗糖,在1.8 mL凍存瓶中浸泡6 min后直接投入液氮;2)F. Migishima等[9]的凍存方法:兩步添加保護劑,體積分數為7.5%DMSO的保護劑溶液中浸泡5 min,轉移至體積分數為15%的DMSO+1 mol/L乙酰胺+3 mol/L丙二醇中浸泡3 min,裝載于1.5 mL凍存管投入液氮;3)R. C. Chain等[10]的凍存方法:兩步添加保護劑,在體積分數為7.5%的EG+體積分數為7.5%的PROH中浸泡5 min,轉入體積分數為15%的EG+體積分數為15%的PROH+0.5 mol/L蔗糖中浸泡2 min后,裝載于凍存管投入液氮,將各組睪丸組織冷凍復溫后移植于小鼠體內,觀察組織移植后產生精子的能力,結果表明,只有第一組高濃度保護劑玻璃化產生了活性精子。可以看出,目前睪丸組織玻璃化凍存方法中所使用的保護劑種類、濃度及加載方案區別較大,所得到的凍存結果也相差很大。
目前關于睪丸組織凍存的研究,大多以復蘇后細胞和組織的活性對凍存方法進行評價,并以此為依據調整凍存工藝,耗費較多的材料和人力。M. Curaba等[11]以乳酸脫氫酶釋放試驗評估的組織活力,免疫組化檢測的細胞凋亡和增殖,光鏡檢測的小管直徑、完整性和細胞密度作為標準,對比了青春期前小鼠睪丸組織玻璃化和慢速冷凍的結果,結果顯示兩種方法均保留了青春期前小鼠睪丸組織的存活、發育和完整性。C. S. Andrae等[12]以生精小管基底膜脫離的比例、各類細胞的凋亡情況為依據,對比了灰狼睪丸組織玻璃化和慢速冷凍,結果表明慢速冷凍可以更好地保持冷凍保存的睪丸組織形態。差示掃描量熱法通過測量樣品在特定的降溫程序下發生結晶現象時的相變溫度和相變過程中的焓變,判斷特定種類及濃度的保護劑抑制冰晶形成和生長的能力,從而對保護劑的選擇起到指導作用[13],大大減少了實驗工作量。李鑫等[14]借助差式掃描量熱儀(DSC) 研究了天然氨基酸中的L-賴氨酸、L-脯氨酸、甘氨酸和 L-絲氨酸水溶液的成核溫度、結晶焓和冰點溫度隨溶液濃度及降溫速率的變化規律,獲得了4種氨基酸低溫保護劑水溶液的未凍水含量,并分析了氨基酸類保護劑與水分子的作用機理。受以上研究的啟發,若運用DSC檢測加載保護劑后睪丸組織在降溫過程中形成組織內冰晶的相變溫度及相變焓,可用于研究不同體積分數保護劑溶液及不同浸泡時間加載保護劑后,抑制組織內形成冰晶的能力,對睪丸組織凍存過程中保護劑加載方案的選擇具有指導性意義。
基于以上分析,本文首先運用差示掃描量熱儀,對在不同體積分數保護劑中浸泡不同時間后的睪丸組織進行熱分析,推測不同保護劑加載方案對組織內部抑制冰晶形成的能力;其次,對睪丸組織進行玻璃化冷凍保存,結合熱分析結果及睪丸組織的凍后管腔完整率及組織內各生殖細胞的凋亡率,綜合分析玻璃化凍存效果;最后,將睪丸組織玻璃化凍存與優化的慢速冷凍保存結果進行對比,得出更適用塊狀睪丸組織冷凍的方法。本研究的結果對推動人睪丸組織凍存的臨床應用有參考意義。
1 材料與方法
1.1 主要試劑及其配置
睪丸組織基礎液為含體積分數為20%FBS的DF12(DMEM/F-12 medium)培養液。用基礎液按照體積分數配置三組玻璃化冷凍液、復蘇溶液及洗滌溶液,具體組成如表1所示。每組玻璃化冷凍液由平衡溶液(equilibration solution, ES)和玻璃化溶液(vitrification solution, VS)兩部分組成。

表1 玻璃化冷凍液及復蘇液
1.2 小鼠睪丸組織采集
選取5~8周齡的雄性小鼠,將其安樂死后快速置于手術臺上,用酒精棉輕輕擦拭腹部,用消毒后的無菌剪刀剪開小鼠下腹部,找到睪丸后剪去附睪連接組織以取出睪丸,置于室溫下(約24~26 ℃)的睪丸組織基礎液中,用鑷子與剪刀夾住睪丸表面白膜輕輕撕開,獲得睪丸內部組織,備用。
1.3 睪丸組織的保護劑溶液加載方案
睪丸組織采用兩步法進行玻璃化保護劑的加載。首先,將睪丸組織在各組平衡溶液(ES1、ES2、ES3)中浸泡10 min,然后在其對應的保護劑溶液(VS1、VS2、VS3)中分別加載1、3、5 min,得到9組保護劑溶液加載方案。以玻璃化溶液中DMSO的體積分數和加載時間表示9種保護劑的冷凍方案,如表2所示。例如20%(體積分數)-1 min表示睪丸組織在平衡溶液ES1中浸泡10 min,然后對應的保護劑溶液VS1中加載1 min。
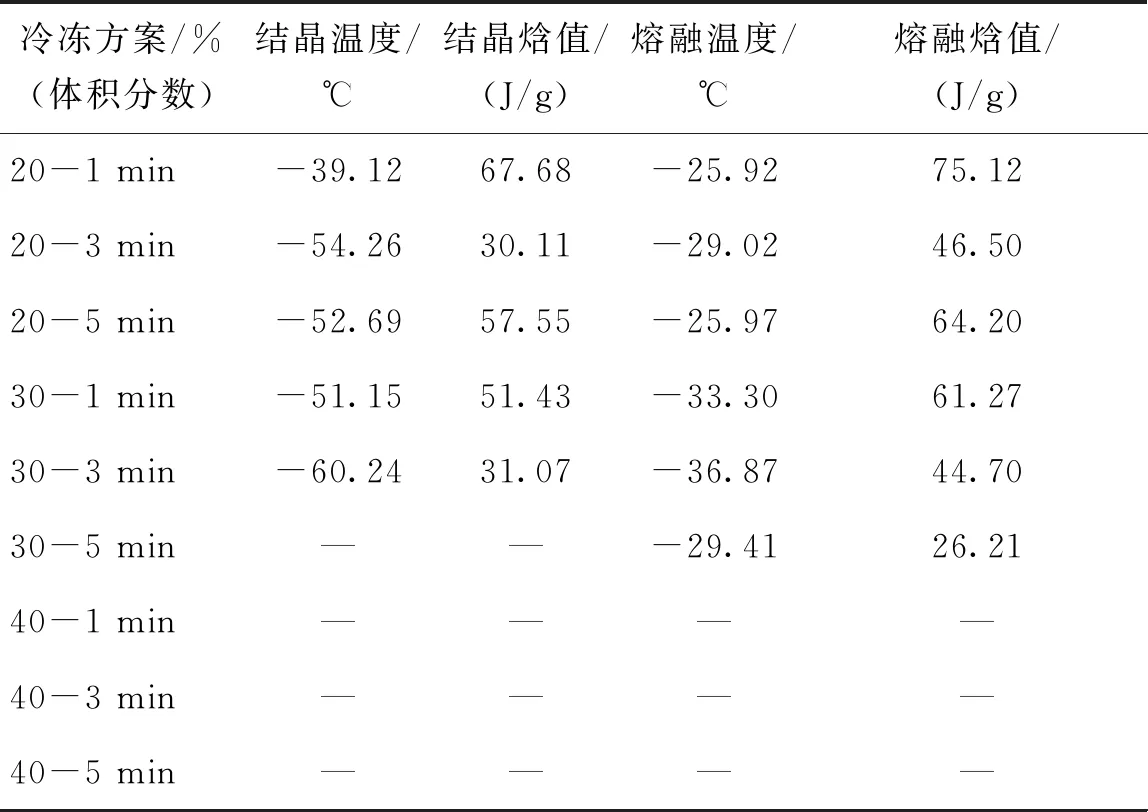
表2 睪丸組織在不同保護劑加載方案后的熱分析
1.4 睪丸組織的量熱分析
采用差示掃描量熱儀(DSC200 F3,Netzsch,德國)進行熱分析,實驗前進行溫度和靈敏度校準。實驗每組取約9 mg小鼠睪丸組織,按照兩步法保護劑加載方案在對應的保護劑溶液中平衡對應時間后,將組織放置于吸水紙上停留3 s吸取組織表面殘留溶液,然后將組織平鋪于鋁坩鍋中,將鋁坩鍋及參皿放入分析腔,以100 ℃/min的降溫速率將樣品溫度降至-150 ℃,然后以100 ℃/min的升溫速率將樣品加熱至室溫25 ℃。根據升降溫的熱流曲線記錄每組升降溫過程中的結晶溫度、結晶焓、融溶溫度及熔融焓。每組實驗重復3次。
1.5 睪丸組織玻璃化冷凍
玻璃化塑料載片(郜鴻生物科技有限公司,上海)由帶有標圈的塑料薄片及手柄組成,為方便在液氮中移動操作,用鐵絲將其固定。玻璃化冷凍實驗步驟如圖1所示。實驗分9組,每組取1/3個睪丸,分別按照9種保護劑加載方案在對應的保護劑溶液中平衡對應時間,加載完成后吸去多余保護劑溶液,將睪丸組織平鋪于冷凍載片上,隨后迅速投入液氮保存。1 h后依次取出,將含有組織的一端浸入提前預熱至37 ℃的復蘇溶液中,組織解凍從載片脫落后繼續平衡1 min,將組織轉移至洗滌溶液1中平衡3 min,然后轉移至洗滌溶液2中繼續平衡5 min,隨后取出用DF12洗滌2~3次,放入含有體積分數為10%的FBS的DF12溶液的孔板內,放置于CO2培養箱培養6 h。
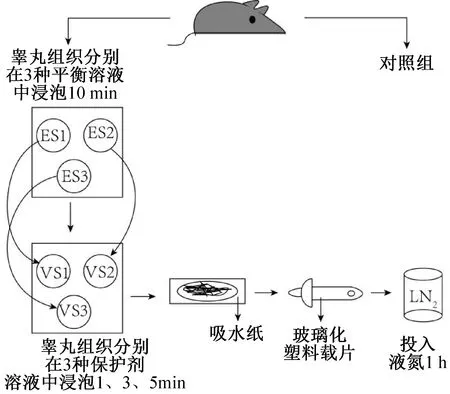
圖1 玻璃化冷凍步驟
1.6 睪丸組織慢速冷凍程序
郭瑩瑩[15]對睪丸組織的慢速冷凍方法進行了優化,其慢速冷凍保護劑按照體積分數配置為:10% DMSO+10%FBS+0.1 mol/L蔗糖+DF12。首先在1.8 mL凍存管中裝入1 mL慢速冷凍保護劑,然后取半顆小鼠睪丸放入凍存管中,最后將小鼠睪丸組織以改進兩步法在程序降溫儀(CryoMed Freezer 7453, Thermo Fisher Scientific, USA)中進行冷凍。改進兩步法冷凍程序為:1)4 ℃停留10 min以加載低溫保護劑;2)1 ℃/min降至-40 ℃,停留1 min;3)快速取出投入液氮。復溫時從液氮中快速取出凍存管,置于37 ℃恒溫水浴鍋復溫,至冰晶融化。然后將冷凍管中的組織塊取出,放入1 mL的培養液中10 min去除保護劑,并用培養液洗滌3次。將組織放入裝有1 mL培養液的孔板內,放置于CO2培養箱培養6 h。
1.7 睪丸組織的凍存效果評價
睪丸組織形態以及生精小管內部結構完整性主要通過HE染色評價。半定量評估切片組織的管腔完整性,正常結構評分為1,管腔受到損傷結構評分為0。當觀察到以下結構變化時結構評分為0∶1)精原細胞從基底膜分離;2)基底膜破裂;3)小管內出現體積較大的空泡;4)小管內空泡面積超過單根小管截面積的40%。最終管腔完整率計算方法見式(1),每個實驗組分別取3組平行,最終取平均值。
管腔完整率=
(1)
冷凍復溫后睪丸組織的凋亡水平采用Tunel試劑盒進行檢測。按照試劑盒的說明進行組織染色,染色后在熒光顯微鏡下觀察細胞著色情況,顯色后陽性凋亡細胞核為棕黃色,存活細胞核顯藍色。在生精小管內,根據細胞形態學方法(細胞形狀、核致密性和相對于基底膜的位置等)來確定各種細胞類型[16]。分別計算各類細胞總數及各類細胞凋亡數量,各生精細胞Tunel陰性率通過式(2)計算,每個實驗組分別取3組平行,最后取平均值。
(2)
2 結果與討論
2.1 睪丸組織不同方案加載保護劑后的熱分析
將睪丸組織按照9種保護劑加載方案在對應的保護劑溶液中平衡對應時間,然后運用差示掃描量熱儀記錄浸泡后組織在降溫和升溫過程中的熱現象,睪丸組織相應的結晶溫度、結晶焓、熔融溫度及熔融焓如表2所示,典型的熱流曲線如圖2所示。
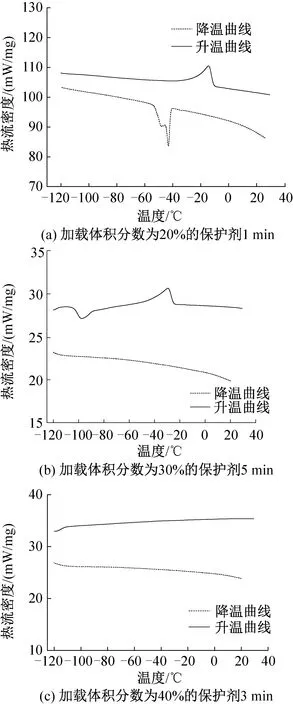
圖2 睪丸組織凍融過程的熱流曲線
在體積分數為20%的DMSO溶液中浸泡1、3、5 min后,典型熱流曲線如圖2(a)所示,降溫過程中有明顯結晶峰,升溫過程中有明顯融化峰。對比睪丸組織在體積分數為20%組保護劑中浸泡3 min及1 min的數據,3 min組相變溫度降低,結晶焓值和熔融焓值均有所降低,說明升降溫過程中形成的冰晶量減少。因此適當延長加載時間,可加強保護劑的跨膜運輸,使組織在降溫過程中抑制組織內冰晶形成的能力升高,減小組織內部冰晶形成量。而當浸泡時間延長至5 min時,熔融焓值為64.2 J/g,低于1 min組,但高于3 min組,說明5 min組在升降溫過程中形成的冰晶量高于3 min組。已有研究證實,細胞在保護劑溶液中浸泡時,在滲透壓差的作用下先失水皺縮,體積減小至最小值后將吸水恢復部分體積[6],組織在浸泡5 min后可能正經歷吸水膨脹過程,組織內保護劑體積分數低于20%,使組織內形成冰晶量增大。
在體積分數為30%的DMSO溶液中浸泡3 min后的睪丸組織,降溫過程中相變溫度及結晶焓值均小于1 min組,說明浸泡3 min后的組織內冰晶形成量小于1 min組。當浸泡時間為5 min時,熱流曲線如圖2(b)所示,在降溫過程中未出現明顯結晶峰,實現了玻璃化;但升溫過程中,在-103.42 ℃出現反玻璃化現象,結晶焓值為11.47 J/g, 在-29.41 ℃反玻璃化形成的冰晶開始融化,熔融焓值為26.21 J/g。
在體積分數為40%的DMSO溶液中浸泡1、3、5 min后,典型熱流曲線如圖2(c)所示,在降溫過程中均未出現結晶峰,在復溫過程中也未出現反玻璃化現象,成功在降溫及升溫過程中實現玻璃化。原因可能在于體積分數為40%的DMSO保護劑濃度較高,組織內外滲透壓差較大,促進了水及保護劑的跨膜運輸,在短時間內使組織內濃度升高至玻璃化水平,因此在升降溫過程中均未出現結晶現象。
2.2 睪丸組織不同加載方案玻璃化凍存結果
將睪丸組織按照9種保護劑加載方案在對應的保護劑溶液中平衡對應時間,放在塑料載片上投入液氮中進行玻璃化冷凍保存,對凍后睪丸組織進行HE及Tunel染色,不同加載方案玻璃化的凍后管腔完整率及細胞凋亡陰性率如表3所示。
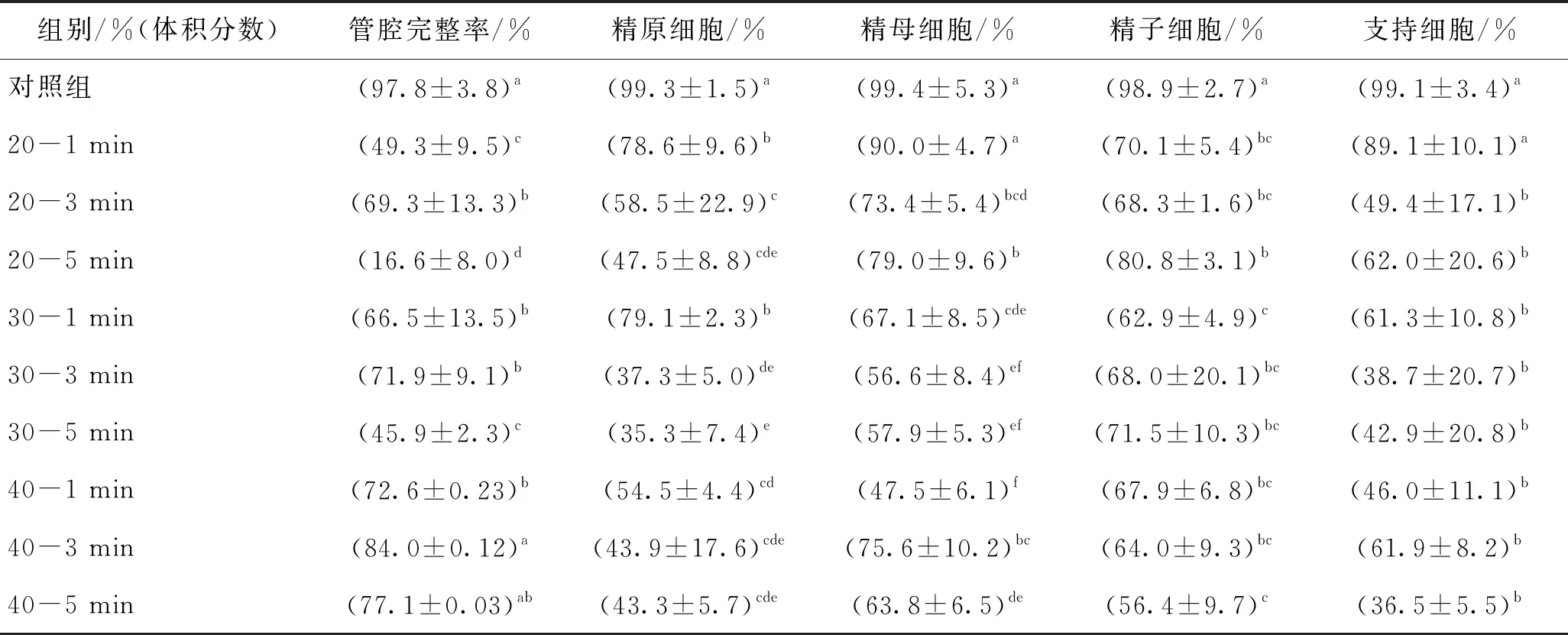
表3 不同加載方案玻璃化的凍后管腔完整率及細胞凋亡陰性率
由表3可知,當DMSO體積分數為20%時,浸泡3 min凍后睪丸組織管腔完整率為69.3%,高于1 min及5 min組。對比表2中的熱分析數據,浸泡3 min后的睪丸組織熔融焓值低于1 min及5 min組,說明3 min組在降溫過程中抑制組織內形成冰晶的能力較高,對管腔造成的機械損傷較小。此外,雖然DSC結果顯示睪丸組織浸泡5 min后的結晶量低于1 min,但睪丸組織在保護劑溶液中長時間浸泡受到了較大的毒性損傷,導致5 min組管腔完整率低于1 min組。對比體積分數為20%的DMSO溶液中浸泡不同時間后凍融后的精原細胞凋亡情況,可以得出,隨著浸泡時間的增加,精原細胞凋亡率顯著增加。這可能是由于精原細胞位于管腔外周,其凋亡率易受管腔外溶液影響,與高體積分數保護劑溶液接觸時間越長,精原細胞受到的毒性損傷越大。而精子細胞隨浸泡時間呈現的凋亡規律與精原細胞相反,隨著浸泡時間的增加,精子凋亡率下降。精子位于生精小管內部,組織內細胞種類復雜,且生精小管呈圓柱形,體表比值較大,對保護劑的滲透率較低,因此加載時間越長,保護劑滲透傳質行為進行得越充分,越能實現對內部精子的保護作用。
當DMSO體積分數為30%時,浸泡3 min管腔完整率為71.9%,高于 1 min及5 min組。對比表2,睪丸組織在30%DMSO中浸泡3 min相比于1 min組結晶量降低,說明相較于浸泡1 min,浸泡3 min后組織在凍融過程中受到的冰晶機械損傷較小,因此管腔完整率較高。而5 min組在DSC熱分析中顯示可在降溫過程中實現非晶態固化,但在升溫過程中出現了反玻璃化現象。G. M. Fahy等[17]研究指出復溫過程中的反玻璃化現象,極易造成細胞在復溫過程中死亡。對于大體積樣本而言,升溫速率難以提高,若在復溫過程中造成重結晶,將對細胞帶來致命傷害。因此受反玻璃化影響,浸泡5 min組的管腔完整率僅為45.9%,顯著低于3 min組。體積分數為30%組的凍后精原細胞及精子凋亡規律與體積分數為20%實驗組相似,位于管腔外側的精原細胞凋亡率隨浸泡時間的增加而增加,而位于管腔中心的精子細胞凋亡率隨加載時間增大而減小。
當DMSO體積分數為40%時,浸泡3 min后的管腔完整率(84%)高于1 min及5 min組。相比于對照組,在體積分數為40%的DMSO溶液中睪丸組織凍后精原細胞凋亡率顯著提高,不同浸泡時間后的精原細胞凋亡情況無顯著性差異。此外,由于體積分數為40%的DMSO濃度較高,組織內外的滲透壓差較大促進了傳質速率,因此,保護劑滲透至管腔內部的所需時間較短,隨加載時間增加,管內精子與高體積分數保護劑接觸時間增加,因此精子凋亡率隨浸泡時間增加呈上升趨勢。
綜合分析可知,在相同的浸泡時間下,管腔完整率隨保護劑體積分數的增加而增加。同時,相同浸泡時間下,高體積分數組的生精細胞凋亡率高于低體積分數組,雖然高體積分數保護劑可以促進組織內形成玻璃態,但高體積分數保護劑帶來的較大毒性損傷使得組織內細胞凋亡率顯著高于低體積分數組。現有研究表明,細胞的損傷與CPA的滲透和毒性作用有關[18]。J. D. Benson等[19]建立了積累性毒性損傷模型J,表明加載時間越長細胞所受累積性毒性損傷越大。現有研究多采用HE染色結果分析生精小管的組織的形態學完整性[18],但該方法的所得管腔完整率被證實還不能確切地評估睪丸組織內生殖細胞功能[20-21]。J. P. Milazzo等[21]表明Tunel染色所測定的細胞凋亡與睪丸組織功能喪失成正相關。因此,綜合考慮幾種生殖細胞的凋亡陰性率,篩選出運用塑料載片進行的睪丸組織玻璃化實驗中,加載最優方案為體積分數為20%的DMSO保護劑加載1 min。現有研究[7-10,22]多認為高濃度保護劑對玻璃化凍存睪丸組織的效果優于低濃度保護劑。這可能是因為他們采用凍存管實現“玻璃化”,凍存體積較大,且凍存管管壁材質傳熱性能較低,導致組織在降溫過程中可實現的降溫速率較低,因此需要高濃度保護劑與低降溫速率相匹配。而本實驗所用冷凍載體為塑料薄片,提高了降溫速率,且組織在裝載前用吸水紙吸去表面多余保護劑,減小了冷凍體積,所需保護劑濃度降至體積分數為20%,并因此降低了細胞所受毒性損傷。
2.3 玻璃化凍存與慢速凍存的結果對比
將上述玻璃化凍存最優結果與郭瑩瑩[15]之前優化的睪丸組織慢速冷凍結果進行對比,如表4所示。慢速冷凍保存睪丸組織管腔完整率高于玻璃化組,生殖細胞凋亡陰性率均顯著高于玻璃化組,且與對照組無顯著性差異。B. S. Pukazhenthi等[23]研究指出凍存方法將影響凍后異種移植效果,對于新生羔羊睪丸組織,慢速冷凍保存優于快速及玻璃化凍存。C. Yildiz等[7]在凍后移植小鼠睪丸組織,結果表明慢速冷凍可維持支持細胞產生雄激素能力,而玻璃化組移植后支持細胞產生激素能力顯著降低。然而,S. F. Moraveji等[22]將小鼠睪丸組織在體積分數為7.5%的EG+體積分數為7.5%的DMSO中浸泡10 min后轉移至體積分數為15%的EG+體積分數為15%的DMSO中浸泡2 min,裝載于凍存管投入液氮,組織凍后管腔完整率達79%,顯著高于常用慢速冷凍組(62%)。M. Abrishami等[24]對比了慢速冷凍與固體表面玻璃化冷凍對小鼠睪丸組織低溫保存的影響,結果顯示,以DMSO作為保護劑時,在玻璃化溶液中浸泡5 min后的固體表面冷凍組織細胞存活率(80%)優于慢速冷凍組(75%)。由以上對比可知,現有研究由于樣本體積、載體類型、保護劑種類與濃度及加載方案等因素的不同,對玻璃化和慢速冷凍兩種凍存方法的對比并未得出統一的結論。
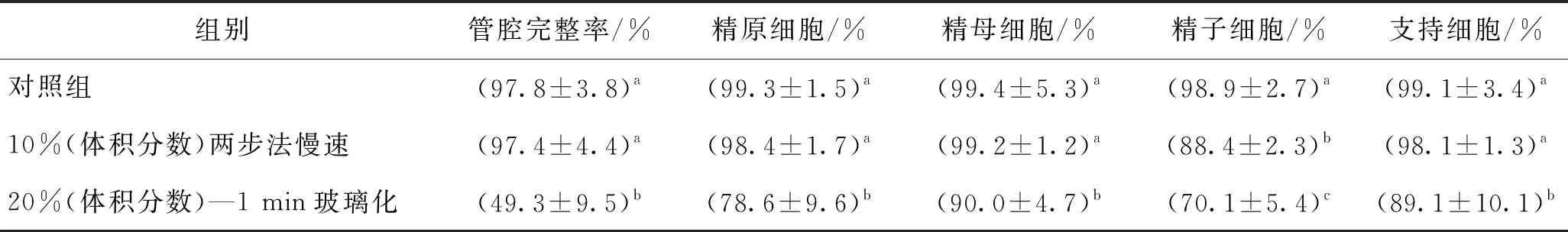
表4 玻璃化與慢速冷凍方法的凍后管腔完整率及細胞凋亡陰性率
慢速冷凍通過使用較低濃度保護劑使得在降溫過程中在組織外形成冰晶以使細胞脫水,從而降低細胞內結晶的幾率。郭瑩瑩[15]對常用的睪丸組織慢速冷凍方法進行改進,提出了改進的兩步法冷凍方案,減小了保護劑加載時間,提高了慢速冷凍兩個階段的降溫速率,且慢速冷凍最優組所需保護劑濃度較低(體積分數為10%的DMSO)。而玻璃化凍存是讓高濃度保護劑中的細胞在降溫速率較高的情況下胞內形成玻璃態,理論上避免了胞內冰晶的形成以減小對細胞的冰晶損傷。但高體積分數保護劑造成的較大毒性損傷限制了組織浸泡時間,且組織對保護劑的滲透能力低于單細胞,在有限的浸泡時間內組織內保護劑濃度難以達到玻璃化所需濃度,加上睪丸組織由于自身形成了較大熱阻,在冷凍過程中降溫速率難以提高至與單細胞相同的高降溫速率,因此在實際降溫過程難以實現完全玻璃化,在20%(體積分數)-1 min的DSC熱分析中同樣顯示,降溫過程中將出現組織內冰晶。因此,如果用并未實現完全玻璃化的結果和慢速冷凍結果進行對比,來評價玻璃化方法相比于慢速冷凍方法的優劣是不合適的,但我們可以認為,在目前的冷凍條件下,慢速冷凍更適用于塊狀睪丸組織凍存。
3 結論
本文對小鼠塊狀睪丸組織的玻璃化保存方法進行了研究,運用差示掃描量熱儀,對在不同體積分數保護劑中浸泡了不同時間后的小鼠塊狀睪丸組織進行熱分析,隨后對其進行玻璃化凍存,并將睪丸組織慢速冷凍保存與玻璃化凍存進行了對比,得到如下結論:
1)低體積分數保護劑組在降溫過程中檢測到了組織內冰晶形成,而高體積分數保護劑組在降溫過程中實現了玻璃化冷凍,未有冰晶形成。
2)以生精細胞的凋亡陰性率為依據,篩選出體積分數為20%DMSO保護劑溶液中浸泡1 min后進行玻璃化凍存為最優玻璃化加載方案,其凍后各生殖細胞凋亡陰性率分別為精原細胞78.6%,精母細胞90%,精子細胞70.1%,支持細胞89.1%。
3)與玻璃化凍存相比,慢速冷凍保存更能維持睪丸組織的凍后形態學完整性,并減小凍后生精細胞的凋亡率,是更適用塊狀睪丸組織冷凍的方法。
本文受上海市促進市級醫院臨床技能與臨床創新能力三年行動計劃重大臨床研究項目(SHDC2020CR3077B)資助。(The project was supported by Clinical Research Plan of Shanghai Hospital Development Center(No.SHDC2020CR3077B).)

