老年營養風險指數聯合血清補體C3水平在維持性血液透析患者腹主動脈鈣化評估中的價值
李佳,王玉,劉怡彤,周路路,孫杰,魏善齋
1 南京中醫藥大學沭陽附屬醫院營養科,江蘇 沭陽 223600;2 南京中醫藥大學沭陽附屬醫院腎內科
維持性血液透析(MHD)是終末期腎臟病(慢性腎臟病Ⅴ期)患者腎臟替代治療的主要方式[1]。我國MHD 患者5 年生存率僅42.2%,并發心血管不良事件是MHD患者死亡的主要原因之一,與血管鈣化密切相關[2-3]。營養不良、炎癥與血管鈣化的形成和進展關系密切[4-5]。慢性腎臟病患者因蛋白質能量消耗大多存在營養不良,老年營養風險指數(GNRI)是BOUILLANNE 等[6]于2005 年編制的用于老年患者營養評估工具。近年研究證實,GNRI 可作為MHD 患者長期營養狀態的監測工具[7]。補體C3為補體系統各成分含量最多的補體,活化后促進多種促炎細胞因子表達,加重炎癥反應。既往研究報道,血液透析會導致補體系統激活[8]。目前關于GNRI和補體C3與MHD 血管鈣化的關系尚不明確。2019年1 月—2021 年5 月,我們探討了GNRI 和血清補體C3水平在MHD 患者腹主動脈鈣化(AAC)評估中的價值。現報告如下。
1 資料與方法
1.1 臨床資料 選取2019 年1 月—2021 年5 月南京中醫藥大學沭陽附屬醫院收治的232 例MHD 患者。納入標準:①符合《慢性腎臟病篩查診斷及防治指南》[9]慢性腎臟病診斷標準;②慢性腎臟病Ⅴ期[10];③接受MHD,持續時間>6 個月;④年齡≥18歲;⑤病歷資料完整。排除標準:①合并嚴重感染者;②已行其他腎臟替代治療者;③合并惡性腫瘤者;④合并血液、免疫系統障礙者;⑤近1 周內輸注白蛋白或其他血液制品者;⑥近1 個月內急性心腦血管事件者;⑦近3 個月內激素或免疫抑制劑使用者。本研究患者及家屬均知情并簽署同意書,經醫院倫理委員會批準(20210214)。
1.2 資料收集和生化指標檢測 收集MHD患者基線資料,包括性別、年齡、體質量指數、病因。采集患者入院后次日清晨空腹靜脈血,3 000 r/min 離心10 min(半徑8 cm),取上層血清,用貝克曼庫爾特AU5800全自動生化分析儀檢測總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血鈣、血磷、全段甲狀旁腺素(iPTH)、白蛋白、血肌酐、血尿酸、血尿素氮。放射免疫擴散法檢測血清補體C3,試劑盒購自上海古朵生物科技有限公司,所有操作嚴格按試劑盒說明進行。
1.3 GNRI計算 根據BOUILLANNE 等[6]制定的公式計算MHD患者GNRI=1.489×白蛋白(g/L)+41.7×(實際體質量/理想體質量),男性理想體質量(kg)=身高(cm)-100-{[身高(cm)-150]/4};女性理想體質量(kg)=身高(cm)-100-{[身高(cm)-150]/2.5}。當MHD 患者實際體質量<理想體質量時使用兩者比值結果,當MHD 患者實際體質量>理想體質量時記為1,GNRI越高表示營養風險越低。
1.4 AAC 評估和分組 所有MHD 患者采用瑞典RAYSAFE X2 醫用X 射線機行腹部側位X 線片檢查,參考KAUPPILA 等[11]制定的AAC 半定量積分法評估第1~4 節腰椎對應腹主動脈前壁、后壁鈣化斑塊長度:無鈣化為0分;鈣化長度<1/3動脈壁長度為1 分;鈣化長度1/3~2/3 動脈壁長度為2 分;鈣化長度>2/3 動脈壁長度為3 分;總分1~4 節腰椎對應腹主動脈前壁、后壁鈣化斑塊長度得分之和(0~24分)。根據是否存在AAC 將MHD 患者分為鈣化組(n=165)與無鈣化組(n=67)。并根據AAC 評分將鈣化組分為重度鈣化組(n=48,>15分)、中度鈣化組(n=55,6~15分)、輕度鈣化組(n=62,1~5分)。
1.5 統計學方法 采用SPSS26.0統計軟件。計數資料以例(%)表示,比較采用χ2檢驗;服從正態分布的計量資料以-x±s表示,兩組間比較采用t檢驗;偏態分布計量資料以中位數和四分位數[M(P25,P75)]表示,兩組間比較采用Z檢驗,多組間比較采用H檢驗,組間兩兩比較Bonferroni 校正;相關性采用Spearman 相關系數分析;影響因素分析采用多因素Logistics 回歸分析;預測價值分析采用受試者工作特征(ROC)曲線,曲線下面積(AUC)比較采用Z檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 鈣化組與無鈣化組基線資料和GNRI 及血清補體C3水平比較 鈣化組年齡大于無鈣化組,體質量指數、白蛋白、GNRI低于無鈣化組,透析時間長于無鈣化組,LDL-C、血磷、iPTH、補體C3水平高于無鈣化組(P均<0.05)。見表1。
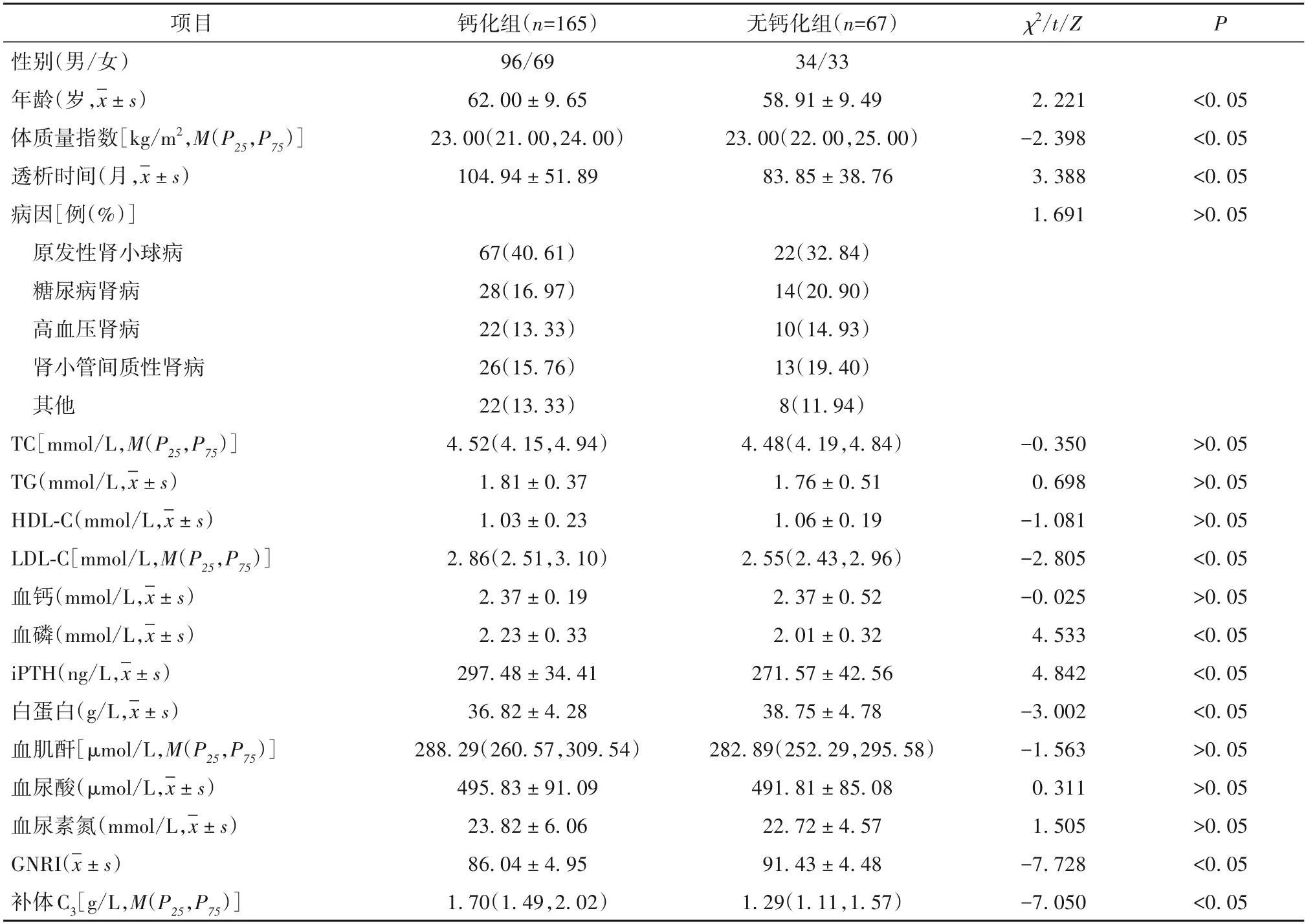
表1 鈣化組與無鈣化組基線資料和GNRI及血清補體C3水平比較
2.2 不同AAC 程度MHD 患者GNRI 和血清補體C3水平比較 輕度、中度、重度鈣化組GNRI依次降低,血清補體C3水平依次升高(P均<0.05)。見表2。
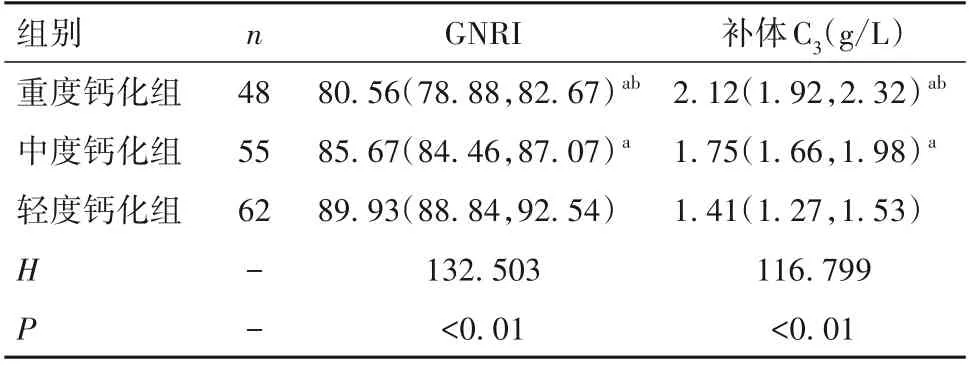
表2 不同AAC程度MHD患者GNRI和血清補體C3水平比較[M(P25,P75)]
2.3 鈣化組GNRI 和血清補體C3水平與AAC 評分的相關性 鈣化組AAC 評分為7.00(3.00,17.00)分,Spearman 相關系數顯示,鈣化組GNRI 與AAC 評分呈負相關(rs=-0.827,P<0.01),血清補體C3水平與AAC評分呈正相關(rs=0.779,P<0.01)。
2.4 MHD 患者ACC 影響因素的多因素Logistic 回歸分析 以年齡、體質量指數、透析時間、LDL-C、血磷、iPTH、白蛋白、GNRI、補體C3為自變量,是否合并ACC(是=1,否=0)為因變量,建立多因素Logistic 回歸模型。結果顯示,透析時間、血磷、iPTH、補體C3是獨立危險因素,白蛋白、GNRI 是MHD 患者ACC的獨立保護因素(P均<0.05)。見表3。
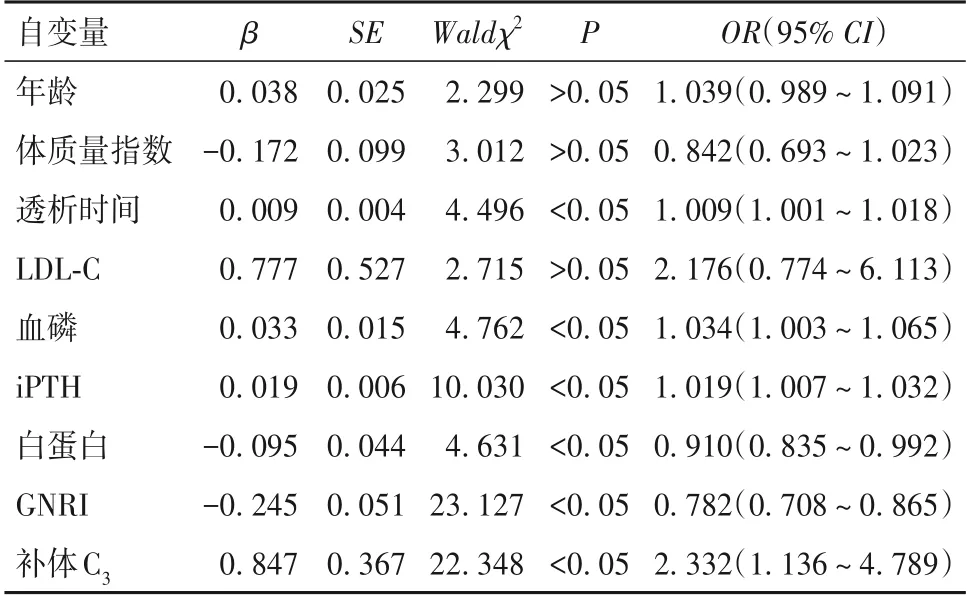
表3 MHD患者ACC影響因素的多因素Logistic回歸分析
2.5 GNRI 和血清補體C3水平對MHD 患者ACC 的預測價值 ROC 曲線分析顯示,GNRI、補體C3、GNRI+補體C3預測MHD 患者ACC 的AUC分別為0.793、0.795、0.868,GNRI+補體C3預測AUC大于GNRI、補體C3單獨預測(Z分別為2.899、2.924,P均<0.05)。見表4。
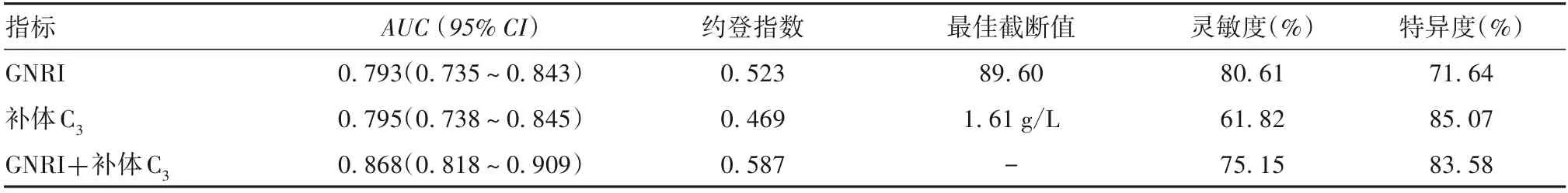
表4 GNRI和血清補體C3水平對MHD患者ACC的預測價值
3 討論
目前我國接受MHD 的患者達70 萬例,盡管血液透析技術經過幾十年的發展已較為成熟,但隨著透析時間延長,各種原因可引起血液動力學變化,增加心血管不良事件風險[12]。除經典高齡、高血脂等心血管疾病危險因素外,因嚴重高磷血癥導致的血管鈣化是慢性腎臟病患者心血管不良事件發生的重要原因,隨著血管鈣化,血管壁僵硬度和脆性逐漸增加,增加血管壁破裂和血栓形成概率,進而引起心血管不良事件,因此指南建議每6~12 個月對慢性腎臟病患者進行一次心血管鈣化診斷和評估[13]。但目前臨床主要通過血管成像、血管彩超診斷血管鈣化,動態評估功能受限,亟需尋找簡便的診斷方式。
血管鈣化與炎癥反應密切相關,血管壁炎癥能激活血管上成骨標志物及相關信號通路,促進血管平滑肌細胞向成骨細胞表型轉化,促進血管鈣化發生[14]。蛋白質能量消耗是指體內能量和蛋白儲備減少狀態,終末期腎病患者因腎臟排泄和清除功能喪失,蛋白質分解速度加快加之低蛋白飲食,不能滿足機體代謝所需,因此患者營養不良癥狀明顯[15]。研究表明,炎癥反應是蛋白質能量消耗的重要組成部分[16]。而炎癥反應是血管鈣化的病理生理機制之一,MHD 患者營養不良與血管鈣化是否有關尚不明確。GNRI最初應用于老年住院患者營養風險篩查,近年研究表明,GNRI 亦適用于MHD 患者營養風險篩查[7,17]。本研究結果顯示,鈣化組GNRI 低于無鈣化組,提示MHD 合并ACC 患者存在明顯營養不良。進一步分析顯示,輕度、中度、重度鈣化組GNRI 依次降低,與AAC 評分呈負相關,說明GNRI隨著ACC程度的加重而降低,進一步說明營養不良與MHD合并ACC 有關。我們通過多因素Logistic 回歸分析也證實,即使在調整年齡、體質量指數、透析時間、LDL-C、血磷、iPTH、白蛋白后,高GNRI 仍然是MHD患者ACC 的獨立保護因素,證實營養不良與MHD合并ACC 密切相關。分析與MHD 患者營養不良是一種微炎癥狀態有關。營養不良會降低機體抵抗力,增加感染風險,導致炎癥持續存在,同時炎癥亦能通過抑制胃腸系統的消化吸收,降低食欲,并增加肌肉蛋白和水解蛋白分解,導致營養不良[18]。研究表明,透析患者營養不良可通過炎癥反應影響血管內皮功能,促進動脈粥樣硬化,動脈粥樣硬化又能通過促進炎癥因子產生導致營養不良,三者互為關聯,共同促進血管鈣化發生[19]。ROC 曲線分析顯示,GNRI 預測MHD 患者ACC 的AUC為0.793,說明GNRI 可作為MHD 患者ACC 預測指標,但預測價值并不理想,考慮與GNRI 計算中白蛋白和體質量易受MHD 患者炎癥、水腫等非營養因素影響有關,有必要聯合其他非營養危險因素提升預測價值。
補體系統為機體免疫重要組成部分,生理狀態下能排除異己、保護機體,病理狀態下過度激活,可引起免疫病理性損傷,促進多種病理進程。補體C3是補體經典途徑和旁路途徑的關鍵物質,是公認最有效的促炎因子,過度激活能促進白細胞介素-1、白細胞介素-6、腫瘤壞死因子-α等促炎因子表達,并能與炎性細胞上的受體互補,增強其黏附功能,促進炎癥發展[20]。本研究結果顯示,鈣化組血清補體C3水平高于無鈣化組,提示補體C3可能參與MHD 患者ACC 發生。進一步分析顯示,輕度、中度、重度鈣化組血清補體C3水平依次升高,與AAC 評分呈正相關,說明補體C3水平隨著ACC 程度的加重而升高,分析是MHD 患者因血液與體外循環材料之間的接觸導致補體激活,引起補體C3大量合成,通過促炎反應參與血管鈣化[21]。多因素Logistic 回歸分析證實,補體C3水平升高是MHD 患者ACC 的獨立危險因素,說明補體C3水平升高與MHD 患者ACC 發生密切相關。血管鈣化多出現于動脈粥樣硬化基礎上,近年多項研究均顯示,補體C3是動脈粥樣硬化發生發展關鍵因素[22-23]。補體C3被C3轉化酶酶切后可形成C3a和C3b,既往研究報道破骨細胞衍生的C3a可刺激骨重塑中的成骨細胞分化[24]。本研究多因素分析結果表明,透析時間為MHD 患者ACC 的獨立危險因素,可能原因是隨著透析時間延長,血液動力學變化大,高磷血癥、慢性炎癥、氧化應激等多種過程能促進血管鈣化發生[12]。本研究結果顯示,高血磷和iPTH 是MHD 患者ACC 的獨立危險因素,進一步證實上述觀點。本研究結果顯示,白蛋白為MHD患者ACC 的獨立保護因素,白蛋白是維持機體營養的主要物質之一,白蛋白降低反映機體營養不良,因此我們分析低白蛋白可能通過炎癥促進血管鈣化發生[25]。ROC 曲線分析顯示,補體C3水平預測MHD患者ACC 的AUC為0.795,說明補體C3也可作為MHD 患者ACC 預測指標,同時GNRI+補體C3預測AUC為0.868,大于GNRI、補體C3單獨預測,說明聯合檢測能提升ACC預測價值。
綜上所述,GNRI 降低和血清補體C3水平升高是MHD 患者ACC 獨立危險因素,與MHD 患者ACC程度相關,可作為MHD患者ACC的預測指標。

