阻塞性睡眠呼吸暫停低通氣綜合征合并夜間心律失常患者對無創通氣治療的反應報告
張偉 馮軍軍 余泳波 王莞爾
(北京大學國際醫院睡眠中心,北京,102206)
阻塞性睡眠呼吸暫停低通氣綜合征(Obstructive Sleep Apnea-hypopnea Syndrome,OSAHS)是一種常見的睡眠呼吸障礙疾病,臨床上主要以夜間打鼾、憋氣、日間困倦等表現為主,與多種慢性疾病的發生、發展緊密相關。常合并高血壓、糖尿病、心腦血管疾病等慢性疾病及認知功能受損[1]。流行病學調查顯示成人中OSAHS患病率為2%~4%。OSAHS可以引起并加重高血壓、2型糖尿病及胰島素抵抗、腦卒中、冠心病、心律失常、心力衰竭等,故引起許多學科的關注[2]。臨床醫生發現OSAHS患者的心律失常發生率高、危害大,嚴重時引起夜間猝死,該心律失常的診斷及治療有自身的特點,需臨床醫生高度重視[3]。OSAHS患者夜間常見的心律失常包括:1)緩慢性心律失常:臨床研究已發現一半以上的重度OSAHS會出現包括竇性停搏、Ⅱ度房室傳導阻滯、頻發室性早搏及短陣性室性心動過速等心律失常[4-8],其中緩慢型心律失常最常見。2)心房顫動(房顫):研究證實,房顫與中度以上OSAHS相關[9]。Gami等[10]發現在151例房顫患者中,有49%被確診為OSAHS,在房顫復律后CPAP治療可以顯著降低房顫的復發率。本文旨在探討合并夜間心律失常的OSAHS患者經CPAP治療后呼吸暫停、低通氣及夜間心律失常的緩解情況和OSAHS患者夜間出現心律失常的發生機制。
1 資料與方法
1.1 一般資料 選取2015年1月至2021年5月就診于北京大學國際醫院睡眠中心,以打鼾、白天犯困為主訴的疑診OSAHS的患者,性別不限,年齡27~65歲。共納入40例符合標準的OSAHS合并心律失常患者做研究分析報告。
1.2 診斷標準 PSG每小時睡眠期間發生的阻塞性為主的呼吸事件(包括阻塞型呼吸暫停、阻塞型低通氣)AHI≥30次/h,診斷為重度OSAHS。心律失常診斷標準:1)Ⅱ度Ⅱ型(莫氏型):心電圖表現為PR間期固定,每隔一個或數個心動周期出現一個或數個心室漏搏,下傳心動周期的PR間期可正常或延長。2)Ⅲ度房室傳導阻滯:a.心房心室各自激動,互不相干,呈完全性房室分離。P-R間期不固定,心房率快于心室率。b.心房節律可以為竇性心律、房性心動過速、心房撲動或心房顫動。c.心室節律可以為房室交界區逸搏心律,心室率40~60次/min或室性逸搏心律,心室率20~40次/min。心室律一般規則,亦可不規則。3)竇性停搏:規則的P-P間距中突然出現P波脫落,形成長P-P間距,且長P-P間距與正常P-P間距不成倍數關系。竇性停搏后常出現逸搏或逸搏心律。
1.3 納入標準 1)滿足重度OSAHS診斷標準:AHI≥30次/h;2)PSG發現心律失常類型為夜間緩慢型心律失常或房撲、房顫者;3)既往無PSG檢查及CPAP治療經歷者。
1.4 排除標準 1)當天飲用酒、咖啡或對睡眠有影響的飲料者;2)服用抗心律失常藥物者;3)既往患有或PSG證實存在中樞性睡眠呼吸暫停綜合征者;4)急性心肌梗死、急性肺栓塞等重癥患者;5)有嚴重的肝、腎功能不全者;6)瓣膜性心臟病、酒精性心臟病、先天性心臟病者;7)合并其他不穩定的心腦血管疾病(如腦卒中、急性心肌梗死、癡呆)者;8)慢性阻塞性肺疾病患者;9)急性左心或右心功能不全者;10)接受氧療者;11)正在接受CPAP治療的OSAHS者;12)近3個月倒班工作、作息不規律者。
1.5 研究方法
1.5.1 資料收集 記錄年齡、性別、是否吸煙及飲酒、睡眠打鼾時間及有無心血管病家族史等;測量受試者身高、體質量、頸圍及腰圍,并計算體質量指數(Body Mass Index,BMI)。見表1。
1.5.2 監測指標 1)所有受試者使用飛利浦(PHLIPS A6)行整夜值守PSG;2)PSG證實符合重度OSAHS且合并緩慢型心律失常或房撲、房顫或頻發室性早博的患者安排同時行PSG和24小時Holter檢查;3)24小時Holter證實夜間存在Ⅱ-Ⅲ度房室傳導阻滯或竇性停搏或陣發性房撲、房顫或頻發室性早博,行CPAP治療(瑞思邁呼吸機,澳大利亞,S9,呼吸機模式:Auto-CPAP,SN22141213069),3天后行CPAP治療的同時復查PSG和Holter,觀察患者臨床癥狀、AHI、夜間平均氧飽和度、夜間心律失常改善情況。
1.5.3 睡眠監測方法 根據美國睡眠醫學會睡眠及相關事件判讀手冊的推薦記錄信號包括:腦電圖(F3-M2、F4-M1、C3-M2、C4-M1、O1-M2、O2-M1)、雙側眼動電圖、下頜肌電圖、口鼻溫度氣流、鼻壓力氣流、胸腹呼吸運動、心電圖、鼾聲、體位、雙側脛骨前肌電圖、脈搏氧飽和度和心率。
1.5.4 判讀標準 呼吸暫停是指睡眠過程中口鼻氣流消失或明顯減弱(較基線水平下降≥90%),持續時間≥10 s;低通氣是指呼吸氣流信號下降30%、持續時間≥10 s,同時伴血氧飽和度降低≥3%和或覺醒。
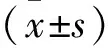
2 結果
2.1 40例患者一般資料比較 共計40例OSAHS合并心律失常患者均納入研究分析。治療前數據見表1。

表1 患者一般資料
2.2 CPAP治療前后比較 40例患者AHI、脈搏氧飽和度、ODI、覺醒指數比較。見表2。
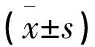
表2 CPAP治療前后40例患者AHI、脈搏氧飽和度、ODI、覺醒指數比較
2.3 行CPAP治療期間及治療后 行CPAP治療期間及治療后,40例患者復查PSG和24 h Holter,結果提示:40例患者打鼾、睡眠呼吸暫停及低通氣基本消失,AHI、平均夜間氧飽和度、夜間最低氧飽和度治療后與治療前比較,差異有統計學意義(P<0.05)。復查24小時Holter提示:25例Ⅱ度Ⅱ型房室傳導阻滯有20例完全消失,5例較前顯著減少,2例竇性停搏、8例陣發性房撲、房顫完全消失,5例頻發室早完全消失。40例患者中有32例堅持長期CPAP治療,隨訪患者至今,呼吸機使用依從性良好,多次復查Holter未見明顯心律失常。
3 討論
一直以來,OSAHS引發的夜間心律失常是睡眠醫學臨床關注的重點。研究顯示,對29例合并嚴重緩慢性心律失常的重度OSAHS患者進行心臟電生理學檢查,發現其竇房結及房室傳導功能并未出現異常[11]。在一項前瞻性分析中,房顫患者中大約50%存在阻塞型睡眠呼吸暫停,因此應當及時治療OSAHS以減少房顫復發及提高房顫的療效[12]。治療睡眠呼吸暫停也可以降低室性早搏及短陣室性心動過速的嚴重程度和發生率[13]。馬毓、溫華知等人在研究中發現重度OSAHS竇性心動過緩發生率顯著高于輕中度OSAHS患者[13]。郭輝、李學文研究也發現,隨著睡眠呼吸暫停的加重,心律失常的發生率逐漸增大,且緩慢性心律失常多見于重度OSAHS患者[14],與本研究結論相同。基于以上發現,人們對OSAHS引發緩慢性心律失常的機制進行了一系列研究,主要包括[2]:1)慢性間歇低氧和二氧化碳潴留;2)自主神經功能失調;3)氧化和抗氧化失調;4)睡眠結構紊亂;5)內分泌及代謝異常;6)血管內皮功能損壞;7)胸內壓大幅度波動。OSAHS患者睡眠期間的間歇低氧會損害竇房結功能,因此增加了異位起搏點的興奮性[15]。電生理檢查證實合并睡眠呼吸暫停的患者清醒時竇房結及房室傳導功能均正常,絕大多數患者給予阿托品治療后可以消除上述異常現象,揭示這些患者夜間發生緩慢性心律失常的原因可能是睡眠呼吸障礙引起的副交感神經張力增高[16]。
關于OSAHS患者發生房顫的機制,目前有:1)心房重構:Dimitri等[17]研究指出OSAHS能引起心房擴大、心房重構,導致心房纖維組織含量增加,長期OSAHS增加了房顫的易感性。2)炎癥反應:大量研究已證實OSAHS患者血清中有較高水平的炎癥介質,OSAHS誘導的機體炎癥狀態也是心房纖維化的重要介導者[18]。3)胸腔內壓力變化:OSAHS患者因為上氣道不同程度的阻塞,引起胸腔壓力增大,引起心房纖維化,同時跨壁壓力導致肺靜脈組織牽張和重構,易發生房顫。
本研究顯示40名患者白天動態心電圖未見緩慢性心律失常及房撲、房顫,可見偶發室性早搏,且白天均無眼前發黑、頭暈及暈厥等臨床癥狀,患者心律失常均發生于夜間,且均發生于呼吸暫停即將結束時,40例患者行CPAP治療后,復查PSG顯示呼吸事件消除良好,AHI及平均氧飽和度均恢復至正常,復查Holter顯示2例竇性停搏、8例陣發性房撲、房顫完全消失;25例Ⅱ度Ⅱ型房室傳導阻滯有20例完全消失,5例較前顯著減少,5例頻發室早完全消失。歐洲的一項多中心研究顯示:植入永久性心臟起搏器的患者中OSAHS患病率為59%[19]。因此對于出現夜間緩慢心律失常的OSAHS患者是否有必要植入心臟起搏器,對于臨床非睡眠專業的醫生提出了考驗。AHA(美國心臟病協會)/ACCF(美國心臟病學基金會)聯合專家共識建議[20]對于心臟傳導功能正常的OSAHS患者治療睡眠呼吸暫停應作為緩慢性心律失常一線治療的重要部分。對于擬行永久性心臟起搏器治療的緩慢性心律失常,特別是夜間緩慢心律失常發作為主者,需先行PSG或試驗性CPAP治療,部分患者可能會改變心臟起搏器治療的要求[21]。由于日常睡眠呼吸暫停非常常見,且對心血管系統有潛在損害,因此對擬行起搏器治療的患者進行睡眠呼吸暫停的規范評價非常必要。本研究臨床樣本量小,入選患者均為重度OSAHS,未入選輕、中度OSAHS患者,雖然患者治療效果理想,呼吸機使用依從性良好,夜間心律失常消失,但仍需要多樣本臨床研究進一步證實。

