黑木耳液體菌種培養基配方及培養條件優化*
盛立柱,葉松梅,葉曉菊,何建芬,文冬華,孫孔蘭,林火松
(1.龍泉市食藥用菌產業辦公室,浙江 龍泉 323700;2.浙江雙益菇業有限公司,浙江 龍泉 323700)
黑木耳(Auricularia heimuer F.Wu,B.K.Cui&Y.C.Dai),隸屬于擔子菌綱(Basidiomycetes)木耳目 (Auriculariaceae)木耳科 (Auriculariaceae)木耳屬(Auricularia),別稱黑耳、云耳、樹耳等[1]。黑木耳味道獨特,嫩口爽滑,營養豐富,被現代營養學家譽為“素中之葷”,世界上稱之為“中餐中的黑色瑰寶”[2],兼具食(藥)用價值,具有提高免疫力、抗凝血和抗腫瘤等保健效果和藥用功效,其營養價值豐富、味道鮮美且口感松脆,深受消費者喜愛[3]。
隨著集約化、機械化生產規模的日益擴大,以及黑木耳產業轉型升級的需求提升,液體菌種生產制作技術成為食用菌企業、合作社、菇農等的迫切需求,故對黑木耳液體菌種培養基配方進行篩選優化試驗,可為黑木耳產業轉型升級提供技術支持。
1 材料與方法
1.1 材料
菌種:選用的黑木耳菌種“黑山”來自龍泉市張良明菌種場。
斜面培養基:馬鈴薯200 g(去皮煮汁)、麩皮(煮汁)40 g、葡萄糖20 g、硫酸鎂1 g、磷酸二氫鉀2 g、瓊脂20 g,加水至1 L[4]。
液體培養基:去皮馬鈴薯200 g、麩皮30 g、碳源25 g、氮源25 g、磷酸二氫鉀2 g、硫酸鎂2 g、VB 10 mg,加純凈水至1 L,pH自然。
1.2 試驗方法
1.2.1 母種制備
在超凈工作臺上進行操作,挑取黑木耳木粒種,接種于PDA試管中,于25℃恒溫培養箱內避光培養。待菌絲長滿2/3試管斜面后,挑取邊緣2/3處,直徑為5 mm的菌塊轉接于PDA平皿中進行擴繁。繼續于25℃恒溫培養箱內避光培養,待菌絲長滿平皿后待用。
1.2.2 液體菌種培養方法
向250 mL搖瓶中加入100 mL液體培養基,接入6塊直徑5 mm大小的菌種塊,置于25℃恒溫搖床中,150 r·min-1振蕩培養6 d。
1.2.3 黑木耳菌絲體生物量測定
將培養好的菌絲體裝入離心管,于4 000 r·min-1離心機內離心5 min,85℃條件下烘干至恒重,記錄黑木耳菌絲體生物量,進行數據統計分析[5]。
1.2.4 不同碳源試驗
分別以葡萄糖、果糖、蔗糖、麥芽糖、玉米粉為碳源(2.5 g),以蛋白胨為氮源(2.5 g),其他成分不變(去皮馬鈴薯20 g、麩皮3 g、磷酸二氫鉀0.2 g、硫酸鎂0.2 g、VB 10 mg),配制供試培養基。于250 mL搖瓶中加入100 mL供試液體培養基,0.12 MPa、121℃高壓蒸汽滅菌30 min。參照參考文獻[6]的方法,待壓力降至0時,取出供試液體培養基,冷卻至室溫。在超凈工作臺內取6塊直徑5 mm的活化母種塊,接種于搖瓶內。后續試驗方法同1.2.2,培養6 d后測量菌絲體生物量。以不加碳源的培養基為對照,每個處理3次重復。
1.2.5 不同氮源試驗
分別以蛋白胨、酵母粉、麩皮、豆粕、硫酸銨為氮源(2.5 g),以葡萄糖為碳源(2.5 g),其余成分不變(去皮馬鈴薯20 g、麩皮3 g、磷酸二氫鉀0.2 g、硫酸鎂0.2 g、VB 10 mg),配制供試培養基。以不加氮源的培養基為對照,試驗方法同1.2.4。
1.2.6 無機鹽配比試驗
選用最佳碳源、最佳氮源,使用磷酸二氫鉀和硫酸鎂分別設置3個添加量配比。配比1為磷酸二氫鉀0.2%、硫酸鎂0.1%(比例為2∶1);配比2為磷酸二氫鉀0.3%、硫酸鎂0.3%(比例為1∶1);配比3為磷酸二氫鉀0.1%、硫酸鎂0.2%(比例為1∶2)。試驗方法同1.2.2,每個配比3次重復。
1.2.7 培養基配方優化試驗
根據單因素試驗結果,選用最佳碳源、最佳氮源、硫酸鎂和磷酸二氫鉀為影響因子,采用L9(34)法進行正交試驗。接種量5%、25℃、150 r·min-1恒溫振蕩培養6 d,測量黑木耳菌絲體生物量,確定黑木耳液體培養基最優配方。每個處理3次重復。
1.2.8 搖床培養溫度試驗
以篩選出的最優碳源、氮源、無機鹽比例配制好供試培養基,接種量5%,搖床轉速150 r·min-1,培養溫度設置23℃、24℃、25℃共3個試驗處理。每個處理3次重復,培養6 d。
1.2.9 搖瓶培養天數試驗
試驗以篩選的碳源、氮源和無機鹽比例配置供試培養基。接種量5%,最優培養溫度為1.2.8中篩選所得,150 r·min-1進行搖床培養,試驗設置為培養3 d、4 d、5 d、6 d共4個試驗處理,試驗方法同1.2.2,每個處理3次重復。
1.2.10 搖床轉速試驗
試驗以最佳的碳源、氮源和無機鹽比例配置好供試培養基,接種量5%,按25℃培養,搖床轉速設置 140 r·min-1、150 r·min-1、 160 r·min-1,3 個處理,培養6 d,試驗方法同1.2.2,每個處理3次重復。
2 結果與分析
2.1 不同碳源對黑木耳菌絲生物量的影響
不同碳源對黑木耳菌絲生物量的影響見表1。
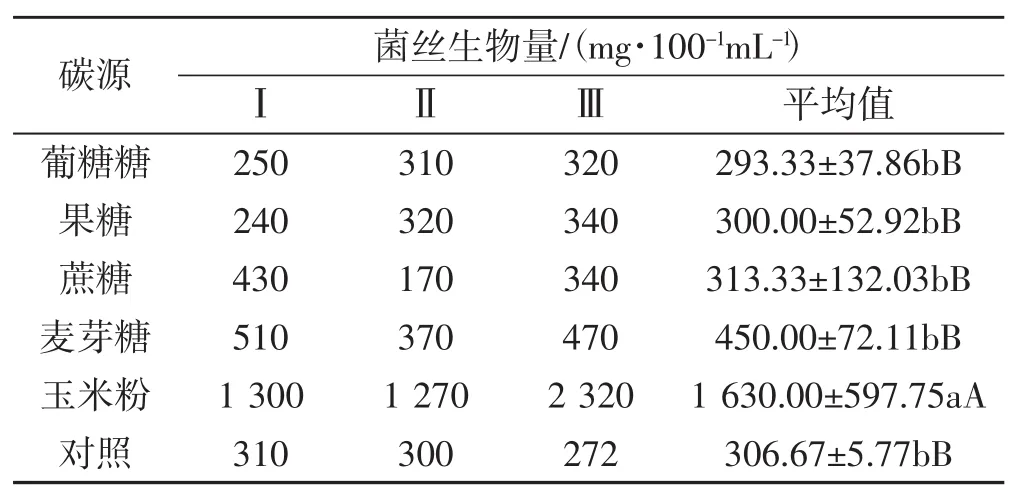
表1 不同碳源對黑木耳菌絲生物量的影響Tab.1 Effect of different carbon source on mycelial biomass of Auricularia heimuer
由表1可知,以玉米粉為碳源的試驗組菌絲生物量最高,平均達到1 630 mg·100-1mL-1;其次是麥芽糖、蔗糖,菌絲生物量分別達450 mg·100-1mL-1、313.33 mg·100-1mL-1;幾種碳源對黑木耳菌絲生物量影響的排序依次為玉米粉>麥芽糖>蔗糖>果糖>葡萄糖;其中葡萄糖和果糖效果較差,低于對照。
2.2 不同氮源對黑木耳菌絲生物量的影響
不同氮源對黑木耳菌絲生物量的影響見表2。
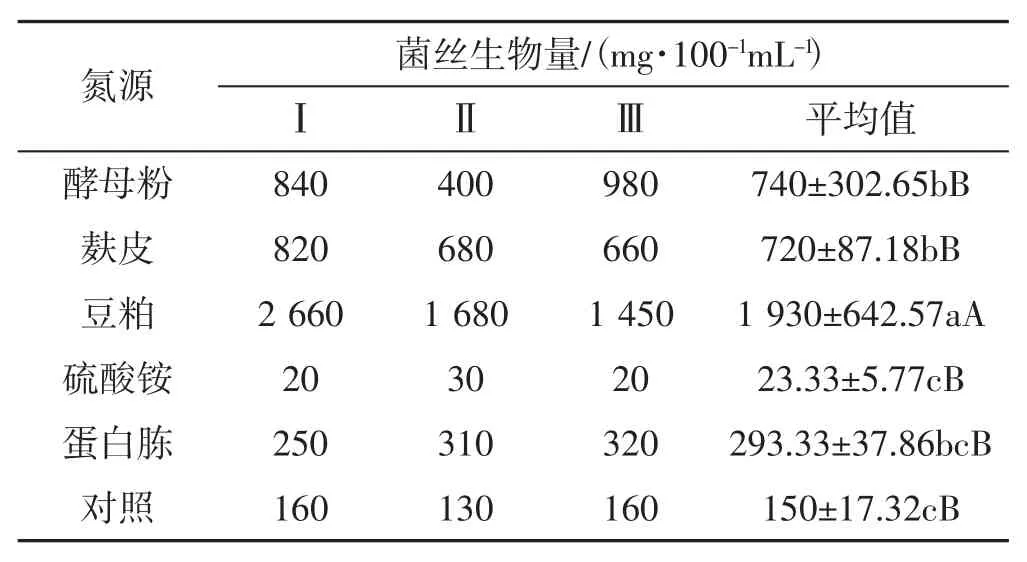
表2 不同氮源對黑木耳菌絲生物量的影響Tab.2 Effect of different nitrogen source on mycelial biomass of Auricularia heimuer
由表2可知,以豆粕為碳源的試驗組黑木耳菌絲生物量最高,平均達到1 930 mg·100-1mL-1;其次是酵母粉、麩皮,菌絲生物量達740 mg·100-1mL-1、720 mg·100-1mL-1;幾種氮源對黑木耳菌絲生物量影響的排序依次為豆粕>酵母粉>麩皮>蛋白胨>硫酸銨;其中只有硫酸銨效果較差,低于對照。
2.3 無機鹽配比對黑木耳菌絲生物量的影響
不同無機鹽配比對黑木耳菌絲生物量的影響結果見表3。
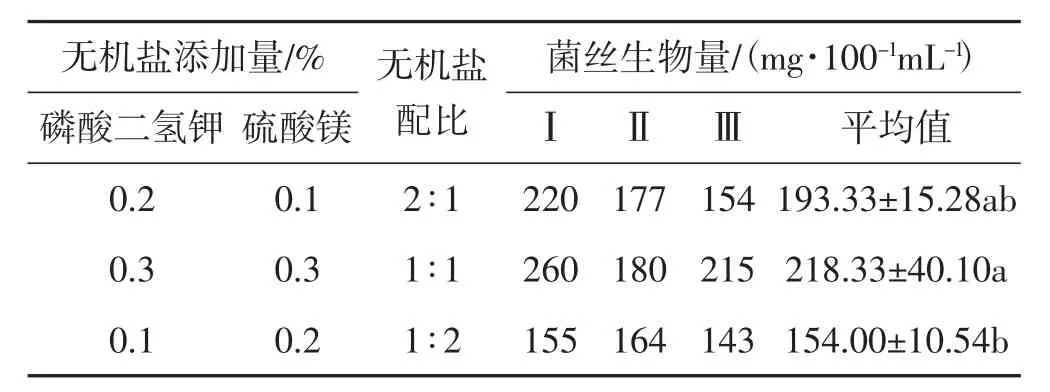
表3 不同無機鹽添加量及配比對黑木耳菌絲生物量的影響Tab.3 Effect of different addictive amount ratio of inorganic on mycelial biomass of Auricularia heimuer
由表3可以看出,磷酸二氫鉀和硫酸鎂比例為1∶1時,黑木耳菌絲生物量最高,平均達218.33 mg·100-1mL-1;其次是比例為 2∶1時;比例為 1∶2時,黑木耳菌絲生物量最低。
2.4 黑木耳液體菌種培養基配方優化正交試驗
根據單因素試驗結果,采用L9(34)設計,選用最佳碳源、最佳氮源、硫酸鎂和磷酸二氫鉀為因子,進行L9(34)正交試驗,正交試驗因素水平見表4,優化結果見表5。
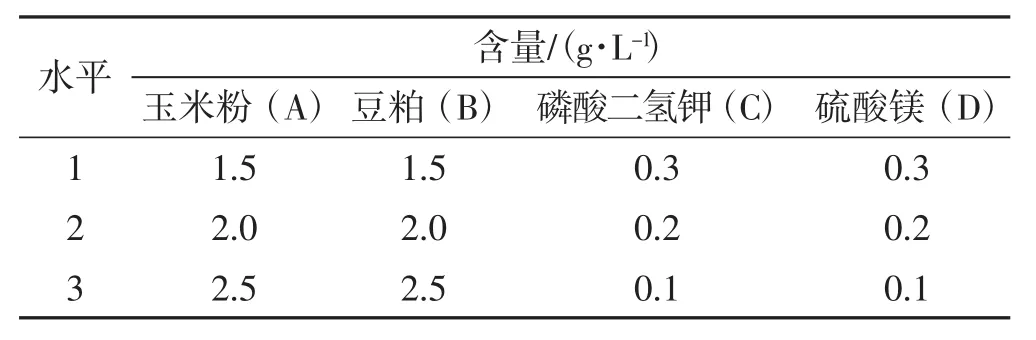
表4 正交試驗因素和水平Tab.4 Factors and levels of orthogonal experiment
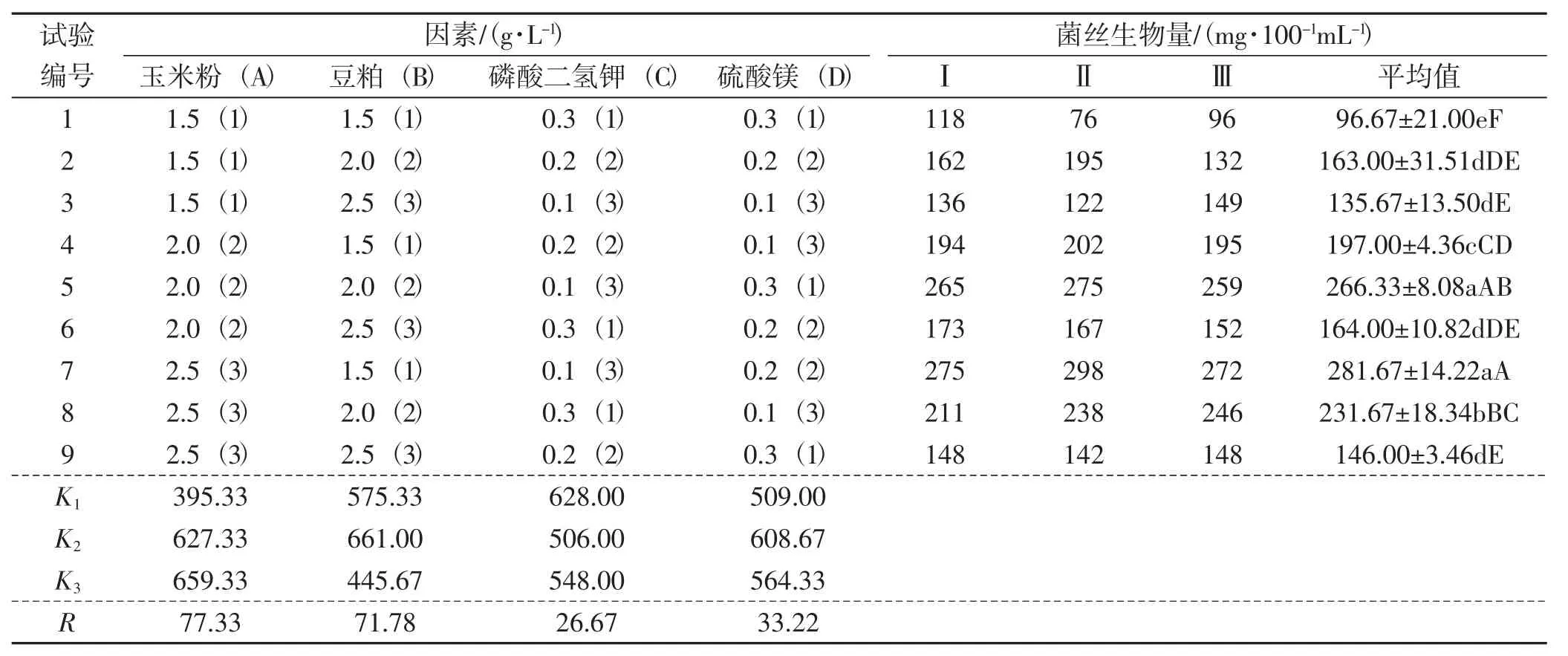
表5 L9(34)正交試驗結果Tab.5 Rusult of orthogonal test
由表5可知,在4個單因子之間,對黑木耳菌絲生物量的影響排序依次為A>B>D>C;玉米粉影響最大,其次是豆粕、硫酸鎂,磷酸二氫鉀影響最小。從正交試驗結果可以看出各因素水平的較理想培養基配方為A3B2C1D2。培養6天后菌絲生物量達296.28 mg·100-1mL-1,結果較理想。
2.5 搖床培養溫度試驗
搖床培養溫度試驗結果見表6。
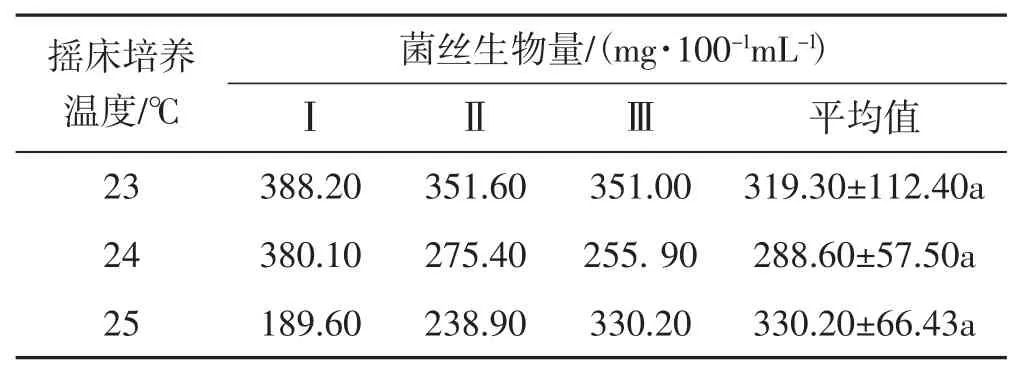
表6 搖床培養溫度試驗Tab.6 Temperature test of shake cultivation
由表6可知,25℃搖床培養時,黑木耳菌絲生物量最大,為330.2 mg·100-1mL-1;其次是23℃搖床培養時,黑木耳菌絲生物量達319.30 mg·100-1mL-1;24℃搖床培養時,黑木耳菌絲生物量最小,為288.60 mg·100-1mL-1;各溫度對黑木耳菌絲體生物量影響排序依次25℃>23℃>24℃;但試驗所設溫度對搖瓶黑木耳菌絲生物量影響不大,無顯著差異。
2.6 搖床培養天數試驗
搖床培養天數試驗結果見表7。
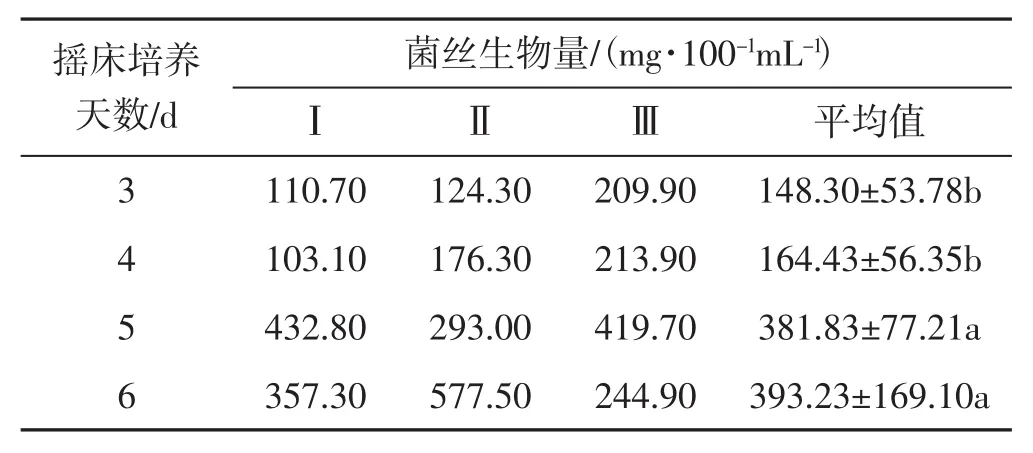
表7 搖床培養天數試驗Tab.7 Test of shake cultivation for different days
由表7可知,搖床培養黑木耳液體菌種,培養6 d菌絲生物量最高,平均達393.23 mg·100-1mL-1;其次是培養5 d和4 d;培養3 d,黑木耳菌絲生物量最低,平均為148.30 mg·100-1mL-1。培養天數對黑木耳菌絲生物量影響排序依次為6 d>5 d>4 d>3 d;其中培養3 d和4 d黑木耳的菌絲生物量差異不顯著;培養5 d和6 d黑木耳菌絲生物量差異不顯著;培養3 d、4 d與培養5 d、6 d間黑木耳菌絲生物量差異顯著。搖床培養5 d和6 d對黑木耳菌絲生物量影響較大。
2.7 搖床轉速試驗
搖床轉速試驗結果見表8。
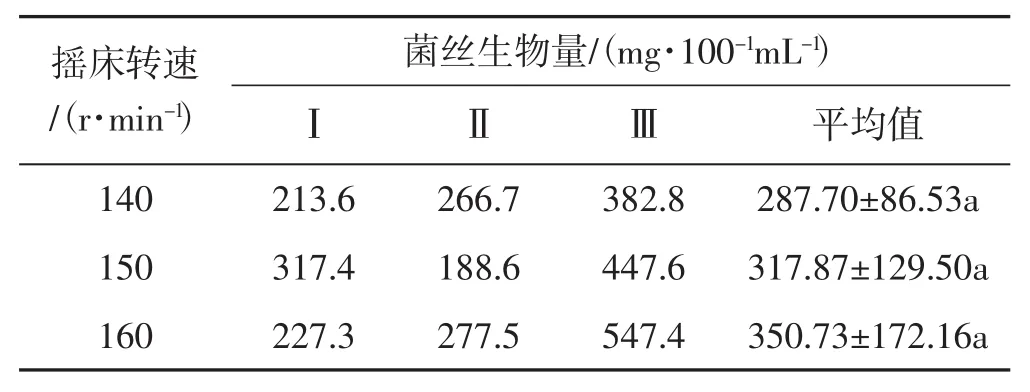
表8 搖床轉速試驗Tab.8 Rotating speed of shaking table
由表8可以看出,在3個搖床轉速處理中,對黑木耳菌絲生物量的影響排序依次為160 r·min-1>150 r·min-1>140 r·min-1;其中,160 r·min-1影響最大,黑木耳菌絲生物量達350.73 mg·100-1mL-1;其次是 150 r·min-1;140 r·min-1影響最小,菌絲生物量達287.70 mg·100-1mL-1。在設置的3個轉速處理試驗中,轉速對黑木耳菌絲生物量的影響不大,無顯著差異。
3 小結
從試驗結果中可以看出碳源是影響黑木耳液體菌種菌絲生物量的重要因素。不同碳源對黑木耳液體菌種菌絲生物量影響程度不同,其中多糖>雙糖>單糖。黑木耳液體菌種制作較適宜的碳源為玉米粉。
氮源為食用菌細胞生長必不可少的營養,可促進蛋白質和核酸的合成[7]。試驗結果顯示,不同氮源對黑木耳液體菌種菌絲生物量影響程度不同,其中有機氮>無機氮。黑木耳液體菌種制作較適宜的氮源為豆粕、酵母粉和麩皮。
硫酸鎂是食用菌合成氨基酸過程中重要的酶激活劑;磷酸鹽在培養基中起到緩沖作用;磷是蛋白質、核酸和細胞膜的重要組成部分[8]。因此不同無機鹽比例對黑木耳液體菌種菌絲生物量影響不同,磷磷酸二氧鉀與硫酸鎂的比例為1∶1時,試驗結果較理想。
不同碳源、氮源、無機鹽比例,直接影響著黑木耳液體菌種的菌絲生物量。試驗結果顯示,玉米粉對黑木耳液體菌種菌絲生物量影響最大;其次是豆粕、硫酸鎂;磷酸二氫鉀影響最小。正交試驗結果顯示適宜的培養基配比為:玉米粉2.5 g·L-1、豆粕2.0 g·L-1、硫酸鎂 0.2 g·L-1、磷酸二氫鉀 0.3 g·L-1。
培養條件是黑木耳液體菌種制作的關鍵,不同培養條件對黑木耳菌絲生物量的影響不同。培養溫度25℃時對黑木耳液體菌種菌絲生物量影響最大,但各溫度試驗處理對黑木耳菌絲生物量影響差異不顯著;培養5 d和6 d的黑木耳液體菌種菌絲生物量和培養3 d和4 d的黑木耳液體菌種菌絲生物量差異顯著,較理想的培養天數為5 d~6 d;搖床培養轉速160 r·min-1時,黑木耳液體菌種菌絲生物量最大,但試驗設置的3個轉速處理對黑木耳液體菌種菌絲生物量影響差異不顯著。
液體菌種具有生產周期短、菌齡一致[9]、菌種純度高、省工、生產成本低等優點,大大提升了黑木耳生產效益,故黑木耳液體菌種生產技術越來越受歡迎,試驗對黑木耳液體菌種培養基配方及培養條件進行優化試驗,但培養條件對菌絲生物學活性的影響機制還有待進一步研究。

