局部晚期和轉移性胰腺癌患者少分次同步劑量遞增放療療效觀察
張 英,趙志飛,王小深,鞠忠建,王 競 北京科技大學醫院 內科,北京 00083; 解放軍總醫院第一醫學中心 放療科,北京 00853
對于不能手術切除或不能耐受手術治療的胰腺癌患者,放療需要考慮的危及器官主要是臨近胰腺的胃和十二指腸。胃腸道的放射性損傷主要表現為胃幽門潰瘍、胃竇不規則狹窄、十二指腸球后肌層增厚、潰瘍和狹窄[1]。早期胃腸道放射性損傷的研究對象主要是接受全腹腹主動脈旁淋巴結或右上腹膜后淋巴結照射的患者[1-2]。文獻報道胃受照50 Gy臨床嚴重晚期損傷的發生率為2% ~6%,小腸受照50 Gy晚期小腸梗阻或穿孔的發生率為2% ~ 9%[3]。小腸晚反應的發生與纖維化、梗阻或穿孔相關。現代放療中少分次高劑量的劑量分次模式使用越來越多,這種劑量模式可以使腫瘤病灶獲得較高的生物學等效劑量(biological equivalent dose,BED)。目前,少分次高劑量放療已經用于全乳放療、部分乳腺加速放療和前列腺治療。正常組織對于少分次放療的耐受不同于常規放療,所取得的數據仍不成熟。理論上“靶中靶”“洋蔥皮”樣的層層遞增劑量模式,可以使正常組織毒性最小,靶區中的腫瘤病灶接受更高的治療劑量。螺旋斷層調強放療是采用螺旋CT掃描方式進行放療的圖像引導精確放療技術,可以實現“靶中靶”的同步劑量遞增 (simultaneous integrated boost,SIB)治療模式。相比于常規放療,螺旋斷層放療在胰腺癌的治療中腫瘤劑量適形度更高,劑量均勻度更好,腫瘤劑量強度調節更準,腫瘤周圍正常組織劑量衰落更快;通過容積調強旋轉技術可以實現非均勻強度射線,不同的劑量強度級差,足夠的放射野角度(360°),達到靶區內劑量的預期設計方案[4-5]。提高生物學有效劑量有利于腫瘤局部控制,十二指腸和胃的耐受性是胰腺癌放療劑量提高最重要的限制性因素,但基于少分次同步劑量遞增放療模式下的胃和十二指腸的劑量限制性容積尚缺乏前瞻性研究資料。我們先前報道了針對局部晚期和轉移性胰腺癌采用少分次高劑量螺旋斷層放療的初步結果[6],本研究將更新隨訪結果,進一步探索少分次同步劑量遞增放療的劑量分次模式及劑量容積毒性的臨床意義,并為將來開展臨床研究提供參考信息。
資料與方法
1 資料來源 收集 2011 年 1 月- 2014 年 4 月在解放軍總醫院第一醫學中心經病理或細胞學診斷不能手術的局部晚期和轉移性胰腺癌患者前瞻性登記的病例資料。納入標準:1)經手術病理或穿刺細胞學診斷的局部晚期、侵犯大血管(門靜脈、腸系膜上靜脈)不能手術的胰腺癌患者和轉移性胰腺癌;2)經多學科(腫瘤內科、肝膽外科、放療科、放射診斷科等)聯合會診,臨床多模態影像資料(核磁、CT、超聲和PET/CT,至少3種以上)證實不能手術的局部晚期或復發轉移性胰腺癌;3)采用以根治性為目的的少分次同步劑量遞增放療(腫瘤大于60 Gy)。排除標準:1)胰腺導管內黏液性腫瘤、胰腺神經內分泌腫瘤等非胰腺導管腺癌;2)預期生存期小于3個月;3)因非治療因素自行中斷或未完成放療計劃。所有患者均在治療前簽署治療知情同意書,所有醫療行為遵循《赫爾辛基宣言》。
2 治療計劃 采用熱塑體膜固定體位,空腹平掃、增強CT掃描,必要時分時口服造影劑CT模擬定位,圖像融合勾畫大體腫瘤靶區(gross target volume,GTV)。根據GTV外放勾畫計劃腫瘤靶區 (plan target volume,PTV)[7],一般在軸位方向外放 0.5 ~ 0.8 cm,在頭腳方向外放 0.5 ~ 1.0 cm,一般不進入正常組織內部。如果腫瘤貼近十二指腸,外放范圍適當縮小為0 ~ 0.3 cm。采用螺旋斷層放療技術進行少分次同步劑量遞增精確放療(PTV/GTV 50 Gy/60 Gy/17 ~ 20 f)。通過劑量容積直方圖(dose volume histogram,DVH)評價 V40、V45、V50、V55、V60和最大劑量(Dmax)。根據處方劑量和DVH評估確定治療計劃,劑量限制要求十二指腸 V45<3 cm3、V50<1 cm3、V55<0.5 cm3,要求胃 V45<5 cm3、V50<3 cm3、V55<1 cm3。
3 隨訪評價 放療后每 3 個月采用門診及電話隨訪。1)主要終點指標:腫瘤局部控制率、劑量限制性毒性和劑量容積限制。腫瘤局部控制率定義為放療后3 ~ 6個月影像學復查腫瘤病灶縮小和穩定者占全部治療患者的百分比。劑量限制性毒性定義為放療后發生治療相關的4級胃腸道毒性反應,包括出血、梗阻和穿孔。劑量容積限制定義為發生劑量限制性胃腸道毒性時對應的毒性反應器官容積。2)次要終點指標:局部無進展生存(local progression-free survival,LPFS) 和 總 生存(overall survival,OS)。LPFS 定義為放療開始至隨訪時治療局部無進展的生存時間。OS定義為放療開始至死亡或末次隨訪的生存時間。3)毒性評價標準參照美國國立癌癥研究院不良反應常見毒性標準 (NCI CTCAE v4.0)。
4 統計分析 統計軟件采用 SPSS26.0,所有指標分析均采用描述性統計。按α/β=10,計算腫瘤及早反應組織的生物學等效劑量(BED10)。生存分析采用Kaplan-Meier法。
結 果
1 患者一般情況 共納入 19 例患者,中位年齡62(47 ~ 75)歲,局部晚期和轉移性胰腺癌患者分別占79%和21%(表1)。4例轉移性胰腺癌為遠處轉移,其中3例為肝轉移,1例為肺轉移。19例患者中,4例在放療前接受胃腸吻合或膽腸吻合手術,5例放療時同步化療,4例接受后續化療。
2 放療情況 所有胰腺腫瘤及肝轉移均接受放療。胰腺腫瘤接受放療的中位BED10為81(范圍78 ~ 90) Gy,胰腺腫瘤原發病灶及區域淋巴結的中位容積為 61.6(范圍 30.5 ~ 230.5) cm3,胰腺腫瘤及周圍淋巴結轉移病灶靶區GTV中位分次劑量為3(范 圍 2.94 ~ 3.53) Gy, 中 位 治 療 20(范 圍 17 ~23)次,中位處方劑量為 60(范圍 60 ~ 69) Gy(表1)。胃受照的 V40、V45、V50、V55、V60和Dmax中 位 值 分 別 為 8.81(范 圍 1.49 ~ 28.3) cm3、2.58(范 圍 0.07 ~ 13.8) cm3、1.16(范 圍 0.03 ~8.28) cm3、0.37(范圍 0 ~ 5.19) cm3、0.04(范圍 0 ~2.97) cm3和 56(范圍 33 ~ 69) Gy。十二指腸受照的V40、V45、V50、V55和Dmax中位值分別為3.45(范 圍 0.19 ~ 18.67) cm3、1.40(范 圍 0.02 ~8.55) cm3、0.45(范圍 0.05 ~ 0.68) cm3、0.06(范圍0.03 ~ 0.10) cm3和 52(范圍 22 ~ 59) Gy(表2)。
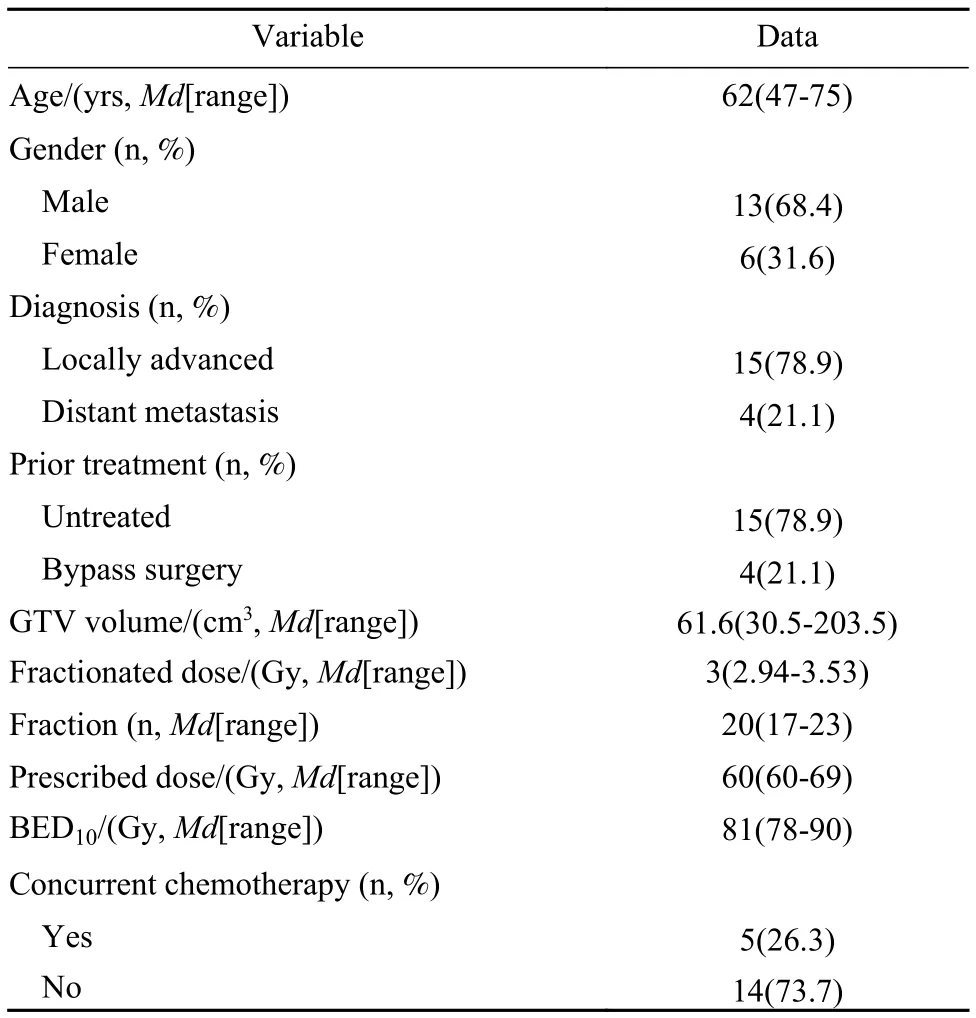
表1 局部晚期和轉移性胰腺癌患者臨床特征Tab.1 Clinical characteristics of patients with locally advanced and metastatic pancreatic cancer
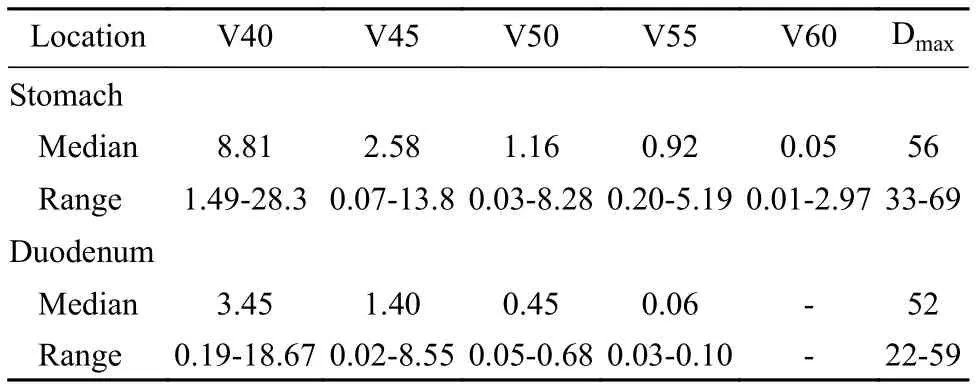
表2 局部晚期和轉移胰腺癌患者胃和十二指腸受照的劑量容積(cm3)Tab.2 Selected dose volume for stomach and duodenum (cm3)
3 療效觀察 中位隨訪 10.7(范圍 3.1 ~ 64.1)個月。19例中,12例病灶縮小,4例病灶穩定,腫瘤局部控制率為84%(16/19),局部晚期胰腺癌中位局部無進展生存 (median local progressionfree survival,mLPFS)期為 8.1(95%CI:5.8 ~ 10.5)個月,中位總生存 (median overall survival,mOS)期為 10.7(95%CI:3.4 ~ 17.9)個月。患者生存曲線見圖1。
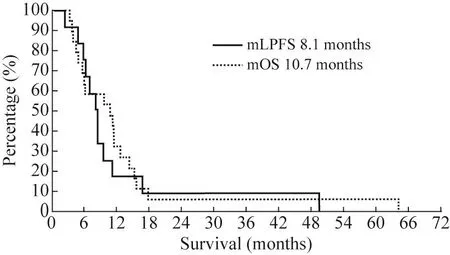
圖1 局部晚期和轉移性胰腺癌的總生存和局部無進展生存Fig.1 Overall and local progression-free survival in the 19 patients with locally advanced and metastatic pancreatic cancer
4 毒性反應 19 例接受少分次劑量遞增放療發生胃和十二指腸2級以上的急性毒性反應的中位時間為3.0個月,6個月和12個月時2級及以上胃腸道毒性反應發生率分別為16%和21%,其中3級和4級毒性反應發生率均為5%(1/19)。治療后 3 ~ 6個月內有1例十二指腸出血(4級),1例腹瀉(2級),1例腸梗阻(3級);治療后1年有1例患者出現腸道狹窄(3級)。1例(5%,1/19)患者發生劑量限制性胃腸道毒性反應,為治療相關的十二指腸出血(4級)。該患者胰腺腫瘤放療PTV/GTV 50 Gy/60 Gy/20 f, 十 二 指 腸 受 照的Dmax為57 Gy,對應的絕對劑量和容積分別為55 Gy 在 0.03 cm3、50 Gy 在 0.50 cm3、45 Gy 在2.62 cm3和 40 Gy 在 6.33 cm3,相應的生物學等效劑量(BED10)和十二指腸受照容積分別為70 Gy在0.03 cm3、63 Gy 在 0.50 cm3、55 Gy 在 2.62 cm3、48 Gy 在 6.33 cm3。
討 論
本研究是針對胰腺癌采用少分次同步劑量遞增螺旋斷層放療基于生物學等效劑量分析危及器官劑量限制性容積的探索性臨床研究。盡管少分次高劑量意味著晚反應或慢性炎癥風險升高[8],但由于少分次高劑量相對較好的腫瘤控制,在一些腫瘤中被確定為治療規范[9]。因此有必要探索少分次高劑量放療對胰腺癌的效果。2.25 ~ 8 Gy分次劑量范圍屬于少分次高劑量,不僅用于轉移性疾病的減癥治療,最近也用于乳腺癌和前列腺癌根治性治療[8]。本研究中針對胰腺腫瘤采用2.94 ~3.53 Gy 分次劑量,治療總劑量為 60 ~ 69 Gy,相應 BED10為 78 ~ 90 Gy。由于胰腺腫瘤位于腹膜后,周圍正常組織胃和十二指腸是放療可能危及的風險器官,確保周圍正常組織安全是給予胰腺腫瘤放療的前提。早期的胃十二指腸劑量容積耐受性來源于術中放療、動物試驗、臨床毒性反應以及數學模型的轉換等[8],胰腺癌常規放療胃十二指腸的劑量容積耐受性來源于RTOG0848和RTOG1102 報告,最大劑量 55 Gy,50 ~ 54 Gy 的容積<10%,45 ~ 50 Gy 的容積<15%[10]。但對于少分次高劑量放療來說,目前尚缺乏全面系統的臨床研究數據。國內學者報道胰腺腫瘤接受70 ~80 Gy/15 ~ 20 f 放療,0.5 cm3胃腸道容積受照45 Gy是預測2級及以上胃腸道毒性反應的最佳閾值[11]。該研究先前也報道了胃受照劑量40.85 Gy≥5 cm3,6 個月時胃毒性反應發生率為75%,而 40.85 Gy 受照容積<5 cm3沒有發生胃毒性反應(P=0.033)[12]。Lin等[13]研究顯示十二指腸毒性反應與十二指腸平均劑量、V40、V35、V30和V25相關。但這些研究因為劑量分次、毒性反應程度和限制容積的不同,往往缺乏可比性。Goldsmith等[14]研究報道了立體定向放療十二指腸毒性限制低危風險是 D1cc≤25.3 Gy/3 f,期3/4級毒性并發癥發生率為4.7%,而D1cc≤37.4 Gy/3 f的預期3級以上毒性并發癥發生率為20%。本研究在胰腺癌中提出采用生物等效劑量BED10比較不同分次劑量下的毒性反應,為將來臨床研究提供了重要的參考數據。研究中觀察到十二指腸受照的劑量限制性容積分別為BED1070 Gy在0.03 cm3、63 Gy 在 0.50 cm3、55 Gy 在 2.62 cm3、48 Gy 在 6.33 cm3,相對于 PTV/GTV 50 Gy/60 Gy/20 f少分次同步劑量遞增放療十二指腸絕對劑量限制性容積為 55 Gy 在 0.03 cm3、50 Gy 在 0.50 cm3、45 Gy 在 2.62 cm3、40 Gy 在 6.33 cm3。這也是在臨床研究中首次用生物等效劑量來確定十二指腸的劑量限制性容積。最近有學者根據小腸劑量耐受數據建立了基于立體定向的DVH風險圖模型并評估風險水平。根據LaCouture等[15]報道21 Gy/3 f小腸容積受照5 cm3發生3級及以上并發癥風險為6.5%,根據模型估算小腸容積16.2 Gy/3 f的風險為2.5%。這些結果也支持目前已開展的劑量遞增臨床研究[16]。
局限期和局部晚期(ⅡB ~ Ⅲ期,T4或N1)可手術切除的胰腺癌患者中位總生存期為10.6~12.7月,不能手術切除的(ⅡB~ Ⅲ期、T4或N1)胰腺癌患者中位總生存期為 6.7 ~ 7.2 月[17]。通過劑量遞增、調強放療和立體定向放療可改善胰腺癌患者的生存[16,18]。本研究中對于局部晚期不能手術的胰腺癌患者采用少分次同步劑量遞增放療局部無進展生存期為 8.1(95%CI:5.8 ~ 10.5)個月,中位總生存期為 10.2(95%CI:3.4 ~ 17.9)個月。與歷史對照相比[17],本研究中少分次同步劑量遞增放療與手術切除的Ⅲ期胰腺癌中位總生存期(10.6個月)相似;與局部晚期不能手術的Ⅲ期胰腺癌相比[17],中位總生存期提高了3.5個月 (10.7 個月vs7.2 個月)。
由于胰腺癌是放射相對抗拒的腫瘤,常規放療1年局控率只有40% ~ 60%,而立體定向放療局控率可達75% ~ 100%,現在立體定向放療已經越來越多地應用于胰腺癌的治療[19]。早期的一系列臨床研究報道了胰腺癌立體定向放療的結果,采用較大的分次劑量 10 ~ 25 Gy/f,治療 1 ~ 3 次,局部腫瘤控制率為57% ~ 100%,中位無進展生存期為 2 ~ 15 個月,中位總生存期為 5.7 ~ 20 個月,3級以上急性胃腸道毒性發生率為0 ~ 79%[20]。盡管立體定向放療可以取得較好的腫瘤局部控制,但單次大劑量放療引起較嚴重胃腸道毒性風險有可能部分或全部抵消治療所帶來的生存獲益。隨后開展的臨床研究顯示采用 5 ~ 12 Gy/f,治療 3 ~5次,局部晚期胰腺癌可取得的中位腫瘤控制率為 61% ~ 85%,中位無進展生存期為 7.3 ~ 15 個月,中位總生存期為8.7 ~ 20個月,3級及以上毒性反應發生率為0 ~ 22%[20-22]。最近的臨床研究采用 5 ~ 7.5 Gy/f,治療 5 ~ 6 次,結果顯示腫瘤控制率為 54% ~ 90%,中位無進展生存期為 8 ~ 10.2 個月,中位總生存期為13 ~ 19.0個月,3級及以上毒性發生率為 0 ~ 7%[20,23-26]。最近的Meta分析顯示劑量遞增的立體定向放療腫瘤控制率為60% ~82%,胃腸道3/4級的毒性反應發生率為2% ~5%[27]。與本研究結果相似,目前研究表明對于局部晚期不能手術胰腺癌采用少分次高劑量放療具有良好的腫瘤局控率和治療耐受性,也是局部晚期胰腺癌可選的治療方案。
螺旋斷層放療對胃腸道的保護具有明顯的優勢[4],臨床上報道了一系列基于少分次同步遞增劑量螺旋斷層放療聯合化療治療局部晚期胰腺癌的臨床研究[28-35],腫瘤局控率為70% ~ 100%,中位局部無進展生存期為3.8 ~ 14.0個月,局部晚期患者中位總生存期為9.3 ~ 12.2個月,3級及以上急性胃腸道反應發生率為0 ~ 13%。這些研究表明少分次同步劑量遞增螺旋放療在保護胃腸道的同時具有較好的腫瘤局控率,有助于改善總生存。另外,放療達到較高的BED10(>70 Gy),有可能給患者帶來長期的腫瘤控制[36],并改善總生存和無進展生存[37]。
綜上所述,少分次的同步劑量遞增放療可使患者獲得了令人鼓舞的生存改善[38],在聯合足量化療和提高生物學等效劑量方面都在逐步改變目前的胰腺癌治療格局[39]。本研究表明胰腺癌螺旋斷層少分次同步劑量遞增放療是一種安全有效的劑量分次模式,在胃十二指腸劑量容積耐受性限制的情況下,通過提高胰腺腫瘤局部生物學等效劑量,可以改善胰腺癌患者的無進展生存,并有助于改善胰腺癌患者的總生存,值得進一步深入研究。

