表觀遺傳修飾劑線性肟酸對樺褐孔菌三萜合成的影響
趙艷霞,周 蓉,孫夢妮,袁雯雯,鄭維發
表觀遺傳修飾劑線性肟酸對樺褐孔菌三萜合成的影響
趙艷霞,周 蓉,孫夢妮,袁雯雯,鄭維發*
江蘇師范大學 生命科學學院,江蘇 徐州 221116
三萜類化合物是藥用真菌樺褐孔菌產生的主要次生代謝產物之一,但其在實驗室培養條件下積累量較少。旨在研究組蛋白去乙酰化酶(histone deacetylase,HDAC)活性抑制劑線性肟酸(suberoylanilide hydroxamic acid,SAHA)對樺褐孔菌三萜合成的調控。液體搖瓶發酵法培養樺褐孔菌,并在培養液中添加SAHA。采用熒光定量PCR測定三萜合成相關基因轉錄水平,香草醛-高氯酸法測定細胞內和發酵液中三萜的含量。SAHA的添加提高了樺褐孔菌體內編碼3-羥基-3-甲基戊二酸單酰輔酶A合成酶、3-羥基-3-甲基戊二單酰輔酶A還原酶、甲羥戊酸激酶、二磷酸酯脫羧酶、角鯊烯合成酶和羊毛甾醇合成酶等基因的表達水平。SAHA顯著提高了樺褐孔菌菌絲體內和發酵液中三萜的積累量。SAHA誘導下樺褐孔菌菌絲體內三萜積累量達(66.4±5.24)mg/g,明顯高于對照組[(22.7±3.3)mg/g],并且胞外三萜的含量由對照組的(30.5±2.7)mg/L提高至(49.3±3.8)mg/L。此外,經SAHA處理后樺褐孔菌胞內三萜清除自由基的能力顯著提高。SAHA可以作為調節因子激發樺褐孔菌液體培養條件下三萜類化合物的積累。
樺褐孔菌;三萜;組蛋白去乙酰化酶;線性肟酸;自由基
樺褐孔菌屬于藥用擔子真菌,可以合成黑色素[1]、多酚[2]和三萜[3]等次級代謝產物。三萜類化合物具有抑制腫瘤、抗菌、抗病毒和鎮痛等作用[3-4],對癌肉瘤Walker-256細胞、人乳腺癌MCF-7細胞和皰疹病毒具有顯著的抑制作用[5]。樺褐孔菌合成的三萜類化合物主要有3-羊毛甾-8,24-二烯-21-醛、羊毛甾醇、3β-羥基-羊毛甾-8,24-二烯-21-醛、白樺脂醇、樺褐孔菌醇、栓菌酸、3β,21-二羥基-羊毛甾-8,24-二烯、齊墩果酸、烏蘇酸、白樺脂酸、樺褐孔菌素A、樺褐孔菌萜D、3β-乙酰氧基-11α,12α-環氧-齊墩果烷- 28,13β-內酯等[6],該類化合物對肺癌人類肺泡基底上皮A549細胞、結直腸腺癌HT29細胞、人宮頸癌Hela細胞和小鼠白血病L1210細胞等腫瘤細胞具有毒性[7],對小鼠乳腺癌4T1細胞株和MCF-7細胞的具有毒性[8]。然而,樺褐孔菌在自然界中生長緩慢,不能作為三萜類化合物的主要來源。其在實驗室培養條件下生長繁殖速度比較快,但是次級代謝產物合成基因處于沉默或者低表達狀態[9],導致實驗室培養條件下三萜類化合物積累量較低。
生物體三萜類化合物主要通過甲戊二羥酸途徑合成[10]。其中3-羥基-3-甲基戊二單酰輔酶A還原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)是催化異戊二烯生物合成,角鯊烯合成酶(squalene synthase,SS)催化從異戊二烯途徑到甾醇和三萜生物合成[10]。羊毛甾醇合成酶(lanosterol synthase,LS)催化2,3-氧雜質量烯環化形成羊毛甾烷[9]。目前本實驗室對ATCC 22881的全基因組進行了測序,結合Narimene等[9]發表的文章,發現L.中編碼3-羥基-3-甲基戊二單酰輔酶A合成酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)、HMGR、甲羥戊酸激酶(mevalonate kinase,MK)、二磷酸酯脫羧酶(diphosphomevalonate decarboxylase,DPMD)、和等基因參與三萜類化合物的合成。生物體內基因表達水平受表觀遺傳調控。組蛋白去乙酰化酶(histone deacetylase,HDAC)對染色體的結構修飾、基因表達調控和次級代謝產物積累發揮著重要的作用[11-12]。組蛋白的乙酰化有利于DNA與組蛋白八聚體的解離,核小體結構松弛,從而使各種轉錄因子和協同轉錄因子能與DNA結合位點特異性結合,激活基因的轉錄。在細胞核內,組蛋白乙酰化與組蛋白去乙酰化過程處于動態平衡,并由組蛋白乙酰化轉移酶(histone acetyltransferase,HAT)和組蛋白去乙酰化酶(histone deacetylase,HDAC)共同調控。HAT將乙酰輔酶A的乙酰基轉移到組蛋白氨基末端特定的賴氨酸殘基上,HDAC使組蛋白去乙酰化,與帶負電荷的DNA緊密結合,染色質致密卷曲,基因的轉錄受到抑制[13]。研究表明,HDAC可以調節黃曲霉中黃曲霉毒素B1(AFB1)的積累[12],稻瘟病菌和亞洲鐮刀菌中hda1型組蛋白去乙酰酶的缺失能增加代謝物的產生[14]。線性肟酸(suberoylanilide hydroxamic acid,SAHA)是HDAC的抑制劑,SAHA通過結合到酶的活性位點抑制HDAC的活性。據報道,SAHA可以改變次級代謝產物的組成[15],SAHA的處理可以增加中抗炎環肽的合成[16]。然而,組蛋白乙酰化修飾是否影響樺褐孔菌三萜類化合物合成相關基因的轉錄尚不確定。本實驗中研究了SAHA對樺褐孔菌三萜類化合物積累量和相關合成基因的影響。研究結果將為提高藥用真菌次級代謝產物合成基因的表達水平從而提高次級代謝產物的產量奠定基礎。
1 材料
1.1 供試菌株
樺褐孔菌(ATCC22881)購自美國典型培養物保藏中心,現保存于江蘇省藥用植物生物技術重點實驗室。樺褐孔菌液體培養基配方:葡萄糖(2%)、蛋白胨(0.35%)、酵母提取物(2%)、KH2PO4(0.01%)、MgSO4·7H2O(0.05%)。培養溫度為26 ℃,搖床轉速為140 r/min。SAHA(批號149647-78-9)購買于Sigma公司。
1.2 儀器
酶標儀(SYNERGY2,美國BioTek公司),實時熒光定量PCR(StepOnePlus,美國Applied Biosystems公司),離心機(Eppendorf 5418,德國Eppendorf有限公司),閃式提取器(ZHBE-50T,河南金鼎科技發展有限公司)。
2 方法
2.1 樺褐孔菌的培養
將樺褐孔菌接種在PDA培養基中,于26 ℃培養7 d,然后轉接到含有80 mL培養液的250 mL的三角瓶中進行培養。在無菌條件下收集菌絲體,勻漿后接種到含有150 mL培養液的500 mL的三角瓶中培養2 d后,向培養液中添加SAHA,使培養液中SAHA的濃度為200 μmol/L。以未添加SAHA的樺褐孔菌培養物為對照組。每天取樣備用。
2.2 基因表達水平的測定
采用熒光定量聚合酶鏈反應(qRT-PCR)檢測樺褐孔菌合成三萜類化合物相關基因的表達水平。菌絲體經液氮研磨后利用Trizol(Takara公司,日本)法提取RNA,采用DnaseI去除基因組DNA的污染(New England BioLabs Inc.,Ipswich,MA,美國)。然后利用反轉錄試劑盒將mRNA反轉錄為cDNA (Takara公司,日本)。使用SYBR?Green Supermix(Roche)進行qRT-PCR,相關引物見表1。以β-肌動蛋白基因作為內參基因,以未添加SAHA的培養物中靶基因的表達值為對照,用2?ΔΔCt法計算目的基因的相對表達水平[17]。實驗過程中每組樣品均做3個生物重復。
表1 引物序列
Table 1 Primer sequences
引物名稱引物序列(5’-3’)目的 qhmgs FAGACCTTCGTAGCAGTTGCChmgs轉錄水平 qhmgs RTGTAGAACGAGGAAGCGCAG qhmgr FGAGCCAACGAATGATGACGChmgr轉錄水平 qhmgr RAGCGCGGAAAGCAAAGAAAG qmk FCTTCCAGTCTGAGGGTGCAGmk轉錄水平 qmk RACGAGGAGATCCGAGGTTCA qdpmd FTCCGTTCGACGACTACCTCTdpmd轉錄水平 qdpmd RTGTACGAGGCGATATGCACG qss1FCGAATTCGACTGCGTCGTTCss1轉錄水平 qss1 RAAGCCAGGGCACTTCCTTAC qss2 FCGAATTCGACTGCGTCGTTCss2轉錄水平 qss2 RAAGCCAGGGCACTTCCTTAC qls1 FTGTGCGATACCACCTCTTCGls1轉錄水平 qls1 RTACCATTGGGGCCAATCCAC qls2 FCATACCGCTCTCCTGGACACqls2轉錄水平 qls2 RTGAAATCTCGGCGCTTCAGT qactin FATGGATCACTTTTCAGAGqactin轉錄水平 qactin RTCAACTAACCCGTCTGGG
2.3 三萜類化合物的提取和測定
利用雙水相超聲法提取樺褐孔菌菌絲體內三萜,提取條件為:異丙醇體積濃度40%,硫酸銨質量濃度0.125 g/mL,料液比0.9∶1,超聲時間為35 min[18]。胞外三萜的提取:收集不同培養條件下樺褐孔菌的培養液,將入醋酸乙酯進行萃取,重復萃取3次。收集醋酸乙酯相,濃縮后定容。以在野生型樺褐孔菌中分離純化到的肌醇為對照品,利用香草醛-高氯酸法[19]測定樺褐孔菌在不同培養條件下三萜類化合物的積累量。
2.4 三萜抗氧化活性的測定
利用分光光度計法測定樺褐孔菌胞內三萜清除超氧陰離子、羥自由基和DPPH的能力。3 mmol/L的鄰苯三酚用于測定樺褐孔菌三萜類化合物清除超氧陰離子的能力[20],5 mmol/L的1,10-二氮雜菲用于檢測清除羥自由基的能力[21],0.1 mmol/L的1, 1-二苯基-2-苦基肼用于清除DPPH自由基的活性研究[22]。
2.5 統計分析
3 結果與分析
3.1 三萜類化合物合成基因的表達水平
樺褐孔菌中編碼HMGS、HMGR、MK、DPMD、SS和LS等基因參與羊毛甾烷型三萜的合成[9],其含有1個編碼3-羥基-3-甲基戊二單酰輔酶A合成酶的基因(,GenBank:MK825554),1個編碼3-羥基-3-甲基戊二單酰輔酶A還原酶的基因(,GenBank:MK825555)、1個編碼甲羥戊酸激酶的基因(,GenBank:MK825557)、1個編碼二磷酸酯脫羧酶的基因(,GenBank:MK825558)、2個編碼角鯊烯合成酶的基因(1,GenBank:MK825564;2。GenBank:MK825565)和兩個編碼羊毛甾醇合成酶的基因(1,GenBank:MK825567;2,GenBank:MK825568)。本實驗研究了SAHA對編碼HMGS、HMGR、MK、DPMD,SS和LS基因的表達水平的影響。分別以對照組不同時間點的基因表達水平為1,計算SAHA處理組基因的表達水平。由圖1可以發現,SAHA的添加激發了、、、、和的表達水平,其中、、1和1在培養的144 h時達最高表達水平,分別為16.34、6.36、11.08和2.65,、2和2在培養的168 h時達最高表達水平,分別為10.13、7.73和4.08,在培養的192 h達最高表達水平為6.51。
3.2 三萜類化合物的積累
SAHA顯著提高了樺褐孔菌細胞內和發酵液中三萜類化合物的積累。樺褐孔菌在添加SAHA后的24 h至96 h中菌絲體內三萜的含量沒有顯著性差異,在培養的120 h開始,添加SAHA組樺褐孔菌菌絲體中三萜的積累量隨著培養時間的延長逐漸升高,培養至192 h時,對照組菌絲體內三萜的積累量為(22.7±3.3)mg/g,極顯著的低于SAHA添加組中三萜的積累水平(66.4±5.24)mg/g(<0.001,圖2-A)。在添加SAHA 24 h后,樺褐孔菌細胞外
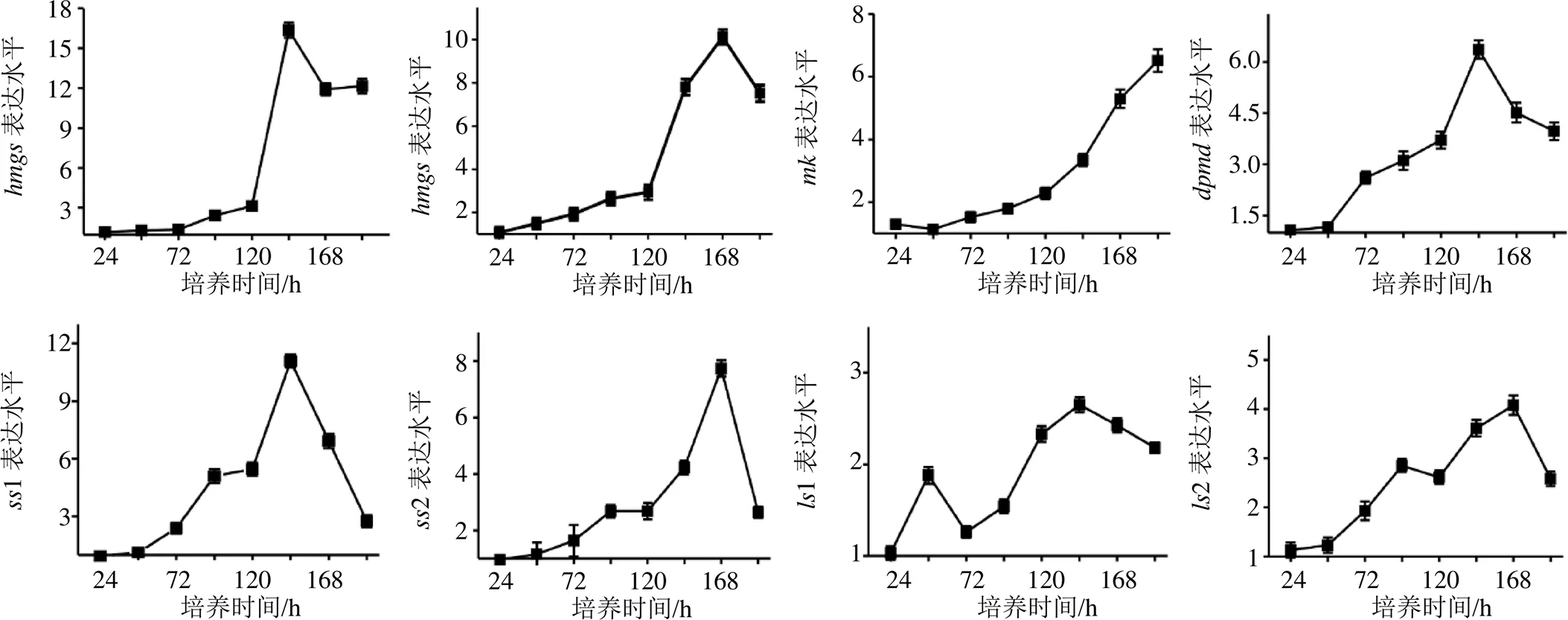
圖1 樺褐孔菌培養過程中SAHA的添加對hmgs、hmgr、mk、dpmd、ss和ls表達水平的影響
三萜的含量明顯提高至(11.3±0.8)mg/L,并隨著培養時間的延長,發酵液中三萜的積累水平逐漸升高,培養至192 h時,三萜的積累量高達(49.3±3.8)mg/L,極其明顯的高于正常培養條件下發酵液中三萜的積累量(30.5±2.7)mg/L(<0.001,圖2-B)。并且經5-AC處理后的樺褐孔菌胞內多酚清除DPPH自由基、超氧陰離子和羥自由基的能力均顯著性的高于正常培養條件下多酚的清除能力(圖3),推測是由于樺褐孔菌胞內三萜類化合物的組成成分的含量和種類的變化引起其清除自由基能力的變化。可見,SAHA的添加不僅促進了三萜類化合物的合成,而且提高了該類化合物的抗氧化活性。

CTR-對照 SAHA-線性肟酸,下圖同
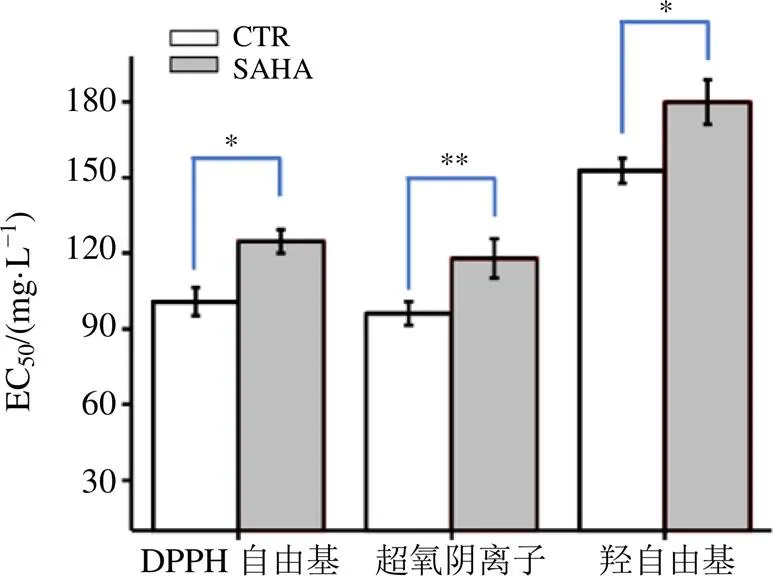
*P<0.05 **P<0.01
4 討論
真菌是天然產物的主要來源,然而,實驗室培養條件下參與次級代謝產物合成相關的基因均處于沉默或低表達狀態[9]。表觀遺傳修飾作為激發劑可以激活基因表達水平從而提高次級代謝產物的產量,誘導新化合物的形成[23]。本研究發現,在液體發酵培養樺褐孔菌的過程中,SAHA的添加提高了參與三萜合成的基因、、、、和等的表達水平,促進樺褐孔菌菌絲體內和發酵液中三萜類化合物的合成,并且菌絲體內三萜類化合物抗氧化能力顯著性的提高。
生物體內組蛋白乙酰化狀態是動態的,同時受組蛋白乙酰轉移酶和組蛋白去乙酰化酶控制。組蛋白的低乙酰化與異染色質形成和基因沉默相關,組蛋白高乙酰化與常染色質形成和基因激活有關[24-25]。利用HDAC的抑制劑調節真菌次級代謝產物的合成被認為是開發新的真菌天然產物的有效途徑。如SAHA可以調控乳突葡萄球菌代謝產物的生成并能誘導新化合物的合成[15],誘導白僵菌產生具有抗炎活性的環縮肽[16]以及誘導曼陀羅內生真菌鐮刀菌酸的合成[26]、芋枝孢霉中新型乙酰甾醇的合成[27]。樺褐孔菌胞內三萜類化合物抗氧化活性的增強,說明樺褐孔菌胞內三萜類化合物組成成分的含量和種類發生了變化,為此將深入研究表觀遺傳修飾劑對樺褐孔菌三萜類化合物組成成分的影響,確定樺褐孔菌體內抗氧化活性較強的物質組成,為進一步研究表觀遺傳修飾劑提高樺褐孔菌次級代謝產物的分子機制奠定基礎。
利益沖突 所有作者均聲明不存在利益沖突
[1] Langfelder K, Streibel M, Jahn B,. Biosynthesis of fungal melanins and their importance for human pathogenic fungi [J]., 2003, 38(2): 143-158.
[2] Lee I K, Kim Y S, Jang Y W,. New antioxidant polyphenols from the medicinal mushroom[J]., 2007, 17(24): 6678-6681.
[3] Taji S, Yamada T, Tanaka R. Three new lanostane triterpenoids, inonotsutriols A, B, and C, from[J]., 2008, 91(8): 1513-1524.
[4] Zheng W F, Zhang M M, Zhao Y X,. Analysis of antioxidant metabolites by solvent extraction from sclerotia of(Chaga) [J]., 2011, 22(2): 95-102.
[5] Taji S, Yamada T, Wada S,. Lanostane-type triterpenoids from the sclerotia ofpossessing anti-tumor promoting activity [J]., 2008, 43(11): 2373-2379.
[6] 張仕瑾, 謝運飛, 譚玉柱, 等. 樺褐孔菌三萜類化學成分研究 [J]. 中草藥, 2015, 46(16): 2355-2360.
[7] Zhao F Q, Mai Q Q, Ma J H,. Triterpenoids fromand their antitumor activities [J]., 2015, 101: 34-40.
[8] Zhao F Q, Xia G Y, Chen L X,. Chemical constituents fromand their antitumor activities [J]., 2016, 70(4): 721-730.
[9] Fradj, Santos G D, Montigny D,. RNA-seq de novo assembly and differential transcriptome analysis of chaga () cultured with different betulin sources and the regulation of genes involved in terpenoid biosynthesis [J]., 2019, 20(18): 4334.
[10] Zhao M W, Liang W Q, Zhang D B,. Cloning and characterization of squalene synthase () gene from[J]., 2007, 17(7): 1106-1112.
[11] Guzman-Chavez F, Salo O, Samol M,. Deregulation of secondary metabolism in a histone deacetylase mutant of[J]., 2018, 7(5): e00598.
[12] Lan H H, Wu L H, Sun R L,. The HosA histone deacetylase regulates aflatoxin biosynthesis through direct regulation of aflatoxin cluster genes [J]., 2019, 32(9): 1210-1228.
[13] Hyndman K A, Knepper M A. Dynamic regulation of lysine acetylation: The balance between acetyltransferase and deacetylase activities [J]., 2017, 313(4): F842-F846.
[14] Maeda K, Izawa M, Nakajima Y,. Increased metabolite production by deletion of an HDA1-type histone deacetylase in the phytopathogenic fungi,(oryzae) and[J]., 2017, 65(5): 446-452.
[15] Triastuti A, Vansteelandt M, Barakat F,. How histone deacetylase inhibitors alter the secondary metabolites of, an endophytic fungus isolated from[J]., 2019, 16(4): e1800485.
[16] Chung Y M, El-Shazly M, Chuang D W,. Suberoylanilide hydroxamic acid, a histone deacetylase inhibitor, induces the production of anti-inflammatory cyclodepsipeptides from[J]., 2013, 76(7): 1260-1266.
[17] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitativeand the 2?ΔΔCTmethod [J]., 2001, 25(4): 402-408.
[18] 趙艷霞, 劉峰, 魏娟娟, 等. 雙水相超聲法提取樺褐孔菌三萜 [J]. 菌物學報, 2014, 33(1): 129-137.
[19] Zhang Y, Wu X Q, Ren Y P,. Safety evaluation of a triterpenoid-rich extract from bamboo shavings [J]., 2004, 42(11): 1867-1875.
[20] Wang S Y, Wu J H, Cheng S S,. Antioxidant activity of extracts fromleaf, bark, and heartwood [J]., 2004, 50(5): 422-426.
[21] 金鳴, 蔡亞欣, 李金榮, 等. 鄰二氮菲-Fe2+氧化法檢測H2O2/Fe2+產生的羥自由基 [J]. 生物化學與生物物理進展, 1996, 23(6): 553-555.
[22] Wang S Y, Wu J H, Cheng S S,. Antioxidant activity of extracts fromleaf, bark, and heartwood [J]., 2004, 50(5): 422-426.
[23] de Groote M L, Verschure P J, Rots M G. Epigenetic Editing: Targeted rewriting of epigenetic marks to modulate expression of selected target genes [J]., 2012, 40(21): 10596-10613.
[24] Shwab E K, Bok J W, Tribus M,. Histone deacetylase activity regulates chemical diversity in[J]., 2007, 6(9): 1656-1664.
[25] Elías-Villalobos A, Helmlinger D, Ibeas J I. Histone deacetylases: Revealing the molecular base of dimorphism in pathogenic fungi [J]., 2015, 2(12): 491-493.
[26] Chen H J, Awakawa T, Sun J Y,. Epigenetic modifier-induced biosynthesis of novel fusaric acid derivatives in endophytic fungi fromL. [J]., 2013, 3(1): 20-23.
[27] Liu D Z, Liang B W, Li X F,. Epigenetic modifier-induced biosynthesis of novel acetylenic sterols fromsteroids [J]., 2014, 87: 35-38.
Effect of epigenetic modifier SAHA on production of triterpenoids in
ZHAO Yan-xia, ZHOU Rong, SUN Meng-ni, YUAN Wen-wen, ZHENG Wei-fa
School of Life Sciences, Jiangsu Normal University, Xuzhou 221116, China
Triterpenoids are one of the major classes of bioactive secondary metabolites produced by medicinal basidiomycete.However, the accumulation of triterpenoids is less under lab culture conditions. The purpose of this study was to investigate the regulation of the histone deacetylase (HDAC) inhibitor suberoylanilide hydroxamic acid (SAHA) on the biosynthesis of triterpenoids in.was cultured by liquid shake flask in the presence of SAHA. For determining the effects of SAHA on biosynthesis of triterpenoids by, the mRNA expression level of genes encoding 3-hydroxy-3-methyl glutaryl-CoA synthase (HMGS), 3-hydroxy-3-methyl glutary-CoA reductase (HMGR), mevalonate kinase (MK), diphosphomevalonate decarboxylase (DPMD), squalene synthase (SS) and lanosterol synthase (LS) by real-time PCR. For assaying the triterpenoids contents inunder submerged culture conditions, Vanillin- Perchloric Acid Method was used to determine the production of total triterpenoids either in mycelia or in the culture broth.The results showed that the addition of SAHA enhanced the expression levels of,,,,andin. Consistent with the increase of gene expression, the accumulation of total triterpenoids was increased to (66.4 ± 5.24) mg/g for mycelial triterpenoids and (49.3 ± 3.8) mg/L for extracellular triterpenoids, which was obviously higher than (22.7 ± 3.3) mg/g mycelial triterpenoids and (30.5 ± 2.7) mg/L extracellular triterpenoids found in the control cultures. Furthermore, SAHA treatment enhanced the capacity of mycelial triterpenoids to scavenge free radicals.In summary, SAHA can be used as a regulator to stimulate the accumulation of triterpenoids ofunder submerged culture conditions.
; triterpenoids; histone deacetylase; suberoylanilide hydroxamic acid; free radical
R286.2
A
0253 - 2670(2022)07 - 2137 - 06
10.7501/j.issn.0253-2670.2022.07.024
2021-08-09
國家自然科學基金項目(31470173);國家自然科學基金項目(31400431);江蘇師范大學研究生創新計劃項目(2021XKT0752)
趙艷霞(1980—),女,河北衡水,副教授,博士,主要從事藥用真菌次級代謝產物研究。Tel: (0516)83403179 E-mail: zhaoyx0318@126.com
鄭維發(1962—),男,安徽南陵,教授,博士,主要從事藥用真菌次級代謝產物的代謝調控研究。Tel: (0516)83403179 E-mail: yyzw@jsnu.edu.cn
[責任編輯 時圣明]

