基于TCMSP數據庫的分子對接虛擬篩選JAK3特異性抑制劑
萬祥宏,蔡沐彬,游清徽
江西師范大學生命科學學院,南昌 330022
Janus激酶(Janus kinase,JAKs)屬于細胞內酪氨酸激酶家族,由JAK1、JAK2、JAK3和TYK2四個成員組成,在許多細胞因子受體的信號傳遞過程中起著中樞作用[1]。通過信號轉導子和轉錄激活子(signal transducers and activators of transcription,STATs)啟動下游靶基因,進而發揮其細胞生物功能的調控作用[2]。JAK-STAT信號通路在細胞的增殖、分化、凋亡和免疫調節等重要生物學過程均有參與,JAK-STAT信號通路的異常激活會加速癌細胞的增殖過程,例如急性早幼粒細胞白血病,其細胞系HT93A誘導分化時就會激活JAK-STAT,導致其增殖加快[3]。JAK-STAT通道還會被NADPH氧化酶激活,使得肝X受體的表達水平下降,大大影響了ATP三磷酸腺苷結合盒(AB-CA1)的表達,抑制THP-1泡沫細胞膽固醇的排出,導致動脈粥樣硬化的發病[4]。目前醫藥領域與之相關的研究多集中于癌癥、炎癥和心血管疾病,其中炎癥性疾病主要包括潰瘍性結腸炎,類風濕性關節炎及克羅恩病等。
JAK蛋白作為人體中重要的一種蛋白,靶點JAK蛋白設計的小分子抑制劑有許多,然而大多數由于口服生物利用率低、選擇性差等缺點都處于臨床的不同研究階段,獲得監管部門批準的上市JAK抑制劑迄今為止僅有兩個[5]。托法替尼(tofacitinib)是美國輝瑞公司研發的一種新型的JAK1/3抑制劑,于2012年11月6日獲得美國FDA批準上市,之后于2013年3月25日獲得日本PMDA批準上市。托法替尼作為第一代JAK抑制劑,通過抑制細胞質受體的下游信號來阻斷細胞因子的信號轉導[6],達到干擾JAK-STAT信號通路從而影響DNA轉錄的目的,在抗增殖和抗炎癥方面發揮了明顯的作用。雖然該藥物已經在臨床上得到廣泛應用,療效較好,但是在對疾病有效的同時,也產生了不良反應,包括但不限于腸胃不適、惡心、嘔吐、貧血、發熱、上呼吸道感染、肝酶和血脂升高,嚴重的還可能導致呼吸困難。不僅如此,托法替尼與強效免疫抑制劑例如他克莫司,環孢素合用還有增加免疫抑制作用的風險,導致藥物副作用加劇。
JAK3是JAK家族中唯一與細胞因子受體γc鏈相關聯的家族成員[7]。由于JAK3在細胞因子信號傳遞中具有極其重要的作用,且其僅在特定的組織中進行表達,因而抑制JAK3活性后導致免疫抑制但不會引發更多的非正常生理變化,這使得JAK3成為研究免疫抑制劑的重要靶標[8]。因此,開發療效確切、毒副作用輕微的JAK3抑制劑類藥物的需求仍十分迫切。通過分子對接虛擬篩選與托法替尼具有相似結合位點的中草藥成分小分子,有望獲得JAK3特異性抑制劑。
1 材料和方法
1.1 材料
1.1.1 JAK蛋白
JAK家族中的四種蛋白的三維結構數據來自RCSB PDB數據庫(https://www.rcsb.org/),JAK1、JAK2、JAK3和TYK2蛋白的PDB ID分別為6SM8、3FUP、3LXK和3LXN。所有結構都是具有藥物結合的復合體,其中3FUP、3LXK和3LXN結合的是藥物托法替尼。
PDB ID為6SM8和3FUP的蛋白是同源多聚體,只保留結構最完整的A鏈。
1.1.2 中草藥成分小分子
中草藥成分小分子結構文件從TCMSP數據庫(https://tcmspw.com/)下載,一共有13 445種小分子,下載格式為MOL2。
1.2 研究方法
1.2.1 分子對接
分子對接是結構生物學和計算機輔助藥物設計的關鍵工具,通過預測出受體和配體的結合構象和親和力來進行小分子改造和設計分子對接[9]。常見的分子對接工具有AutoDock、LeDock、MOE Dock、FlexX等。
本研究利用LeDock軟件(http://www.lephar.com/)對中草藥成分小分子與JAK3進行模擬對接。LeDock是由趙洪桃博士開發的分子對接軟件,其優點是小分子與蛋白質對接既快速又準確[10]。
對接盒子由GetBox-PyMol-Plugin插件(http://bioms.org/thread-1234-1-1.html)自動識別含配體的蛋白活性空腔確定。
1.2.2 圖表繪制
本研究中的表格以Excel軟件繪制,圖片由PyMOL2.3.0和Molecular Operating Environment (MOE) 2019.0102導出。
2 結果與分析
利用LeDock軟件進行分子對接,得到13 445種小分子與JAK3蛋白的對接結果。
2.1 對接結果的初步處理
考慮分子對接計算算法的近似性處理和配體結合蛋白時候復雜的熱力學、動力學性質導致很多預測結果并沒有顯示出生物活性,為控制篩選結果的假陽性,使用配體結合效率(ligand efficiency,LE)和結合能打分值來進行篩選[10]。對接結果以結合能打分值小于-6.0且配體結合效率大于0.4或結合能打分值小于-7.5且配體結合效率大于0.3作為范圍進行過濾,初步篩選出118種小分子。
2.2 對接結果的進一步處理
2.2.1 結構篩選
由于硫酸根、磷酸根、酚羥基與蛋白質的結合特異性差,作為藥物的副作用大,含有這些基團的小分子不適合作為JAK3特異性抑制劑。通過查找并分析結構,排除含有以上基團的小分子,得到40種符合條件的分子。
2.2.2 研究相關性篩選
根據分子的編號、名稱、結構在TCMSP數據庫(https://tcmspw.com/)、藥源網(https://www.yaopinnet.com/)等進行查找,選擇對相關疾病有潛在治療效果,且已經作為藥物、保健品成分或已有制備工藝的分子,得到18種小分子進行后續研究。
2.2.3 氫鍵數目篩選
用PyMOL保存18種小分子與3LXK蛋白結合的最佳構象,再用MOE軟件展現小分子與活性位點氨基酸殘基的相互作用,得到氫鍵數量等數據。分析對接結果,并與托法替尼進行對比,18種小分子以及托法替尼與3LXK的對接結合能、氫鍵數量及配體效率見表1。
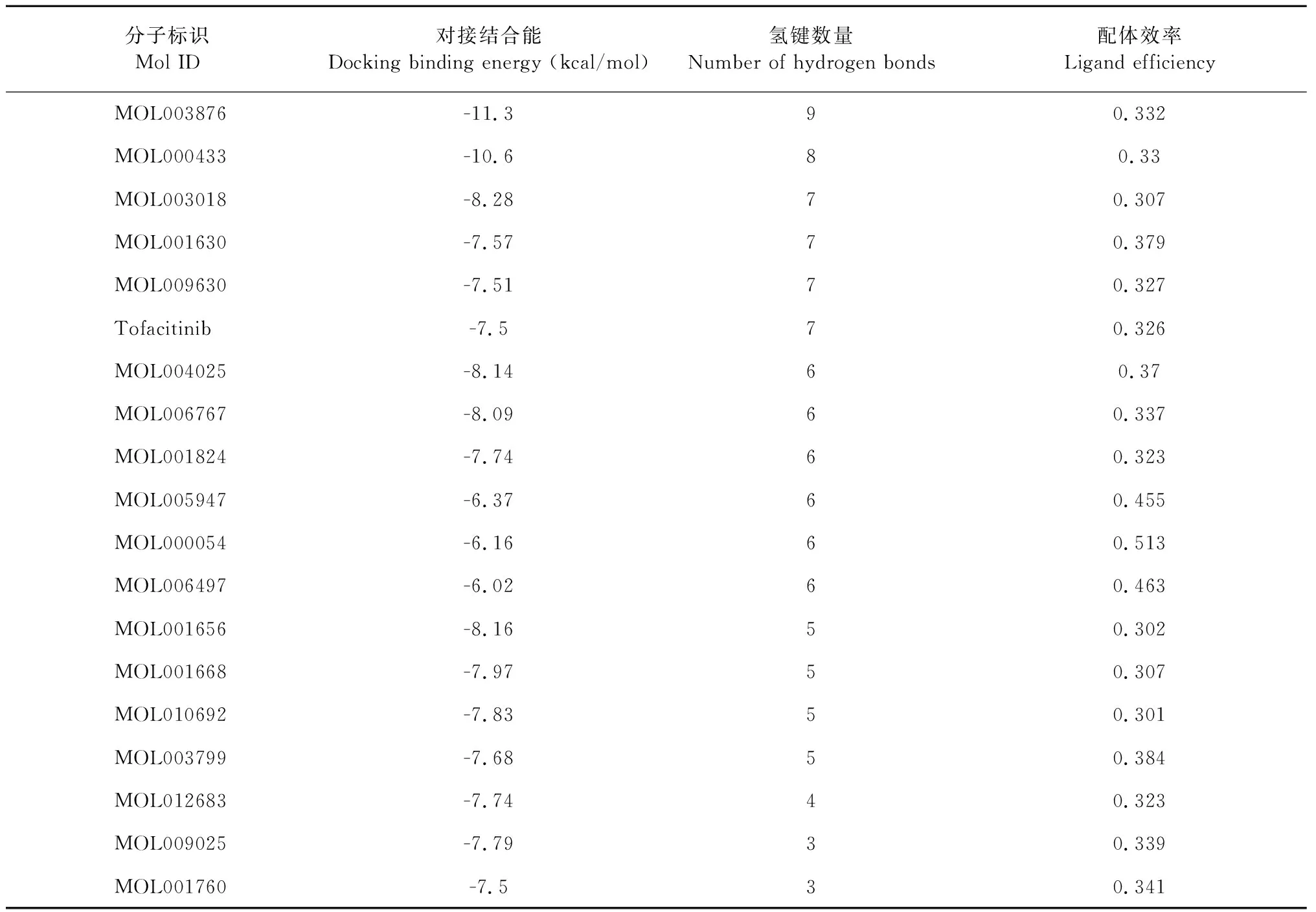
表1 18種小分子與3LXK的對接結合能、氫鍵數量及配體效率Table 1 Docking binding energy,number of hydrogen bonds,and ligand efficiency of 18 small molecules and tofacitinib with 3LXK
氫鍵是維系蛋白質與配體分子結合穩定性的重要作用力[11]。小分子在靶蛋白活性空腔內與氨基酸殘基形成的氫鍵數作為反映結合能力的另一指標,并比較采用托法替尼分子進行對接的打分值和配體結合效率,形成氫鍵數目越多,對接打分值越低,配體效率越高,則小分子與靶蛋白的結合能力越強。根據數值排名得出與JAK3的結合具有優勢的7種小分子,相關信息見表2。利用MOE軟件可視化配體小分子在靶蛋白活性空腔中與相關氨基酸殘基的相互作用,得到分子對接結果見圖1。
M1(戊二酸)與JAK3之間通過9個氫鍵相連,是所有配體分子中氫鍵數最多的。其中Leu905、Ala966、Lys830、Asn832、Asn954作為氫供體;Leu905、Asn832、Arg953、Asn954作為氫接受體。此外Leu828更是與配體分子形成pi-H鍵,使二者之間的結合更加緊密。二者之間的對接結合能更是只有-11.3 kcal/mol遠遠低于托法替尼的-7.5 kcal/mol。
M2(葉酸)與JAK3之間共有8個氫鍵相連,其對接結合能也低于托法替尼,僅有-10.6 kcal/mol。其中Arg953、Ala966、Pro906、Lys830、Glu903、Lys830、Asp967作為氫供體;Leu905作為氫受體。
M3(斷馬錢子苷)與JAK3之間的對接結合能為-8.28 kcal/mol,其中Asp967、Ala966、Leu905、Lys830、Leu905 作為氫供體分別形成一個氫鍵,Glu 903在結合時提供了兩個氫,此外,Lys830與Leu905為氫受體,一共形成7個氫鍵。
M4(巴豆苷)與JAK3的對接結合能為-7.57 kcal/mol稍高于托法替尼與JAK3結合的結合能,其中Met902、Ala966、Arg953、Leu828作為氫供體分別形成一個氫鍵,Glu 903則在結合時提供了兩個氫,Leu905作為氫受體,一共形成7個氫鍵。
M5(2-O-(β-D-吡喃葡萄糖基)-抗壞血酸)與JAK3的對接結合能稍高于托法替尼的結合能,為-7.51 kcal/mol,其中Arg953、Asp967、Asp949、Leu828作為氫供體分別形成一個氫鍵,Asn954則在結合時提供了兩個氫,Arg953作為氫受體,一共形成7個氫鍵。
M6(色胺)與JAK3的對接結合能為-8.14 kcal/mol,其中Ala966、Glu 903、Asn954作為氫供體分別形成1個氫鍵,Arg953在結合時提供了兩個氫,此外,Asn954、Asp967為氫受體,一共形成6個氫鍵。
M7(仙人掌黃質-1)與JAK3的對接結合能為-8.09 kcal/mol,Ala966、Leu828、Glu903、Lys830作為氫供體分別形成一個氫鍵,Asp967則在結合時提供了個氫,一共形成6個氫鍵。
分析小分子與JAK3蛋白的結合效果,反映其被篩選作為苗頭化合物對JAK3的抑制作用,并且發現JAK3蛋白活性位點處氨基酸殘基中,Arg953、Asp967、Lys830、Ala966和Asn954最容易與小分子配體的H、O原子形成氫鍵作用。這些氨基酸殘基在與小分子結合時發揮較為重要的作用,尤其以Arg953和Ala966與小分子配體形成氫鍵的機會最大,此外范得華力和靜電相互作用等非鍵相互作用在酶活性中心與小分子配體形成穩定的結合構象中也起了非常重要的作用[13]。
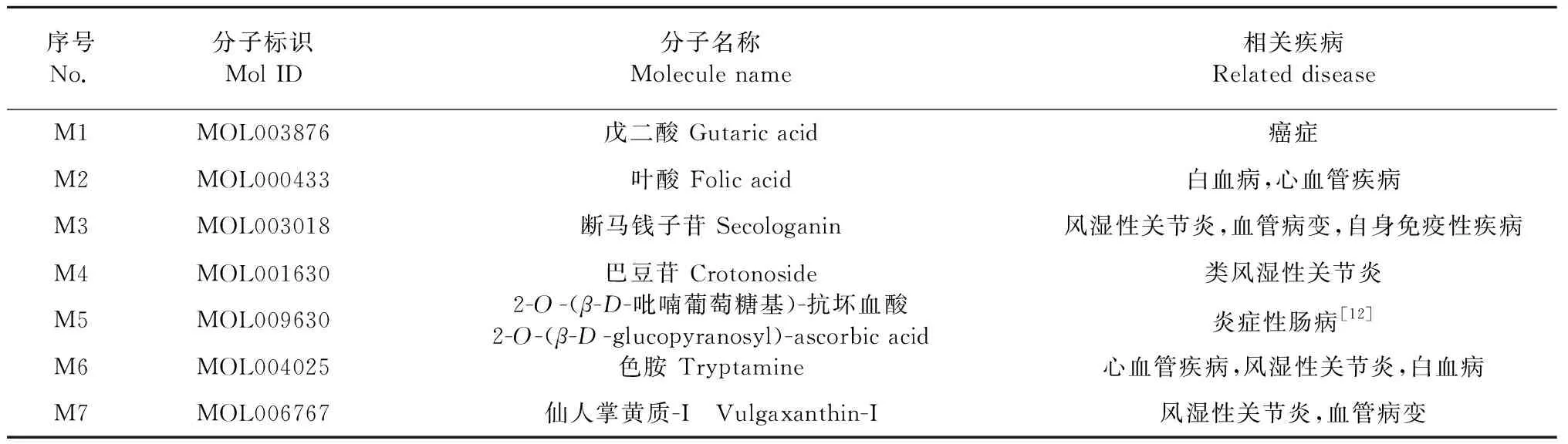
表2 7種優勢小分子的相關信息Table 2 Related information of 7 best small molecules
2.3 高選擇性篩選
為使小分子能與JAK3蛋白較好結合的同時,減小對其他JAK家族蛋白的影響,進行相應的高選擇性篩選。以JAK1、JAK2、TYK2為靶蛋白,將M1~M7這7種小分子分別與這三個蛋白對接,結果見表3,篩選出僅與JAK3對接效果好,與其他JAK3家族蛋白對接效果差的小分子,從而獲得JAK3激酶的高選擇性抑制劑。
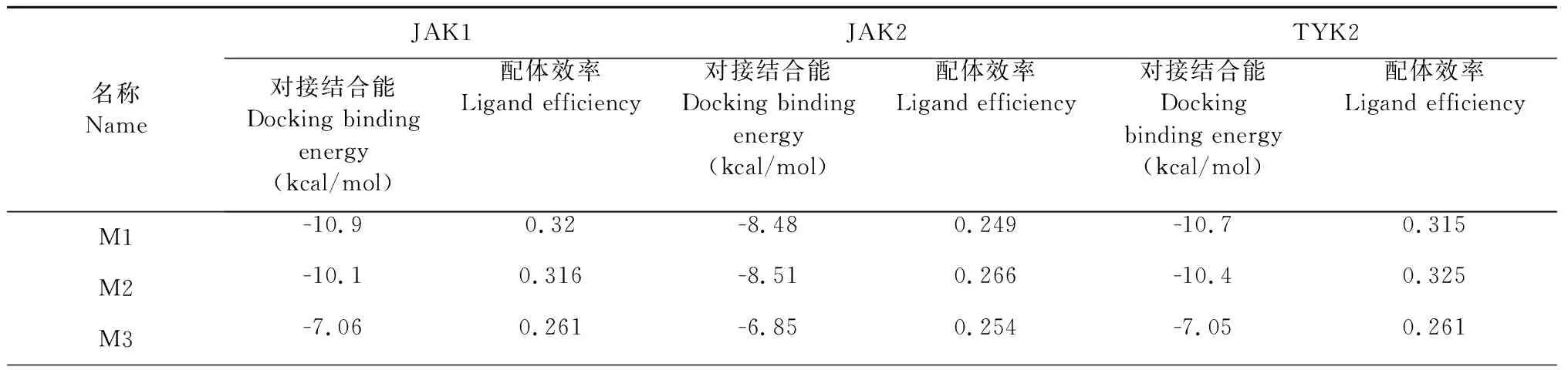
表3 7種小分子與JAK1、JAK2、TYK2的對接結合能及配體效率Table 3 Docking binding energy and ligand efficiency of 7 small molecules with JAK1,JAK2 and Tyk2
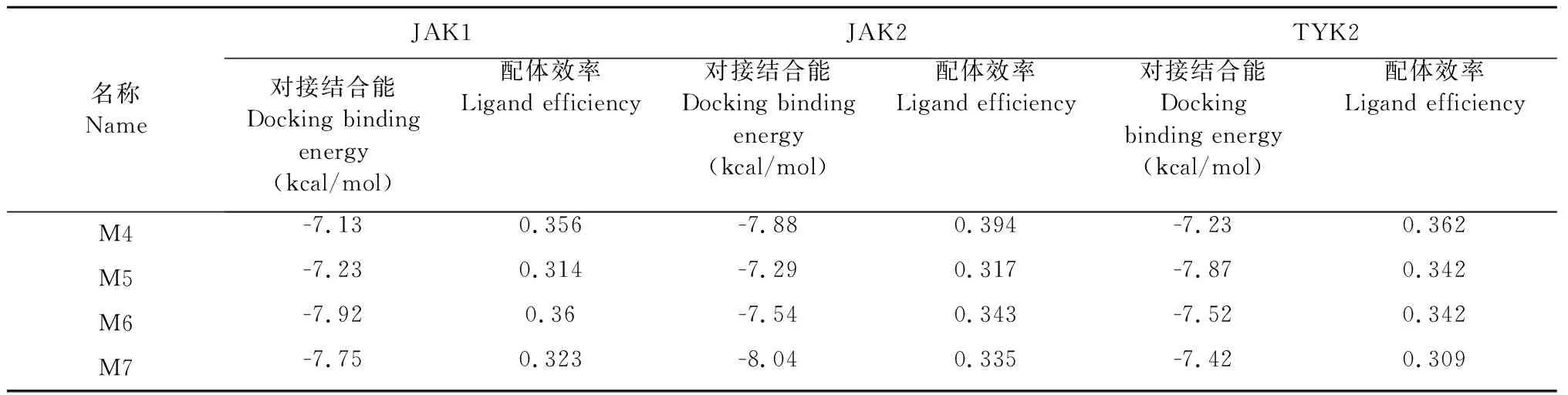
續表3(Continued Tab.3)
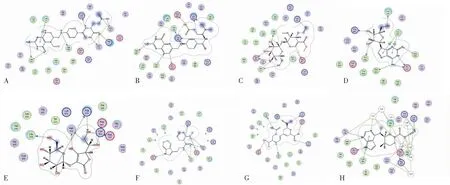
圖1 小分子與JAK3蛋白的分子對接圖Fig.1 Molecular docking diagram of small molecules and JAK3 protein注:A~H分別為戊二酸、葉酸、斷馬錢子苷、巴豆苷、2-O-(β-D-吡喃葡萄糖基)-抗壞血酸、仙人掌黃質-I和托法替尼與JAK3蛋白的分子對接圖。Note: A~H are the molecular docking respectively picture of glutaric acid,folic acid,secologanin,crotonoside,2-O-(β-D-glucopyranosyl)-ascorbic acid,tryptamine,vulgaxanthin-I,tofacitinib and JAK3 protein.
以對接打分值小于-7.5且配體結合率大于0.3作為小分子與靶蛋白對接效果好的大致標準,發現M6與三個靶蛋白對接效果好;M1、M2、M7與兩個靶蛋白對接效果好(其中M1、M2與JAK1和TYK2對接效果好,M7與JAK1和JAK2對接效果好);M4、M5只與其中一個靶蛋白對接效果好,對應分別是JAK2、TYK2蛋白。最終,只有M3(斷馬錢子苷,secologanin)與三個靶蛋白對接效果差,展現其與JAK3蛋白的高選擇性結合(見圖2)。
為進一步驗證斷馬錢子苷的高選擇性,在參考軟件算法輔助打分的基礎上,利用MOE軟件,展現活性空腔內小分子與周圍氨基酸殘基的相互作用,并借助其report功能,得到各氫鍵的作用力大小,驗證可得:相比于其他JAK家族蛋白,斷馬錢子苷在JAK3蛋白活性空腔內,與周圍氨基酸殘基產生更多更強的氫鍵作用力,更穩定地結合在其中,證實了它對JAK3蛋白高選擇性的抑制作用。
3 討論與結論
以上對接結果顯示,中草藥成分小分子戊二酸(glutaric acid)、葉酸(folic acid)、斷馬錢子苷(secologanin)、巴豆苷(crotonoside)、2-O-(β-D-吡喃葡萄糖基)-抗壞血酸(2-O-(β-D-glucopyranosyl)-ascorbic acid)、色胺(tryptamine)、仙人掌黃質- I(vulgaxanthin- I)與JAK3激酶的結合能力強于托法替尼(Tofacitinib),可以作為候選的JAK3激酶抑制劑。對結合位點進行匯總分析發現,JAK3激酶活性空腔中的Arg953、Asp967、Lys830、Ala966和Asn954氨基酸殘基容易與小分子抑制劑的H、O原子形成氫鍵作用,是JAK3抑制劑的開發設計的關鍵。
在7種小分子中,斷馬錢子苷(secologanin)與其他JAK家族蛋白對接結合效果差,表現出與JAK3蛋白結合的高選擇性,有進一步研究設計成為JAK3激酶特異性抑制劑的價值。斷馬錢子苷存在于金銀花[15]和馬錢子等植物中。金銀花(LoniceraeJaponicaeFlos)是我國的傳統中藥,具有增強免疫力、抗腫瘤、降血糖血脂、消炎、解熱等功效[15],藥用歷史悠久,臨床用途十分廣泛;馬錢子(Strychnosnux-vomicaL.)被研究發現能夠影響與類風濕關節炎發病有關的JAK-STAT通路[16]。根據本研究的結果,斷馬錢子苷可能具備與托法替尼類似的藥理機制,通過與JAK3蛋白結合,抑制JAK磷酸化,進而抑制STAT磷酸化,從而阻斷JAK-STAT信號轉導通路,抑制多種炎癥細胞因子的合成與分泌,達到抗炎、調節免疫的作用[17]。托法替尼對JAK1和JAK3激酶都能發揮抑制作用,而斷馬錢子苷與JAK3的結合作用具有高度選擇性,作為JAK3激酶抑制劑的特異性更強。此外,斷馬錢子苷還是金銀花等常用中藥的成分,具有綠色性、易獲取、毒副作用小等特點,值得作為JAK3特異性抑制劑進行深入研究。
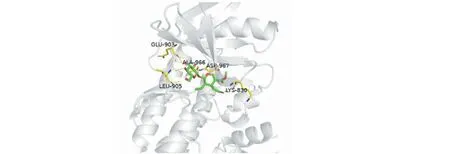
圖2 斷馬錢子苷與JAK3的相互作用Fig.2 The interaction between secologanin and JAK3

