DC-CIK免疫治療聯合化療對晚期結直腸癌患者的臨床療效*
張正聰 朱曉亮 張彥軍 袁得峰 呂鵬飛 白小平 朱克祥
(1.蘭州大學第一醫院東崗院區普外科,甘肅 蘭州 730000;2.蘭州大學第一醫院東崗院區消化內科,甘肅 蘭州 730000;3.蘭州大學第一醫院普外二科,甘肅 蘭州 730000)
結直腸癌(Colorectal cancer, CRC)是最常見的消化道惡性腫瘤之一,在全球各類惡性腫瘤中發病率位居第3位,死亡率位居第2位[1],我國CRC的發病率及死亡率在所有惡性腫瘤中均居第5位[2],并呈逐年上升的趨勢。由于CRC患者就診時多數已進入進展期甚至已發生遠處轉移,目前對于晚期CRC患者只能采取化療為首的綜合性治療[3],但化療在對腫瘤細胞進行滅活的同時,也會一定程度上損害患者的免疫功能[4]。因此,探索一種更安全有效的晚期CRC治療方式已成為臨床亟待解決的問題。隨著生物治療的深入研究,也為晚期CRC的治療提供了新的思路。樹突狀細胞(Dendritic cell, DC)-細胞因子誘導的殺傷細胞(Cytokine induced killer cell, CIK)能夠使腫瘤細胞對淋巴細胞的敏感性增強,可以提高機體抗腫瘤的免疫能力[5],并且由于其較小的毒副反應,安全性也得到了許多學者認可[6]。本研究對晚期CRC患者在應用DC-CIK免疫治療聯合化療后的療效進行回顧性分析,評價其治療的有效性和安全性,旨在為臨床應用提供參考。
1 資料與方法
1.1 資料
1.1.1 臨床資料 選取2013年6月~2016年1月期間在蘭州大學第一醫院東崗院區住院治療的晚期CRC患者90例,其中采用DC-CIK免疫治療聯合CapeOX方案化療的45例晚期CRC患者為觀察組,僅采用CapeOX方案化療的45例晚期CRC患者為對照組。納入標準:①所有患者依據美國癌癥聯合委員會結直腸癌TNM分期標準(第八版)[7]進行分期。②病理證實為結直腸癌,臨床分期為Ⅲ期或Ⅳ期,未能行手術治療。③卡氏評分(KPS)≥60分,預計生存時間≥3個月。④血常規及肝腎功能均正常。⑤治療前均向患者或家屬告知病情、治療方案及可能出現的不良反應,并簽署DC-CIK免疫治療和化療知情同意書。排除標準:①合并心、肺等嚴重器官功能衰竭或其他惡性腫瘤者。②不能耐受化療及對生物制品有過敏史者。③長期服用免疫抑制劑者。④合并精神障礙者。⑤臨床資料不完整者。本研究獲得醫院倫理委員會批準。
1.1.2 實驗試劑及儀器 淋巴細胞培養基(美國Gibco公司),粒細胞-巨噬細胞集落刺激因子(GM-CSF)(廈門特寶生物科技有限公司),鼠抗人CD3單克隆抗體(北京博奧森生物科技有限公司),白細胞介素-4(IL-4)(上海創未生物技術有限公司),重組人白細胞介素-2(rhIL-2)(長春生物制品研究所),淋巴細胞分離液(上海山進生物科技有限公司),血細胞分離機(美國Terumo BCT公司)。奧沙利鉑注射液(江西恒瑞醫藥有限公司),卡培他濱片(上海羅氏制藥有限公司)。
1.2 方法
1.2.1 制備自體腫瘤細胞抗原 將腫瘤組織研磨成漿,經膠原酶消化后制成腫瘤單細胞懸液,用分離液分離后制成原代結直腸癌細胞,再經過多次傳代并收集,連續洗滌3次后裂解細胞,過濾收集上清液儲存備用。
1.2.2 DC-CIK細胞培養及回輸 取外周血后離心獲得單個核細胞,并接種于淋巴細胞培養基中。①DC細胞培養:收集懸浮細胞,將貼壁細胞加入含有GM-CSF及IL-4的培養基中,第7天加入自體腫瘤細胞抗原,致敏后獲取DC細胞。②CIK細胞培養:將懸浮細胞加入含有CIK細胞因子的淋巴細胞培養基中,1 d后加入rhIL-2及抗人CD3單克隆抗體,至第7天與DC細胞共同培養,最終收獲DC-CIK細胞。③DC-CIK細胞回輸:回輸前檢測細菌、真菌、內毒素和支原體等均為陰性。回輸細胞活率>95%,細胞數量≥1.0×109個/次。
1.2.3 治療方案 根據中國結直腸癌診療規范(2020版)[8],兩組患者均采用CapeOX化療方案:第1~14天,卡培他濱1000 mg/m2;第1天,奧沙利鉑130 mg/m2;用藥結束后休息1周,3周為1個化療周期,3個化療周期結束后進行療效評價,根據患者耐受情況,入組患者共進行6~8周期化療,在化療期間常規給予保肝、止吐及抗過敏等對癥治療。觀察組患者在予以化療前采外周血用于培養DC-CIK細胞,采血后當日按上述方案進行化療,并于第8天回輸DC細胞,第11天回輸CIK細胞,第14天回輸DC-CIK細胞,每3周為1個周期,接受3個周期治療后評價療效。
1.2.4 觀察指標 ①免疫功能評價:通過檢測治療前及治療3周期后兩組患者T細胞亞群(包括CD3+、CD3+CD4+、CD3+CD8+、NK及NKT細胞)比例,對患者免疫功能進行評價。②近期療效評價:3周期治療后通過實體瘤療效評價標準(Response evaluation criteria in solid tumors,RECIST)評定兩組患者的療效。完全緩解(Complete response,CR):全部靶病灶消失,且腫瘤標志物水平正常,至少維持4周;部分緩解(Partial response,PR):靶病灶最大徑之和減少≥30%,至少維持4周;疾病穩定(Stable disease,SD):靶病灶最大徑之和縮小<30%,或增大幅度<20%;疾病進展(Progressive disease,PD):靶病灶最大徑之和增大幅度≥20%,或出現新病變或轉移灶。疾病有效率(Response rate,RR)=(CR+PR)/n×100%,疾病控制率(Disease control rate,DCR)=(CR+PR+SD)/n×100%。③不良反應評價:治療期間對兩組患者按照美國國立癌癥研究所《急性和亞急性毒性反應表現及分度標準》(NCI-CTCAEv4.0)[9]進行不良反應評價,分為0~Ⅳ度,包括發熱、骨髓抑制、胃腸道反應及肝功能異常等。④遠期療效評價:DC-CIK免疫治療及化療結束后每月進行1次電話或者醫院復查隨訪,記錄患者的生存情況和腫瘤的復發時間。首要研究終點為病情進展,次要研究終點為死亡,對兩組患者無進展生存(Progression-free survival,PFS)以及總生存(Overall survival,OS)情況進行評價。

2 結果
2.1 兩組患者一般資料比較 兩組患者的性別、年齡、臨床分期、分化程度、原發部位及病理分型等一般資料比較,差異無統計學意義(P>0.05)。見表1。
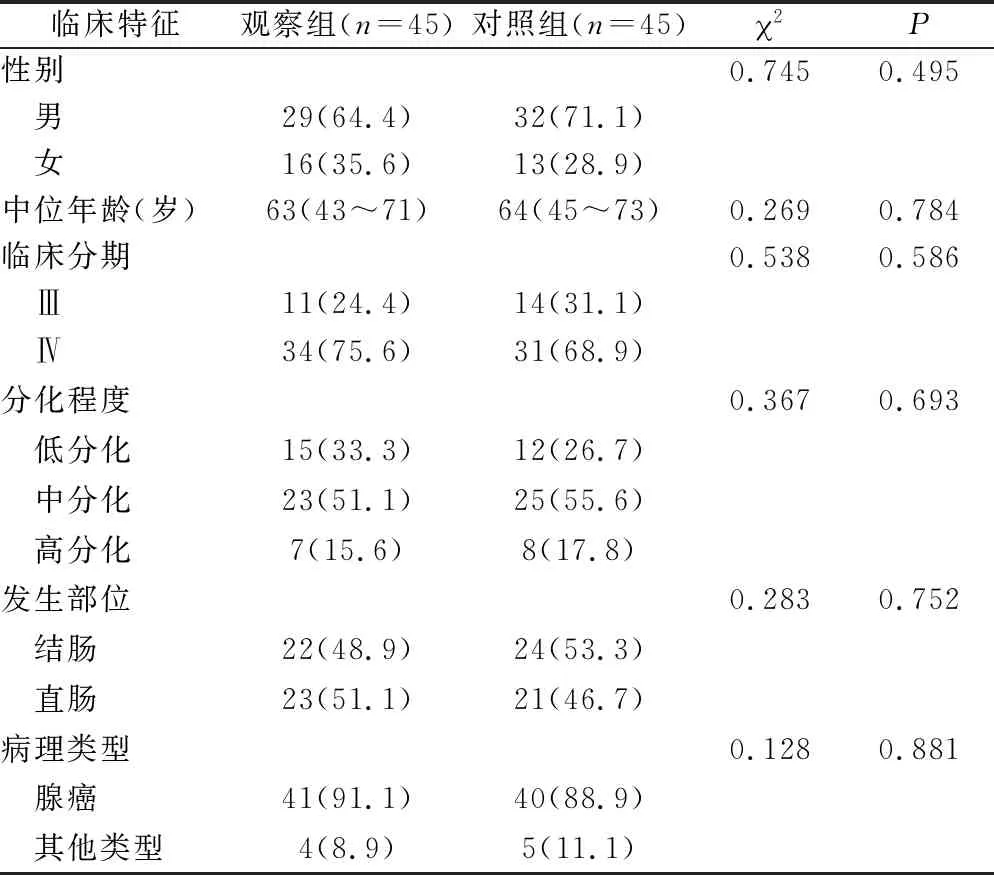
表1 兩組患者基線資料比較[n(×10-2)]
2.2 外周血T細胞亞群比例變化 對兩組患者治療前及治療3周期后外周血中T細胞亞群的比例變化進行比較,結果顯示,觀察組治療前后外周血中CD3+、CD3+CD4+、CD3+CD8+、NK及NKT細胞比例無明顯變化(均P>0.05),而對照組治療后外周血中CD3+、CD3+CD4+、CD3+CD8+、NK及NKT細胞比例較治療前顯著下降(均P<0.05);兩組間治療后比較,對照組CD3+、CD3+CD4+、CD3+CD8+、NK及NKT細胞比例明顯低于觀察組(均P<0.05)。見表2。
表2 兩組患者治療前后外周血中T細胞亞群流式檢測比較
2.3 近期療效評價 3周期治療后,以CT等方法檢測兩組患者RR無統計學差異(P>0.05);觀察組DCR明顯高于對照組(P<0.05)。見表3。
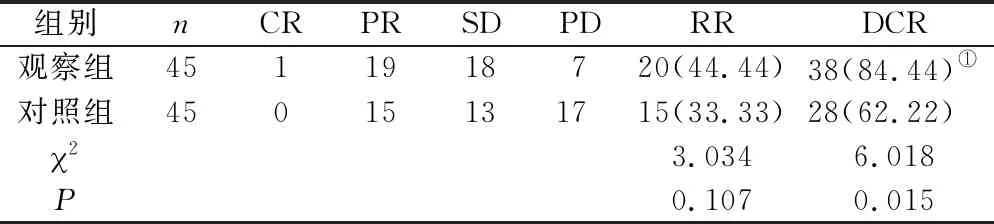
表3 兩組患者治療前后近期療效評價[n(×10-2),n=45]
2.4 兩組患者不良反應發生率比較 兩組患者的主要不良反應表現為骨髓抑制、胃腸道反應、發熱及肝功能異常等,對癥治療后均可緩解。治療期間觀察組和對照組白細胞減少、血小板減少發生率分別為55.6%、42.2%和75.6%、64.4%,兩組比較差異均有統計學意義(P<0.05)。觀察組和對照組腹瀉發生率分別占15.6%和35.6%,兩組比較有明顯差異(P<0.05)。其他相關不良反應,如貧血、發熱、肝功能異常、外周神經毒性及惡心、嘔吐等無統計學差異(P>0.05),均經對癥處理后恢復正常。見表4。
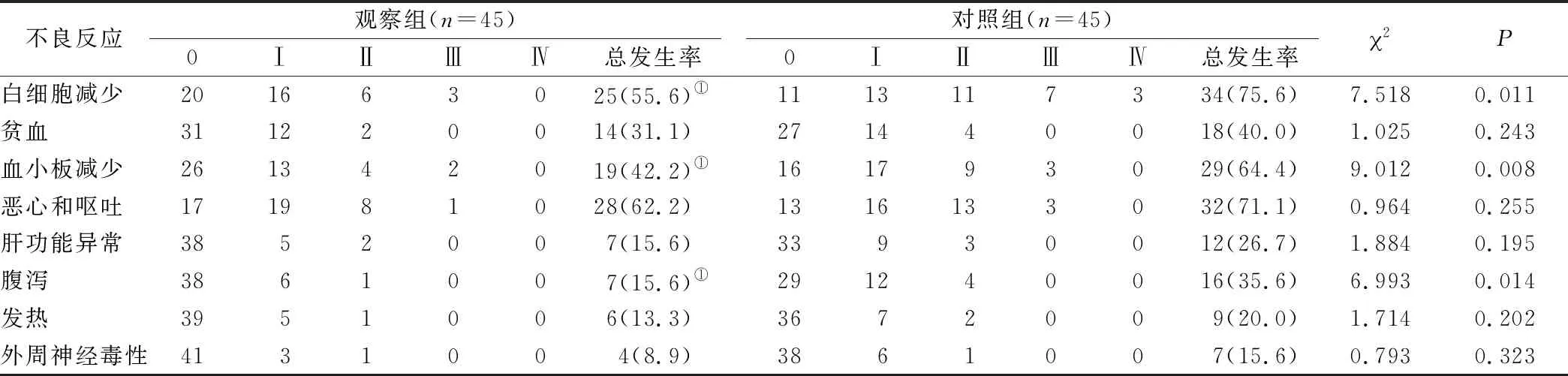
表4 兩組患者治療后不良反應發生率比較[n(×10-2)]
2.5 遠期療效的評價 治療結束后對兩組患者定期復查并隨訪,對照組患者的PFS為3~22個月,中位PFS為6.5個月;觀察組患者的PFS為3~26個月,中位PFS為10.5個月。經Log-rank檢驗,兩組患者PFS差異有統計學意義(2=4.748,P=0.029)(圖1)。對照組患者的OS為6~30個月,中位OS為15個月;觀察組患者的OS為7~32個月,中位OS為19個月。經Log-rank檢驗,兩組患者OS差異無統計學意義(2=2.379,P=0.123),見圖2。
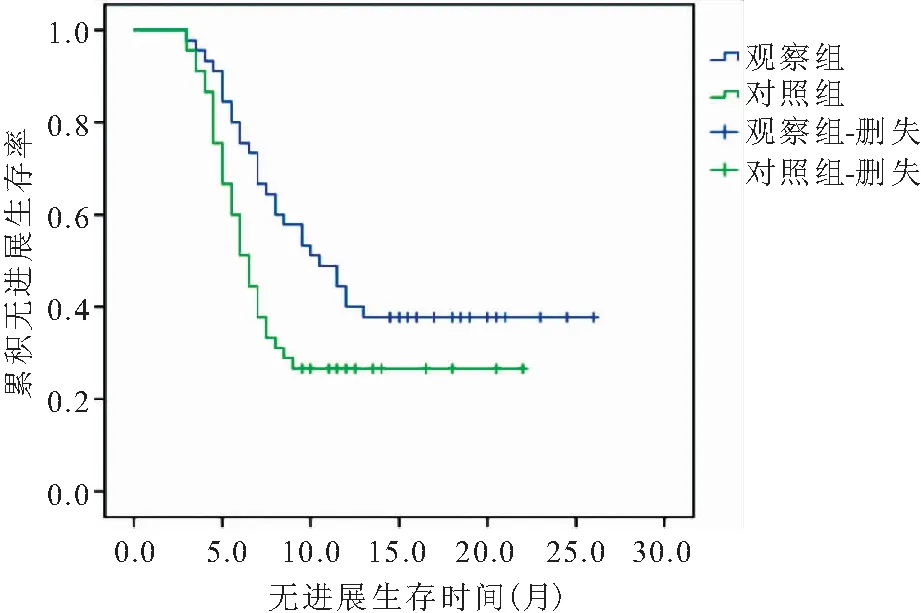
圖1 兩組患者PFS曲線

圖2 兩組患者OS曲線
3 討論
隨著當前手術及放化療等抗腫瘤方法在CRC治療中的聯合使用,CRC患者的治愈率明顯升高,并且生存期也逐漸延長,但傳統的抗腫瘤方法在一定程度上會對機體的免疫功能造成不可逆的損害,從而導致出現頻發的不良反應[10],因此,腫瘤免疫治療作為目前第四種抗腫瘤手段而被深入研究,并且已經在一些實體腫瘤的治療上取得了顯著療效[11]。腫瘤免疫治療是將大量增殖產生并擁有特定功能的免疫細胞回輸機體內,可重塑腫瘤患者免疫系統,清除體內腫瘤微小病灶及殘留的癌細胞,并減少傳統方法治療后不良反應的發生[12]。
DC細胞作為目前倍受關注的專職抗原呈遞細胞,具有攝取、加工及呈遞抗原的作用,并且能有效激活T細胞介導的免疫反應,是機體抗腫瘤免疫反應的啟動者和調控者[13]。既往臨床研究[14]也已證實DC細胞對一些惡性腫瘤的治療有明顯療效。CIK細胞是在體外分離、培養及擴增后獲得的異質性細胞群,具有一定的免疫特性,不僅準確識別并直接清除腫瘤細胞,還可通過調節機體免疫系統間接滅活腫瘤細胞[15],具有培養簡單、抗瘤活性高及使用安全等特點[16]。有研究表明,DC和CIK細胞共同培養后,不僅具有比CIK細胞更強的抗腫瘤活性,而且還能加速T細胞增殖,發揮更強的殺傷腫瘤作用[17],明顯提高患者的免疫功能,最終有效地抑制腫瘤的生長[18]。
本研究回顧性分析了DC-CIK免疫治療聯合化療對晚期CRC患者的療效及安全性,結果顯示,化療后機體的免疫功能明顯下降,而化療聯合DC-CIK免疫治療后機體免疫功能下降不明顯,說明聯合治療有可能恢復機體的抗腫瘤免疫功能,使機體保持較好的免疫狀態[19]。化療聯合DC-CIK免疫治療也顯著提高了晚期CRC患者的DCR、PFS,而RR、OS雖有延長的現象,但差異并不明顯,其可能的原因是由于腫瘤組織的免疫抑制性,致使免疫細胞難以在腫瘤實體內發揮作用[20]。本研究還表明,化療聯合DC-CIK免疫治療可使患者骨髓抑制和腹瀉的發生率顯著下降。說明DC-CIK免疫治療不但可以延長生存期,還能提高患者的生存質量,并具有較高的安全性。但由于本研究樣本量較小,隨訪時間有限,故研究結果仍需進一步予以證實。
4 結論
DC-CIK免疫治療聯合化療能夠明顯改善晚期結直腸癌患者的免疫功能,提高抗腫瘤療效,延長無進展生存時間,減少不良反應發生率,可在臨床推廣應用。

