甲醇同系化制乙醇熱力學研究
劉說,劉曉旭,寇巍,何萍,李明楊,姜沐彤
(1.營口理工學院化學與環境工程學院,遼寧 營口 115014;2.遼寧省化學助劑合成與分離省市共建重點實驗室,遼寧 營口 115014)
0 引言
燃燒化石燃料會對環境造成一定的污染[1],[2]。保護環境已經成為了新世紀的重要課題,燃料乙醇作為一種清潔能源也逐漸走進了大眾的視野[3]。在生產乙醇的方法中,傳統的發酵法是利用高粱、玉米等糧食作物作為原料。2007年國家發改委出臺了《關于促進玉米深加工業健康發展的指導意見》,要求不再建設新的以玉米為主要原料的燃料乙醇項目,并大力鼓勵發展以非糧作物為原料開發燃料乙醇。
在眾多化學合成乙醇方法中,甲醇同系化制乙醇具有一定的優勢[4],[5]。從原料來源上看,一氧化碳可源于水煤氣和使用合成氨的方法得到,氫氣可以采用煤氣化制氫技術和電解水等方法得到,甲醇則可以通過劣質高硫煤和焦爐氣回收利用得到,也可以從生物質(林木、有機垃圾等)提取。從經濟角度分析,一氧化碳和甲醇作為碳源幾乎均來自煤炭,并且煤的價格也相對低廉。到目前為止,甲醇同系化制乙醇催化劑的研究已有報道[4],[6]~[10]。陳英贊[4]研究了甲醇和合成氣作為原料,以Rh-Ru為雙金屬、1,3—雙(二苯基膦)丙烷為配體、碘甲烷為促進劑催化甲醇還原羰基化制乙醇,研究結果表明,在壓力為6.0 MPa、溫度為140℃、n(H2):n(CO)=2:1條件下,甲醇轉化率達96.16%,乙醇選擇性達30.79 %。Portillo Crespo M A[8]研究了當進料中甲醇濃度由0增加到8%(摩爾濃度)時,乙醇和高級醇的產率提高了兩倍以上。在甲醇含量較低的情況下,添加甲醇對乙醇的選擇性有積極的影響。但是,目前關于甲醇同系化制乙醇熱力學方面的研究還未見文獻報道。
本文針對甲醇同系化制乙醇進行熱力學研究,為拓寬催化劑的研制提供了必要的理論依據,并對實驗研究制乙醇路線提供理論指導。
1 模擬計算方法
本文采用商業軟件HSC Chemistry 6.0(Outokumpu公司產品)進行熱力學計算,各種物質的熱力學數據由商業軟件的數據庫給出[11]。熱力學模擬過程無需具體的反應和催化劑,只需反應壓力、反應溫度、進料組成比和平衡組成。所有計算均基于一個封閉的系統,在平衡系統中考慮17種主要組成,分別為氫氣、二氧化碳、一氧化碳、甲醇、乙醇、水、乙醛、乙酸、丙醇、異丁醇、甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯、二甲醚、乙二醇和碳,除碳以石墨形態存在外,其他16種組成均以氣體形式存在[4],[9],[12],[13]。本文研究壓力、溫度和氫碳比對原料轉化率、醇選擇性等指標的影響。
原料轉化率計算式為
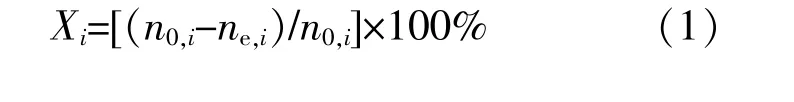
式中:Xi為原料i的轉化率,%;n0,i為原料中反應物i的摩爾數,mol;ne,i為產物i的平衡摩爾數,mol。
醇選擇性計算式為
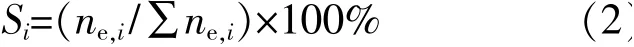
式中:Si為醇i的選擇性,%;ne,i為醇i的平衡摩爾數,mol。
2 結果與分析
2.1 合成氣制乙醇
本文通過HSC Chemistry 6.0軟件模擬計算了壓力(0.1,2,4 MPa)、溫度(150,200,250,300,350,400,450℃)、氫碳比(H2/CO物質的量比)(0.5:1,1.0:1,1.5:1,2.0:1,2.5:1,3.0:1,3.5:1,4.0:1)對合成氣制乙醇反應的一氧化碳轉化率、氫氣轉化率以及乙醇選擇性的影響。
2.1.1 一氧化碳轉化率
當壓力分別為0.1,2,4 MPa時,一氧化碳轉化率與溫度和氫碳比的關系如圖1所示。從圖1(a)可以看出:當壓力為0.1 MPa,溫度為150~350℃時,在任意氫碳比下,一氧化碳均能完全轉化;當溫度為400~450℃時,一氧化碳轉化率隨著氫碳比的增加而增加,隨著溫度的升高而降低。分析圖1(b),(c)可知,當壓力分別為2 MPa和4 MPa時,一氧化碳轉化率的變化趨勢與圖1(a)中相似,不同之處在于一氧化碳完全轉化的范圍有所增大。綜上可知,提高壓力和氫碳比對一氧化碳轉化率影響不大,而提高溫度可使一氧化碳轉化率有所降低。

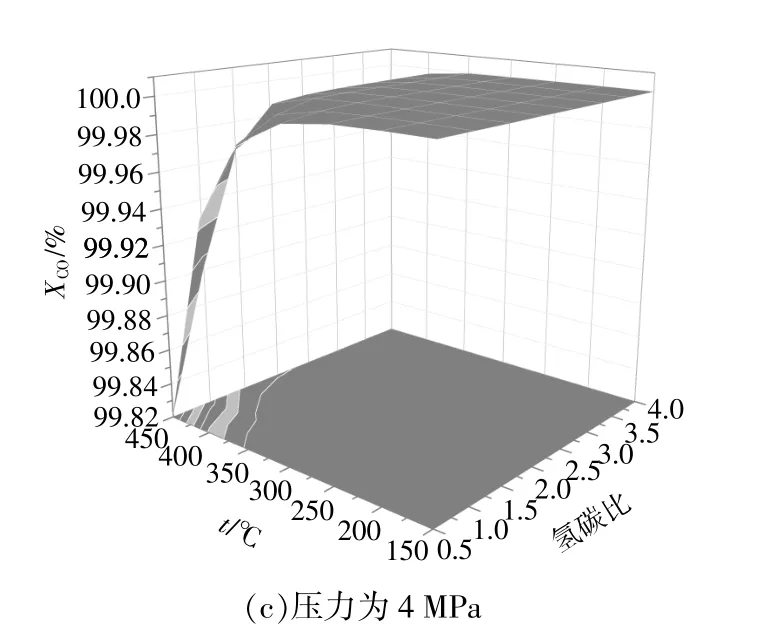
圖1 一氧化碳轉化率Fig.1 The conversion of carbon monoxide
2.1.2 氫氣轉化率
當壓力分別為0.1,2,4 MPa時,氫氣轉化率與溫度和氫碳比的關系如圖2所示。從圖2(a)可以看出:當壓力為0.1 MPa,溫度為150 ~400 ℃時,氫氣轉化率隨著氫碳比的增加而逐漸降低,隨著溫度的升高而逐漸降低。分析圖2(b),(c)可知,當壓力分別為2 MPa和4 MPa時,氫氣轉化率的變化趨勢與圖2(a)中相似,不同之處在于氫氣完全轉化的范圍有所增大。綜上可知,提高壓力對氫氣轉化率影響不大,而提高溫度和氫碳比可使氫氣轉化率有所降低。
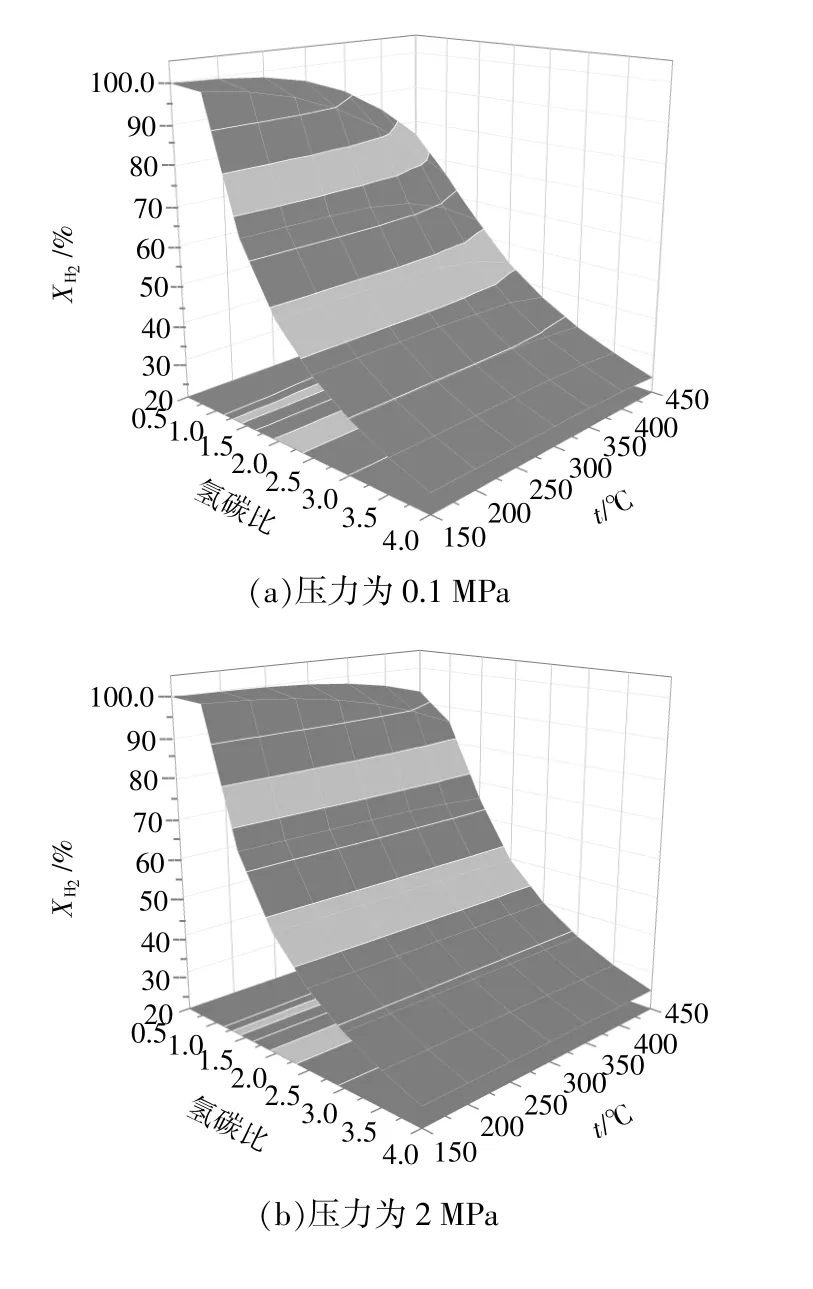
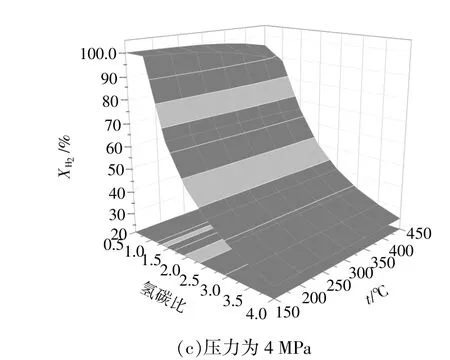
圖2 氫氣轉化率Fig.2 The conversion of hydrogen
2.1.3 乙醇選擇性
當壓力分別為0.1,2,4 MPa時,乙醇選擇性與溫度和氫碳比的關系如圖3所示。從圖3(a)可以看出:當壓力為0.1 MPa,溫度為150 ~250 ℃時,乙醇選擇性隨著氫碳比的增大而增大;當溫度為300 ~450 ℃時,乙醇選擇性隨著氫碳比的增大變化不大,隨著溫度的升高而降低。分析圖3(b),(c)可知,當壓力分別為2 MPa和4 MPa時,乙醇選擇性的變化趨勢與圖3(a)中相似,不同之處在于圖3(c)中:溫度為150℃時,乙醇選擇性隨著氫碳比的增大先增大后降低,在氫碳比為2.0:1時出現最大值;當溫度為200~450℃時,乙醇選擇性隨著氫碳比的增大而升高。綜上可知,在低溫、高氫碳比條件下提高壓力有利于乙醇的生成。

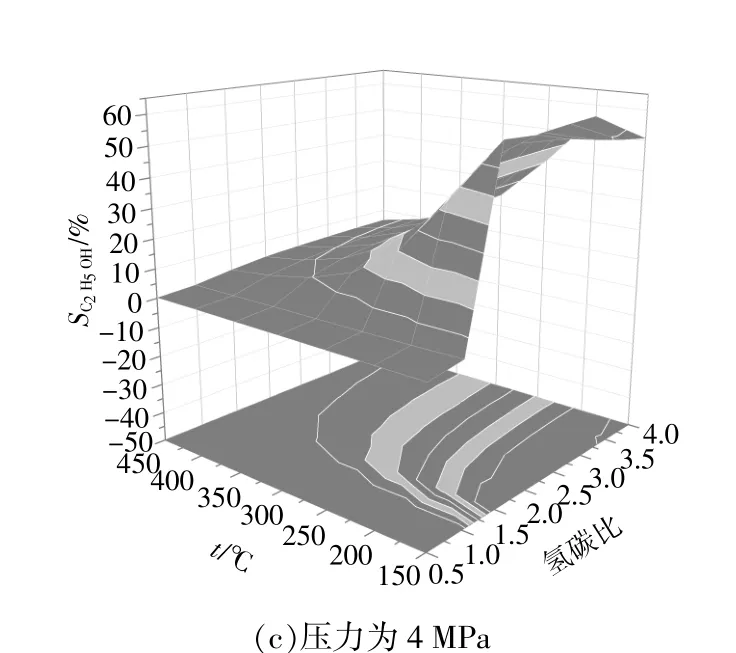
圖3 乙醇選擇性Fig.3 The selectivity of ethanol
結合圖1~3可知,增加壓力有利于乙醇的生成、一氧化碳和氫氣的轉化,原因在于增加壓力發生了合成氣制甲醇反應,繼而發生甲醇同系化反應,增加壓力均促進兩種反應的進行。增加氫碳比有利于乙醇的生成和一氧化碳的轉化,卻不利于氫氣的轉化,原因在于增加氫碳比發生了合成氣制甲醇反應,繼而發生甲醇同系化反應、一氧化碳和水生成二氧化碳和氫氣的反應、水和碳生成合成氣的反應。生成的合成氣再進一步反應生成甲醇。提升溫度不利于乙醇的生成、一氧化碳和氫氣的轉化,原因在于溫度升高抑制了合成氣制甲醇反應,進而抑制了甲醇同系化反應。
由圖1~3分析可知,在壓力為2~4 MPa、溫度為150~200℃、氫碳比為1.5:1~4.0:1條件下,有利于乙醇的生成。
2.2 甲醇同系化制乙醇
本文通過HSC Chemistry 6.0軟件模擬計算了壓力(4 MPa)、溫度(120,150,200,250,300,350,400,450℃)、氫碳比[H2/(CO+MeOH)物質的量比=2.0:1]、甲醇(MeOH)加入量(0.0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 mol(保持總碳數不變,即MeOH加入量與CO總摩爾數為1 mol)對甲醇同系化制乙醇反應的一氧化碳轉化率、氫氣轉化率、甲醇轉化率以及乙醇選擇性、丙醇選擇性、異丁醇選擇性的影響。
2.2.1 原料MeOH/CO比的影響
當壓力為4 MPa,溫度為150 ℃時,一氧化碳轉化率、氫氣轉化率、甲醇轉化率與甲醇加入量的關系如圖4所示。由圖4可知,隨著甲醇加入量的增加,一氧化碳與甲醇完全轉化且一直大于氫氣轉化率。氫氣轉化率隨著甲醇加入量的增加而降低。
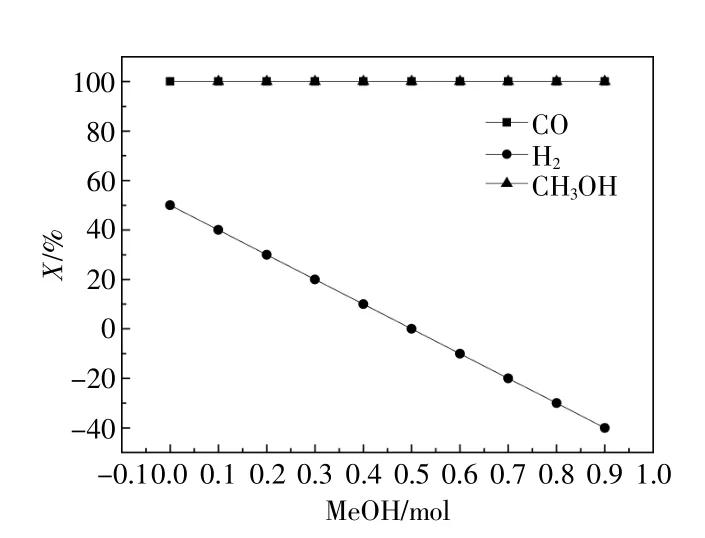
圖4 原料轉化率Fig.4 The conversion of raw materials
乙醇選擇性、丙醇選擇性、異丁醇選擇性與甲醇加入量的關系如圖5所示。由圖5可知,隨著甲醇加入量的增加,丙醇和異丁醇選擇性逐漸升高,乙醇選擇性先增加后降低,甲醇加入量為0.1 mol時,乙醇選擇性達到最大值。在所考察范圍內,乙醇選擇性一直大于丙醇和異丁醇選擇性。由圖4,5可知,甲醇加入量為0.1 mol時有利于乙醇的生成。
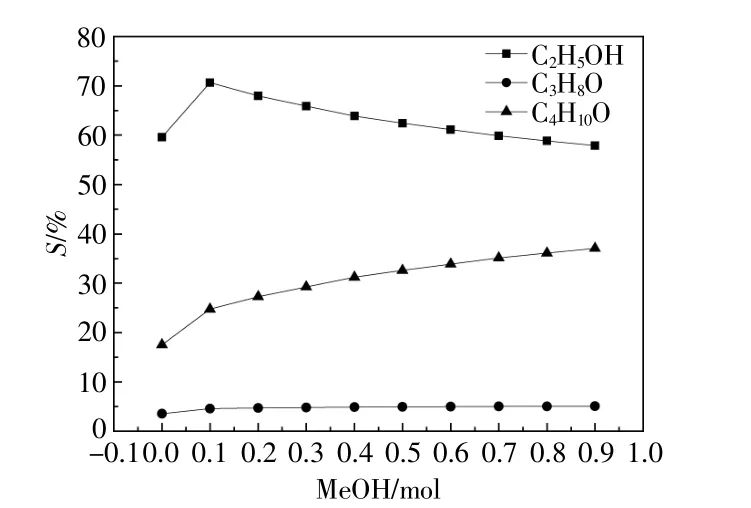
圖5 產物乙醇、丙醇和異丁醇選擇性Fig.5 The selectivity of the products to ethanol,propanol and isobutanol
2.2.2 溫度的影響
當壓力為4 MPa,氫碳比為2.0:1(MeOH/CO比為0.1:0.9)時,一氧化碳轉化率、氫氣轉化率、甲醇轉化率與溫度的關系如圖6所示。由圖6可知,在所考察溫度范圍內,一氧化碳、甲醇和氫氣轉化率都保持不變,一氧化碳與甲醇轉化率一直大于氫氣轉化率,且一氧化碳和甲醇完全轉化。
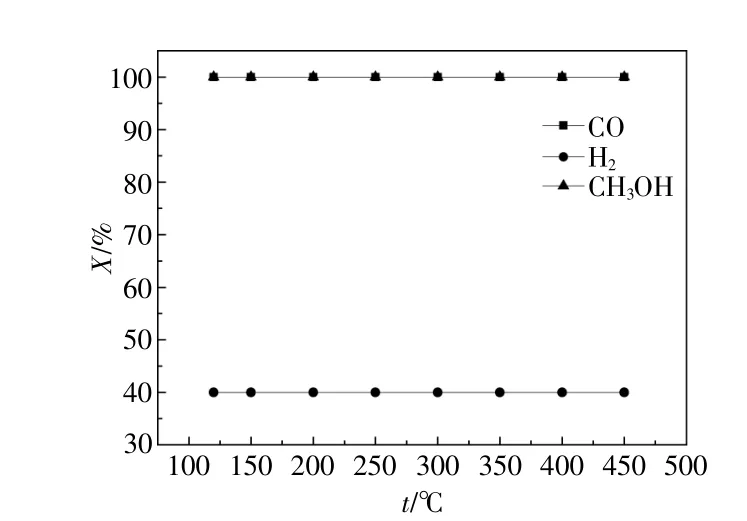
圖6 原料轉化率Fig.6 The conversion of raw materials
乙醇選擇性、丙醇選擇性、異丁醇選擇性與溫度的關系如圖7所示。由圖7可知:隨著溫度的升高,乙醇選擇性迅速升高后趨于平穩,而異丁醇選擇性迅速下降后趨于平穩,丙醇選擇性逐漸降低;當溫度為120~127℃時,異丁醇選擇性大于乙醇選擇性和丙醇選擇性;當溫度為127~450℃時,乙醇選擇性大于異丁醇選擇性和丙醇選擇性。由圖6,7可知,當溫度大于250℃時有利于乙醇生成。
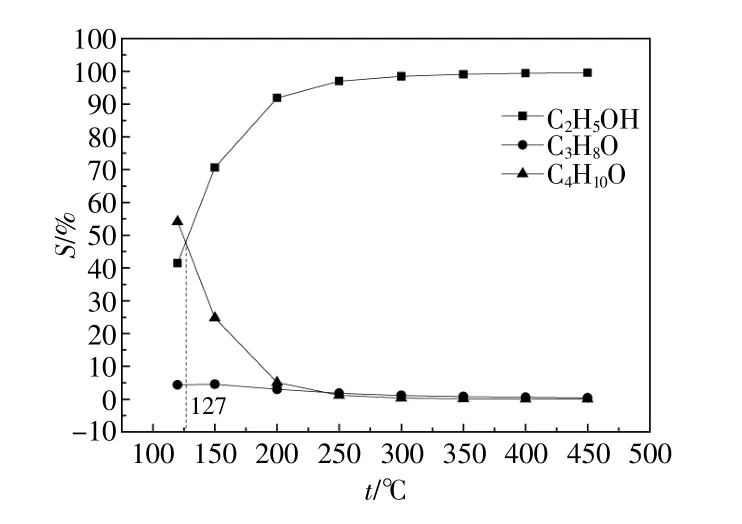
圖7 產物乙醇、丙醇和異丁醇選擇性Fig.7 The selectivity of the products to ethanol,propanol and isobutanol
由圖4~7可以看出,甲醇加入對合成氣制乙醇反應有很大的影響。甲醇加入有利于乙醇的生成,氫氣轉化率顯著降低,但并未影響一氧化碳完全轉化。原因在于甲醇同系化反應首先發生合成氣制甲醇反應,再發生甲醇同系化反應及合成氣生成碳和水的反應。而甲醇同系化反應速率大于合成氣生成碳和水的反應速率。提高溫度有利于乙醇的生成,且并未影響各原料轉化。原因在于提高溫度首先發生合成氣制甲醇反應,繼而發生甲醇同系化反應。甲醇同系化反應速率大于合成氣制甲醇反應速率。結合甲醇完全轉化和乙醇選擇性有所增加,說明甲醇不是一氧化碳的競爭者,加入甲醇促進了甲醇同系化反應的進行,提高了平衡時乙醇選擇性。
由圖4~7分析可知,當壓力為4 MPa,溫度為250℃,氫碳比為2.0:1(MeOH/CO比0.1:0.9)時,乙醇選擇性為97.00%,氫氣轉化率為40.00%,一氧化碳轉化率為100.00%,甲醇轉化率為100.00%。
3 實驗方法
甲醇同系化制乙醇催化劑的活性評價在高壓反應釜中進行,實驗裝置示意圖如圖8所示。將催化劑體系(乙酰丙酮二羰基銠(以銠計)0.06 g,水合三氯化釕0.25 g,配體1,3-雙二苯基膦丙烷0.20 g,碘甲烷1.12 g,醋酸16.00 g,碘化鋰0.03 g)和甲醇3.20 g置于帶有攪拌裝置的100 mL高壓反應釜中,密封高壓反應釜。先用氮氣置換高壓反應釜內空氣,再用H2/CO/N2(物質的量比為2.0:0.9:0.5)混合氣置換高壓反應釜內的氮氣,將高壓反應釜充壓至4 MPa,攪拌并升溫,催化劑在混合氣氛圍下溫度升至250℃,恒壓反應12 h,取試樣進行色譜分析。
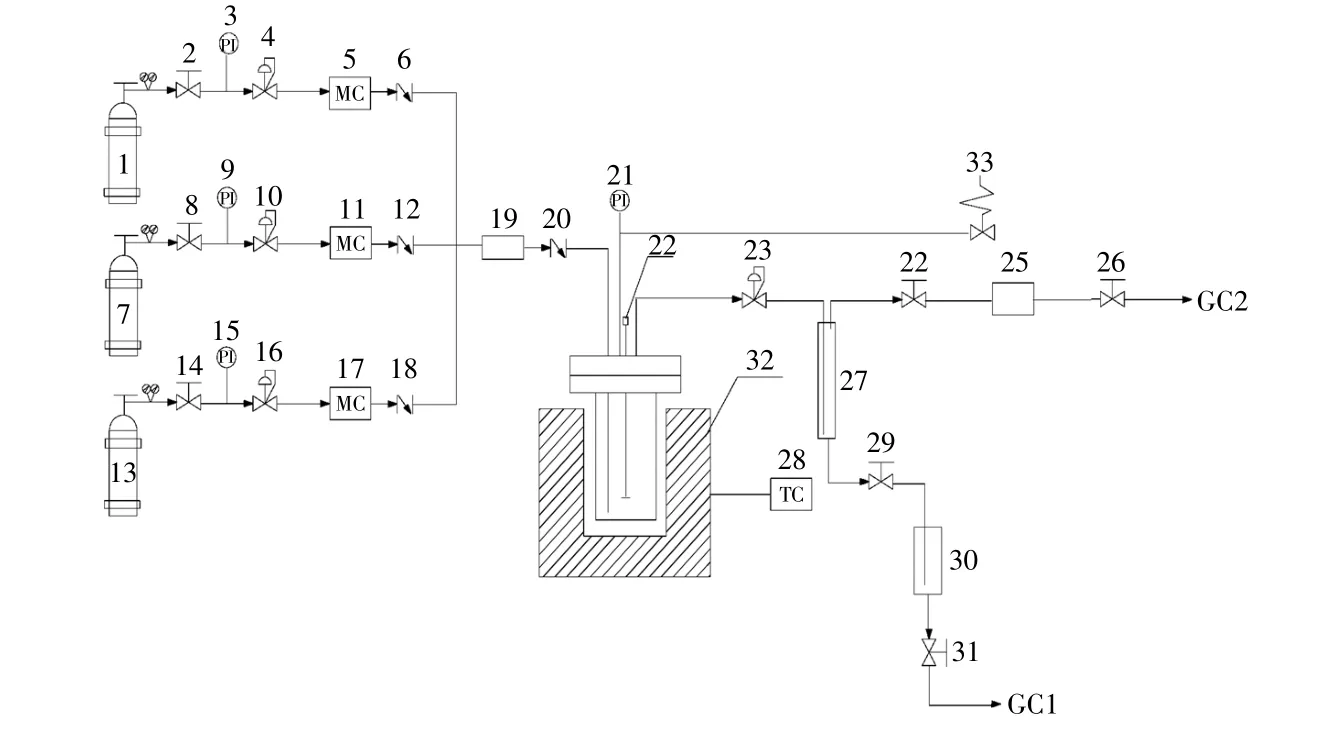
圖8 實驗裝置示意圖Fig.8 Schematic diagram of experimental apparatus
采用安捷倫7980A型氣相色譜儀(GC1)分析液體反應產物,FID檢測器分析,色譜柱為HP-5毛細管柱,乙腈為內標物,載氣為氦氣。采用安捷倫7980A型氣相色譜儀(GC2)分析氣相產物,一部分氣相產物(H2,N2和CO)由5A分子篩填充柱、TCD檢測器分析,氮氣為內標物,載氣為氦氣;另一部分氣相產物(N2和CO2)由Porapak Q填充柱、TCD檢測器分析,氮氣為內標物,載氣為氦氣。實驗分析結果如下:氫氣轉化率為32.00%,一氧化碳轉化率為91.21%,甲醇轉化率為90.02%,乙醇選擇性為89.00%。這說明在此催化劑上乙醇選擇性與熱力學理論值還有些差距,催化劑對于原料轉化率和乙醇選擇性還有待提高。
4 結論
①合成氣制乙醇應在乙醇選擇性高的條件下進行,通過模擬得出有利于該反應的條件:壓力為2~4 MPa,溫度為150~200℃,氫碳比為1.5:1~4.0:1,該條件下一氧化碳完全轉化,有利于乙醇的生成。
②甲醇同系化制乙醇反應是一個復雜反應,該反應應在乙醇選擇性高的條件下進行,并在此條件下盡可能地減少其他副產物的生成。由熱力學模擬結果可知,在壓力為4 MPa、溫度為250℃、氫碳比為2.0:1(MeOH/CO比0.1:0.9)反應條件下,乙醇選擇性為97.00%,氫氣轉化率為40.00%,甲醇轉化率為100.00%,一氧化碳轉化率為100.00%。綜上所述,甲醇的加入有利于乙醇的生成。

