近紅外光譜法分析頭孢拉定顆粒的關鍵質量屬性及對其量值的測定
趙瑜 朱俐 尹利輝
(中國食品藥品檢定研究院,北京 102629)
國家評價性抽驗是國家藥品監督管理局組織的對上市藥品的全環節監督檢驗。其主要針對監管工作中問題較多、風險隱患較大的品種,通過對產品主要質量問題等的綜合評價,促進藥品質量標準的提高,進而促使企業提高產品質量[1]。國家評價性抽驗平臺是在多年國家評價性抽驗工作積累的基礎上,由中國食品藥品檢定研究院組織、全國各藥品檢驗所共同參與建設的數據共享平臺,其中蘊藏著豐富的藥品質量信息;針對監管工作的需要,如何挖掘并合理利用國家評價性抽驗平臺中的信息是當前的研究熱點。
頭孢拉定是第一代半合成頭孢菌素,臨床主要用于呼吸道、泌尿道、皮膚和軟組織的感染[2]。頭孢拉定制劑包括片劑、顆粒劑、膠囊劑和注射劑等[3]。其中,頭孢拉定顆粒劑為我國的特有品種,臨床主要用于兒童[4]。國內生產廠家較多,共有33個批準文號。國產兒童藥品一般具有生產批量小、多批次的特點,保證其產品質量的一致性是質量控制的關鍵。2017年,頭孢拉定顆粒被列為國家評價性抽驗品種,與其相關的各類信息包括企業的處方工藝、各種檢驗數據、用于鑒別的近紅外光譜(NIR)數據等均被收錄于國家評價性抽驗平臺的數據庫中。
近紅外光譜法(near-infrared spectroscopy)是指對波長范圍780~2500 nm(波數范圍為12500~4000 cm-1),由分子振動的倍頻和合頻產生的光譜,通過化學計量學算法對其光譜特征信息進行提取、模式識別和量值建模的分析方法,可用于對藥物制劑的一致性檢驗、定性和定量分析[5-6]。本研究探索利用國家評價性抽驗平臺數據庫中的數據,應用近紅外光譜法,對頭孢拉定顆粒質量和工藝的一致性進行評價,并建立預測關鍵質量屬性量值的方法,為藥品整個生命周期的監管以及靶向抽驗等提供有效的科學依據。
1 NIR光譜
從國家評價性抽驗平臺數據庫中選取17個廠家96個代表性批次的頭孢拉定顆粒樣品NIR光譜,包括:北京首兒藥廠(簡稱BJSE)4批次,北京永正制藥有限責任公司(簡稱BJYZ)6批次,迪沙藥業集團有限公司(簡稱DSYY)4批次,廣西邦琪藥業集團有限公司(簡稱GXBQ)4批次,廣州白云山醫藥集團股份有限公司白云山制藥總廠(簡稱GZBYS)10批次,國藥集團汕頭金石制藥有限公司(簡稱GYJS)6批次,海南三葉制藥廠有限公司(簡稱HNSY)6批次,湖南康爾佳生物醫藥科技有限公司(簡稱HNKEJ)3批次,華北制藥河北華民藥業有限責任公司(簡稱HBZY)6批次,焦作市銀河藥業有限公司(簡稱JZYH)9批次,金日制藥(中國)有限公司(簡稱JYZY)4批次,荊州市津奉藥業發展有限公司(簡稱JZJF)2批次,遼寧華瑞聯合制藥有限公司(簡稱LNHR)10批次,山東云門藥業有限責任公司(簡稱SDYM)3批次,神威藥業集團有限公司(簡稱SWYY)6批次,天津太平洋制藥有限公司(簡稱TTTPY)2批次,珠海金鴻藥業股份有限公司(簡稱ZHJH)11批次。頭孢拉定對照品(批號130427,中國食品藥品檢定研究院)。
近紅外光譜均采用MPA型傅里葉變換近紅外光譜儀(Bruker Optics GmbH),PbS檢測器,在儀器性能測試通過的狀態下進行采集。樣品置低羥基石英樣品瓶中,采用積分球模式采樣,測試條件為光譜范圍12000~3500 cm-1,光譜分辨率8 cm-1,背景掃描次數32次,樣品掃描次數32次,采集3次。
2 NIR光譜分析方法
采用OPUS6.5(Bruker Optics GmbH)軟件對數據進行處理和建模。
2.1 模式識別模型
通過對頭孢拉定對照品、各同廠家的頭孢拉定顆粒的近紅外光譜圖進行分析,選擇特征譜區(圖1),并結合模型優化選擇適宜的光譜預處理方法;通過因子分析法提取主成分光譜,用第一主成分表征制劑工藝的共性信息,用第二、三、…主成分表征不同工藝的特征信息;通過特征信息建立模式識別模型;利用模式識別的結果與制劑處方分類的相關性,評價不同廠家頭孢拉定顆粒質量和工藝一致性。
2.2 NIR量值預測模型
將近紅外光譜與參考方法測定的化學值相關聯,應用偏最小二乘法(PLS)建立定量模型[7],實現對關鍵質量屬性量值的快速預測。優化的定量模型參數[光譜范圍、光譜預處理方法、算法、維數(rank)等],根據模型的決定系數R2和均方根誤差(RMSEP)確定。
3 結果與討論
3.1 頭孢拉定顆粒處方分析
顆粒劑由原料藥和一定比例的賦形劑,通過混合、制軟材、制濕微粒、干燥、整粒與分級、裝袋等過程生產[8]。通過對數據庫處方工藝信息的發掘,得到部分廠家頭孢拉定顆粒的處方組成信息(表1)。頭孢拉定顆粒處方中除賦形劑外,還添加了改善口感的香精作為矯味劑和改善觀感的食用色素,以提高兒童臨床用藥的依從性。雖然各廠家的頭孢拉定顆粒處方和工藝各異,但均采用蔗糖作為主要的賦形劑。
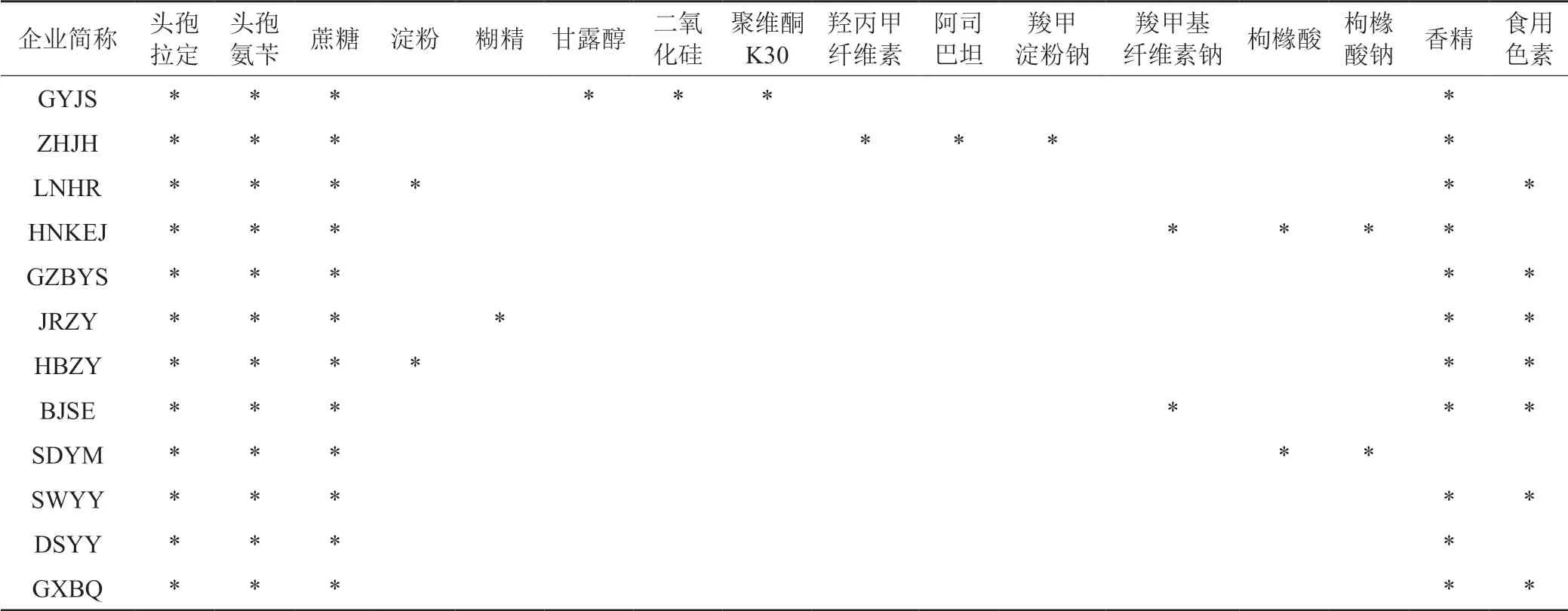
表1 頭孢拉定顆粒的處方組成信息Tab.1 Prescription composition information of cefradine granules
3.2 頭孢拉定顆粒質量和工藝一致性評價
近紅外光譜中除包含有制劑活性成分和處方中諸輔料的信息外,還包括產品中有關物質(工藝穩定性)、粒度(制粒工藝)、水分(干燥工藝)等與制劑工藝相關的信息。通過比對頭孢拉定、頭孢氨芐對照品和頭孢拉定顆粒的典型近紅外光譜(圖1)發現:頭孢拉定的近紅外信號在5100 cm-1附近呈較強的特征吸收峰,制劑中輔料未見其有干擾;顆粒劑中輔料在7500~5400 cm-1和5000~4000 cm-1的信號比較豐富且吸收較強,對頭孢拉定信號存在干擾。同時,17個廠家的頭孢拉定顆粒的近紅外光譜(圖2)顯示,他們的相似度較高,這可能與處方中蔗糖的含量均較高有關。

圖2 17個廠家頭孢拉定顆粒的近紅外光譜圖Fig.2 NIR spectra of cefradine granules from 17 maufacturers
利用化學計量學方法挖掘各產品近紅外光譜中的工藝信息,利用模式識別法對不同的工藝特征進行區分,探索不同廠家頭孢拉定顆粒質量和工藝的一致性。
對17個廠家96個批次的頭孢拉定顆粒的近紅外光譜(光譜范圍為5000~5600 cm-1、7000~7400 cm-1、6200~6900 cm-1)進行矢量歸一化預處理,通過因子分析,提取主成分光譜(表2);其中第一主成分代表率達99.9%,表征顆粒劑工藝的共性信息;第2~5主成分表征不同廠家的工藝特性。
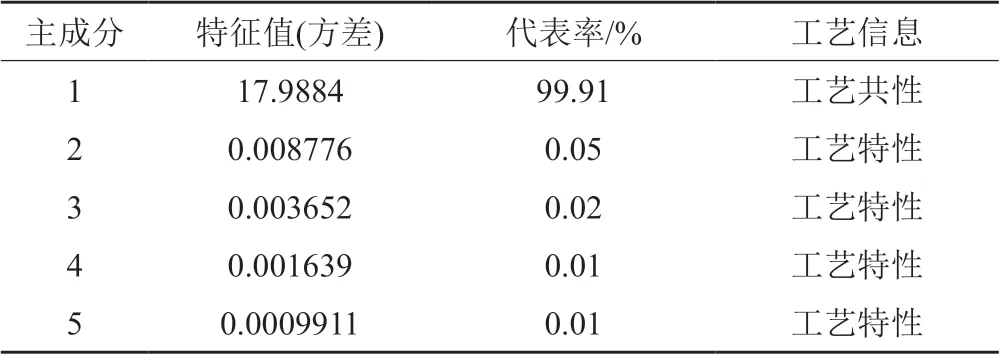
表2 頭孢拉定顆粒近紅外光譜因子分析的特征值及代表率Tab.2 Eigenvalues and representative rate of NIRS factor analysis of cefradine granules
用第2、3、4主成分進行數據重構,通過主成分空間表征不同工藝的特征(圖3)。模式識別結果顯示,17個廠家(工藝)頭孢拉定顆粒在工藝特征空間中呈現5類工藝特征。

圖3 模式識別區分頭孢拉定顆粒的工藝特征Fig.3 Pattern recognition of the process characteristics of cefradine granules
用光譜的第2、3、4主成分進行Ward’s聚類分析,光譜距離的閾值設為1,將模式識別結果與不同廠家產品相關聯,對頭孢拉定顆粒的產品質量和工藝的一致性進行分析(圖4)。GYJS各批次聚為一類,與類1相對應,且與其他廠家樣品的光譜距離最遠,顯示其具有獨特的工藝特異性;ZHJH與類2對應,各批次樣品的光譜距離較小,顯示了較好的批間一致性;HNKEJ的光譜和LNHR的光譜距離較近,與類3對應,LNHR表現出相對較大的批間波動;與類4對應的有5個廠家的樣品,其中GZBYS和BJYZ的光譜距離相對較近,GZBD、JZJF、JZYH 3個廠家的光譜距離相對較近;其余廠家的樣品與類5對應,包括BJSE、JRZY、HBZY、SDYM、SWYY、DSYY、HNSY、GXBQ、TJTPY 9個廠家,其中SDYM、SWYY和DSYY的產品各批次樣品光譜距離較小且各聚為一類,其他廠家的樣品各批次之間存在交叉,均顯示出較大的批間變異性。

圖4 產品基于NIR光譜第2、3、4主成分的Ward′s聚類結果Fig.4 Ward′s clustering results of products based on the 2nd,3rd and 4th principal components of NIR spectra
3.3 關鍵質量屬性的量值預測模型
頭孢拉定、頭孢氨芐和水分的含量是頭孢拉定顆粒的關鍵質量屬性。其中,頭孢拉定為API成分,頭孢氨芐為頭孢拉定的降解物,可來源于原料藥和制劑過程,水分主要由顆粒制粒給出引入。中國藥典2020版頭孢拉定顆粒各論中規定:頭孢氨芐不得過頭孢拉定和頭孢氨芐總量的6.0%。利用近紅外光譜建立定量模型,可實現對制劑中頭孢拉定、頭孢氨芐和水分的含量的快速預測。
3.3.1 參考方法[9]
利用國家評價性抽驗的檢測結果作為近紅外模型的化學參考值。其中,頭孢拉定含量和頭孢氨芐含量為采用中國藥典2010版HPLC法(C18柱,流動相水-甲醇-3.86%醋酸鈉溶液-4%醋酸溶液(1564:400:30:6,V/V/V/V),流速0.8 mL/min,檢測波長254 nm)測得的百分含量(W/W,%)。水分為卡爾非休法測得的百分含量(W/W,%)。
3.3.2 頭孢拉定含量預測模型
頭孢拉定顆粒中活性成分的含量約在4%~12%之間。將96個批次樣品中的67批次作為訓練集(百分濃度范圍(3.93~11.93)(W/W,%),29批次作為驗證集(百分濃度范圍(4.0~11.7)(W/W,%),建立頭孢拉定定量模型。優化后的模型參數:光譜范圍為11600~9830、8940~7150和6270~5380 cm-1,采用矢量歸一化法進行光譜預處理。頭孢拉定PLS模型的校正和驗證結果如圖5所示。訓練集模型擬合值和真值的決定系數R2達99.5,RMSEE值0.205,維數為8;交叉驗證預測值和真值的決定系數R2達99.1,RMSECV值0.27,偏移量0.004486。驗證集預測值和真值的決定系數R2達97.63,RMSEP值0.389,偏移量-0.0253。
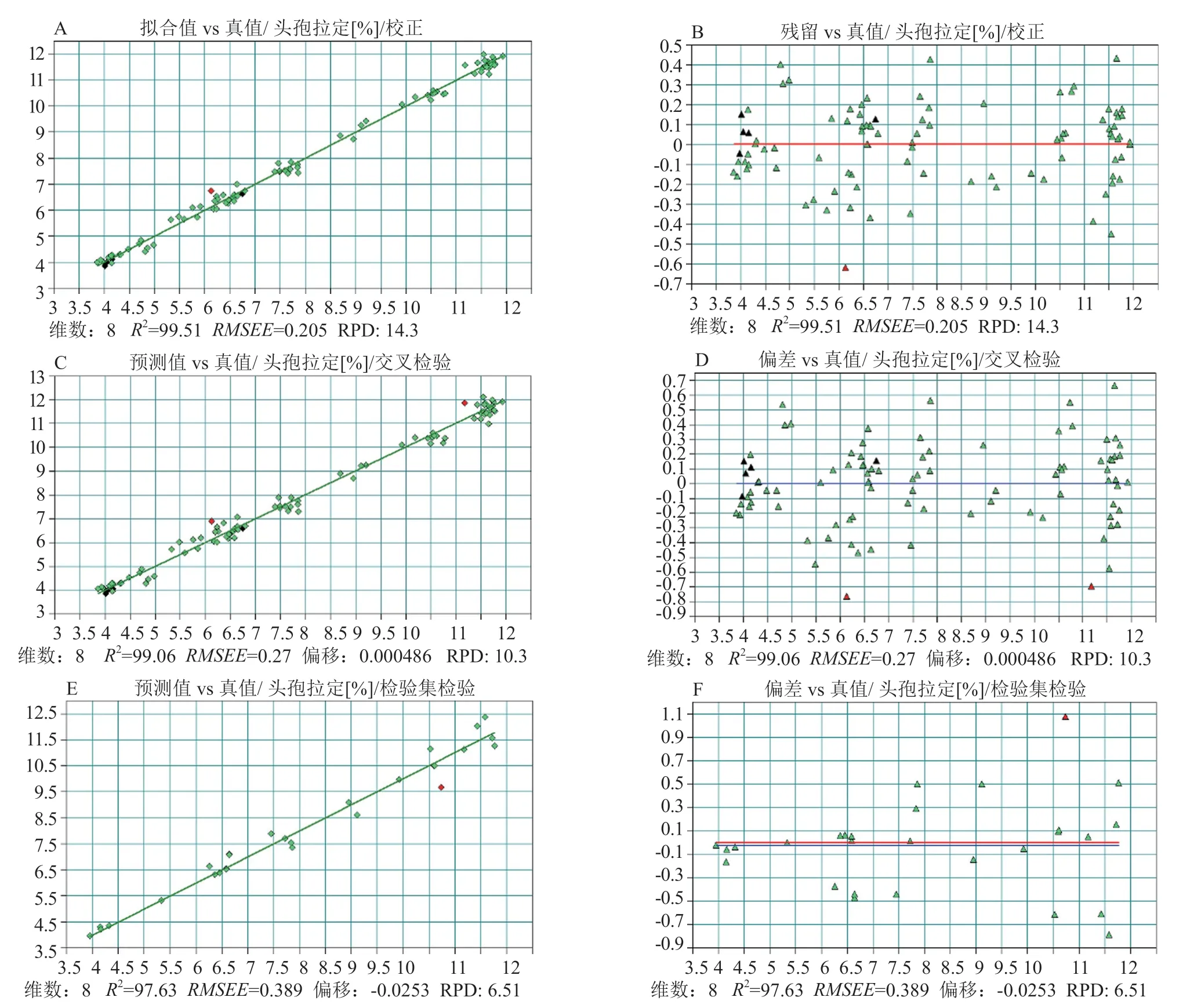
圖5 頭孢拉定顆粒中頭孢拉定PLS模型校正和驗證結果Fig.5 Results of calibration and validation of PLS model of cefradine content in cefradine granules
3.3.3 頭孢氨芐含量預測模型
頭孢拉定顆粒中頭孢氨芐的含量約在1%~6%之間。將96個批次中的67批次樣品作為訓練集(百分濃度范圍(1.3%~5.7%)(W/W),29批次作為驗證集(百分濃度范圍1.36%~4.2%(W/W),建立頭孢氨芐的PLS定量模型。優化后的模型參數:光譜范圍為8940~7150和6270~5380 cm-1,采用矢量歸一化法進行光譜預處理。頭孢氨芐PLS模型的校正和驗證結果如圖6所示。訓練集模型擬合值和真值的決定系數R2為86.8,RMSEE值0.0351,維數為8;交叉驗證預測值和真值的決定系數R2為70.0,RMSECV值0.0483,偏移量-0.00076。驗證集預測值和真值的決定系數R2達57.2,RMSEP值0.531,偏移量-0.0991。
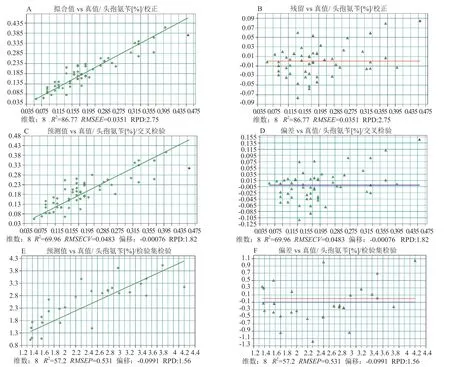
圖6 頭孢拉定顆粒中頭孢氨芐PLS模型校正和驗證結果Fig.6 Results of calibration and validation of PLS model of cephalexin content in cefradine granules
3.3.4 水分含量預測模型
頭孢拉定顆粒中水分的含量約在0.3%~1.4%之間。將96個批次中的67批次樣品作為訓練集(百分濃度范圍0.3%~1.31%(W/W),29批次作為驗證集(百分濃度范圍0.4%~1.26%(W/W),建立水分的定量模型。優化后的模型參數:光譜范圍為10533.5~5450 cm-1,采用矢量歸一化法進行光譜預處理。訓練集模型擬合值和真值的決定系數R2為86.5,RMSEE值0.104,維數為8;交叉驗證預測值和真值的決定系數R2為55.9,RMSECV值0.476,偏移量0.00519。驗證集預測值和真值的決定系數R2為53.0,RMSEP值0.149,偏移量0.0604,參見圖7。
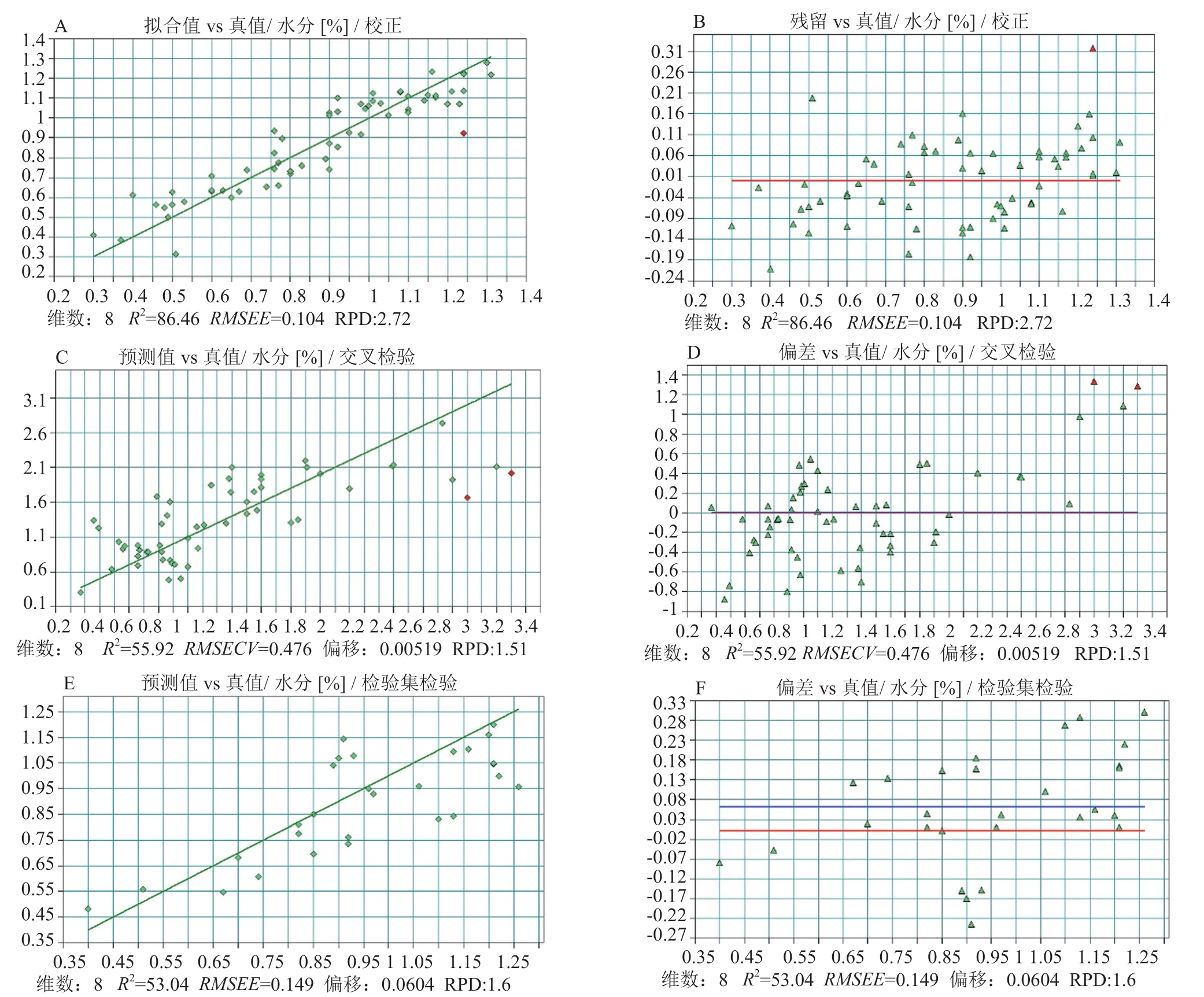
圖7 頭孢拉定顆粒中水分PLS模型校正和驗證結果Fig.7 Results of calibration and validation of PLS model of water content in cefradine granules
4 結論
本文以頭孢拉定顆粒為例,探討了通過發掘國家評價性抽驗平臺數據庫中的數據,采用近紅外光譜結合模式識別的方法,對不同廠家產品的質量和工藝的一致性進行評價,對其中關鍵質量屬性的量值(頭孢拉定含量、頭孢氨芐含量和水分含量),通過PLS定量模型進行快速預測。該研究表明,國家評價性抽驗平臺對服務于藥品的監管及靶向抽驗具有重要價值。

