基于實驗情境的“鈉及其重要化合物”復習課設計
葉煒華


摘要:高三復習備考中,圍繞“鈉及其重要化合物”知識,創設物質制備、成分探究、性質探究、定量測定等實驗情境,合理設置問題鏈,引導學生自主建構、內化鈉及其重要化合物的認識方式,提升學生自覺運用鈉及其重要化合物性質解決化學實驗問題的能力,發展“宏觀辨識與微觀探析”“證據推理與模型認知”等化學學科核心素養。
關鍵詞:實驗情境;鈉及其重要化合物;證據推理;模型認知
文章編號:1008-0546(2022)03-0090-06???? 中圖分類號:G632.41???? 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.03.020
高考評價體系[1]規定了高考的考查載體——情境,以此承載考查內容,實現考查要求。崔允漷[2]認為,指向素養的學習是有真實情境與任務介入的真實學習,只有在真實情境下運用某種或多種知識完成特定的任務,才能評估關鍵能力、必備品格和價值觀念。基于實驗情境開展“鈉及其重要化合物”復習,引導學生將所建構的物質類別、化合價、反應原理等物質性質的認識方式真正內化,并自覺運用于解決實驗情境下的真實問題,實現對物質性質的系統探究或創造性應用,發展“證據推理與模型認知”等化學學科核心素養。
一、教學主題內容分析
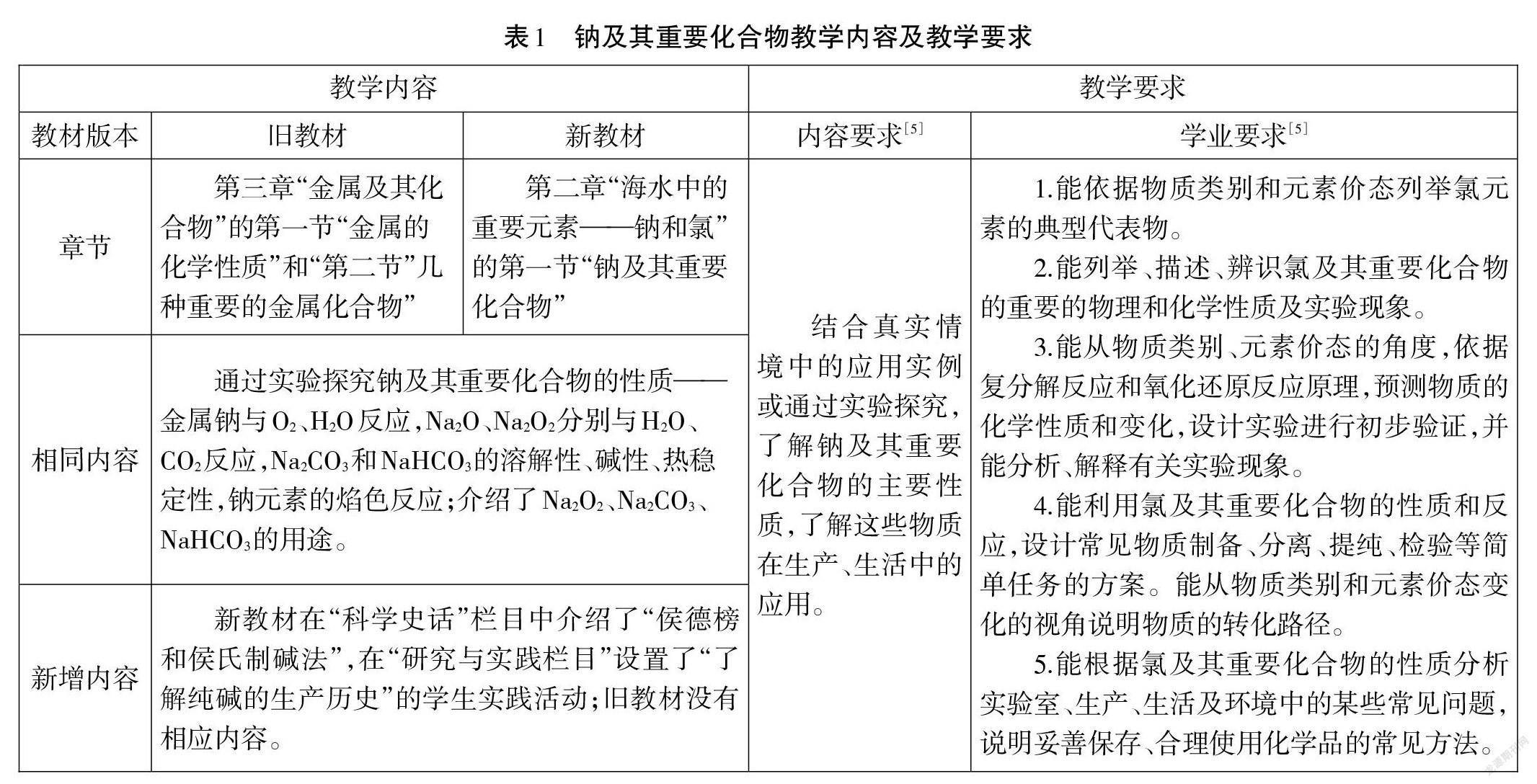
鈉及其重要化合物是高中化學必修課程中“主題2 常見的無機物及其應用”的重要組成部分。人教版舊教材[3]和新教材[4]中有關鈉及其重要化合物的知識內容和呈現方式幾乎一致,主要通過實驗探究鈉及其重要化合物的性質(詳見表1),只是內容所在章節有所調整;另外,新教材在“科學史話”欄目中介紹了“侯德榜和侯氏制堿法”,在“研究與實踐欄目”設置了“了解純堿的生產歷史”的學生實踐活動。
近年高考常以鈉及其重要化合物為載體,考查學生在真實實驗情境中接受、吸收、整合化學信息,分析問題和解決問題的能力及化學實驗與探究能力。2018年海南省高考通過“探究金屬鈉與二氧化碳的反應”,考查 CO2的制備、提純及Na 與 CO2反應產物的推斷和化學方程式的書寫;2018年全國高考Ⅱ卷考查“Na2CO3可用于去除餐具的油污”等。
二、教學現狀分析
1.文獻分析
在中國知網(CNKI)以“鈉及其重要化合物”為主題進行檢索,絕大多數是研究新授課教學,研究復習課教學的很少。葉蘭峰[6]等利用工業上制備金屬鈉、氯堿工業、侯氏制堿法等新情境,提高課堂教學效率。鄭雅蘭[7]等通過創新設計實驗——鈉與水反應引發鈉與硫反應,體現知識的系統性以及元素化合物作為其他部分知識載體的功能。上述研究,結合實際工業生產、化學實驗探究等真實情境,引導學生關注鈉及其重要化合物的性質在真實情境中的應用,有利于提高學生化學學科能力,促進學生化學學科核心素養的發展。
2.學情分析
學生已經復習了物質的分類及其變化、離子反應、氧化還原反應等知識,具備建構從物質類別、化合價、反應原理等角度歸納鈉及其重要化合物性質的知識基礎。基于實驗情境開展“鈉及其重要化合物”復習,首先要引導學生自主建立元素化合物的認知模型;其次,要強化證據推理意識,培養運用元素化合物知識解決復雜實驗情境的問題的能力。
三、教學思想與創新點
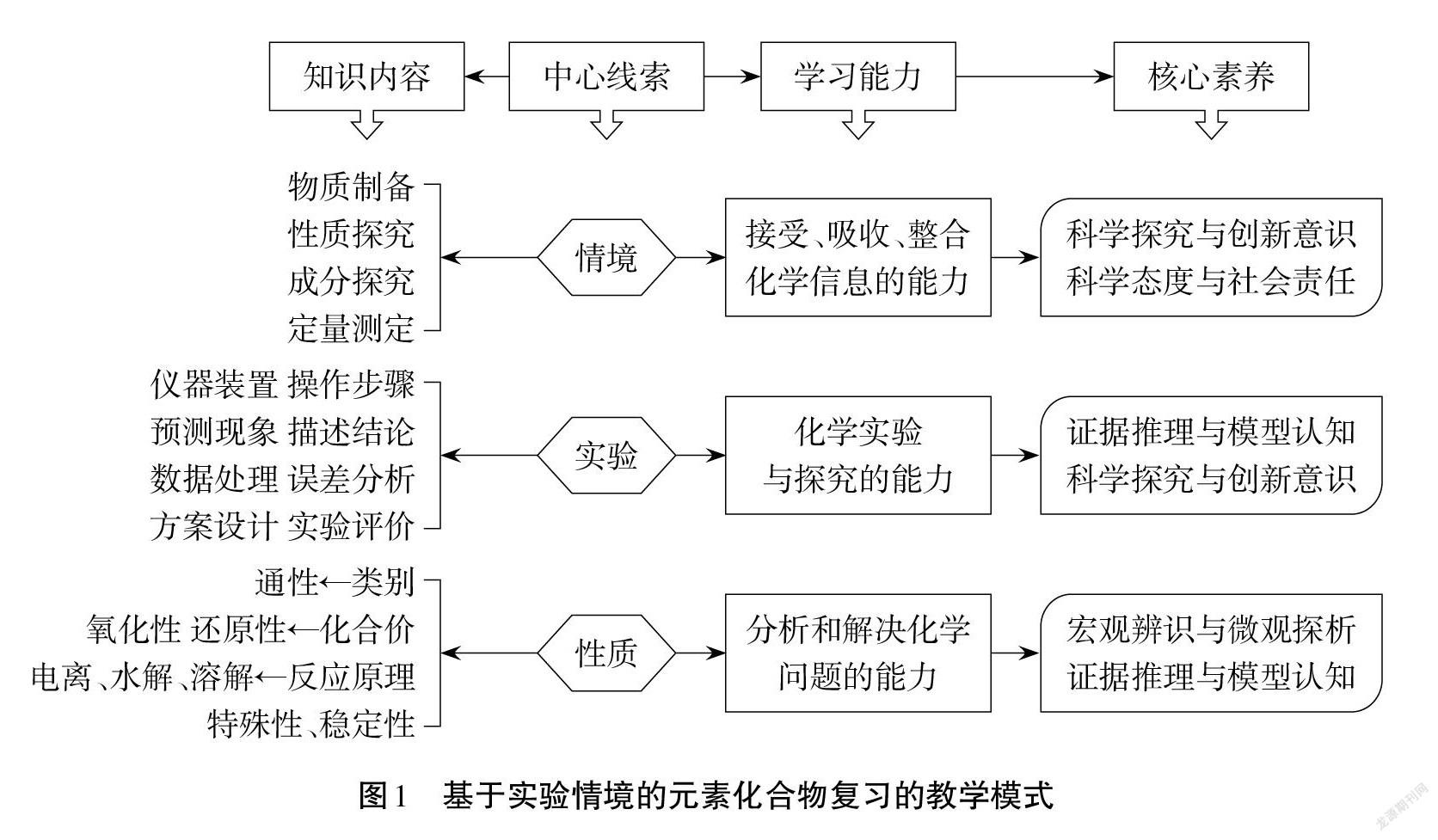
單旭峰[8]認為“在真實情境中解決問題的過程展示出的能力才是實際的能力,表現出的態度和情感才是真實的品質特征”“實驗目的就是一個問題情境”。筆者提出基于實驗情境的元素化合物復習的教學模式(詳見圖1),開展“鈉及其重要化合物”的復習實踐。
基于實驗情境的“鈉及其重要化合物”復習,圍繞 Na、Na2O與Na2O2、NaOH、Na2CO3和NaHCO3的性質,創設制備NaH、探究Na2O2與濃鹽酸反應的氣體產物、探究 CO2緩慢通入 NaOH 溶液 的產物及檢 驗、測定 Na2CO3和NaHCO3混合物中Na2CO3百分含量等實驗情境,有梯度地設計不同復雜和陌生程度的問題,引導學生開展分類與概括、符號與表征、證據與推理、設計與評價等學習活動,基于代表物類別、類別通性、化合價、周期律或反應原理(電離、水解、化學平衡、電化學)等認識角度[9]理解鈉及其重要化合物的性質,通過完成物質制備、保存、利用、檢驗、鑒別、分離等不同類型的應用性問題和活動任務,促進學生建構、內化、自覺運用對鈉及其重要化合物的認識方式和問題解決能力,發展“宏觀辨識與微觀探析”“證據推理與模型認知”等化學學科核心素養。
四、教學目標
結合對教材內容、課程標準、高考真題和具體學情的分析,確定教學目標如下:
1.通過分析NaH的制備實驗的裝置、操作步驟、產品驗純,掌握Na的強還原性——與O2、H2O、HCl的反應,建構物質制備類實驗裝置連接模型及實驗注意事項。
2.通過分析 Na2O 和鹽酸的反應,知道 Na2O 是一種堿性氧化物,掌握堿性氧化物的通性——與 H2O、酸、CO2等發生反應;通過預測 Na2O2和濃鹽酸反應的氣體產物,掌握 Na2O2與 H2O、酸、CO2的反應,理解 Na2O2的強氧化性;通過設計檢驗Na2O2和濃鹽酸反應的氣體產物的實驗方案,初步養成排干擾意識;通過 Na2O、Na2O2的性質對比,基于物質類別、類別通性、化合價等認識角度理解物質性質。
3.通過探究 CO2緩慢通入 NaOH溶液中依次發生的反應,理解CO2與NaOH溶液的反應產物與CO2氣體的量有關;通過設計實驗方案,檢驗 NaOH 和 Na2CO3混合溶液中的溶質成分、鑒別Na2CO3和NaHCO3,掌握Na2CO3和 NaHCO3的化學性質,強化實驗方案設計中的排干擾意識;通過設計利用 CO2和 NaOH溶液制備純凈的Na2CO3的實驗方案,掌握實驗方案設計與評價的基本原則,提高化學實驗與探究能力。
4.通 過設計 測定 Na2CO3和 NaHCO3混 合物 中 Na2CO3的百分含量的實驗方案,進一步掌握Na2CO3和 NaHCO3的化學性質,提高設計與評價實驗方案的能力;了解熱分解法、沉淀法、滴定法、量氣法等定量測定的常用方法及其注意事項;理解定量測定實驗的關鍵在于減小實驗誤差,保證測量數據的準確性。
五、教學流程
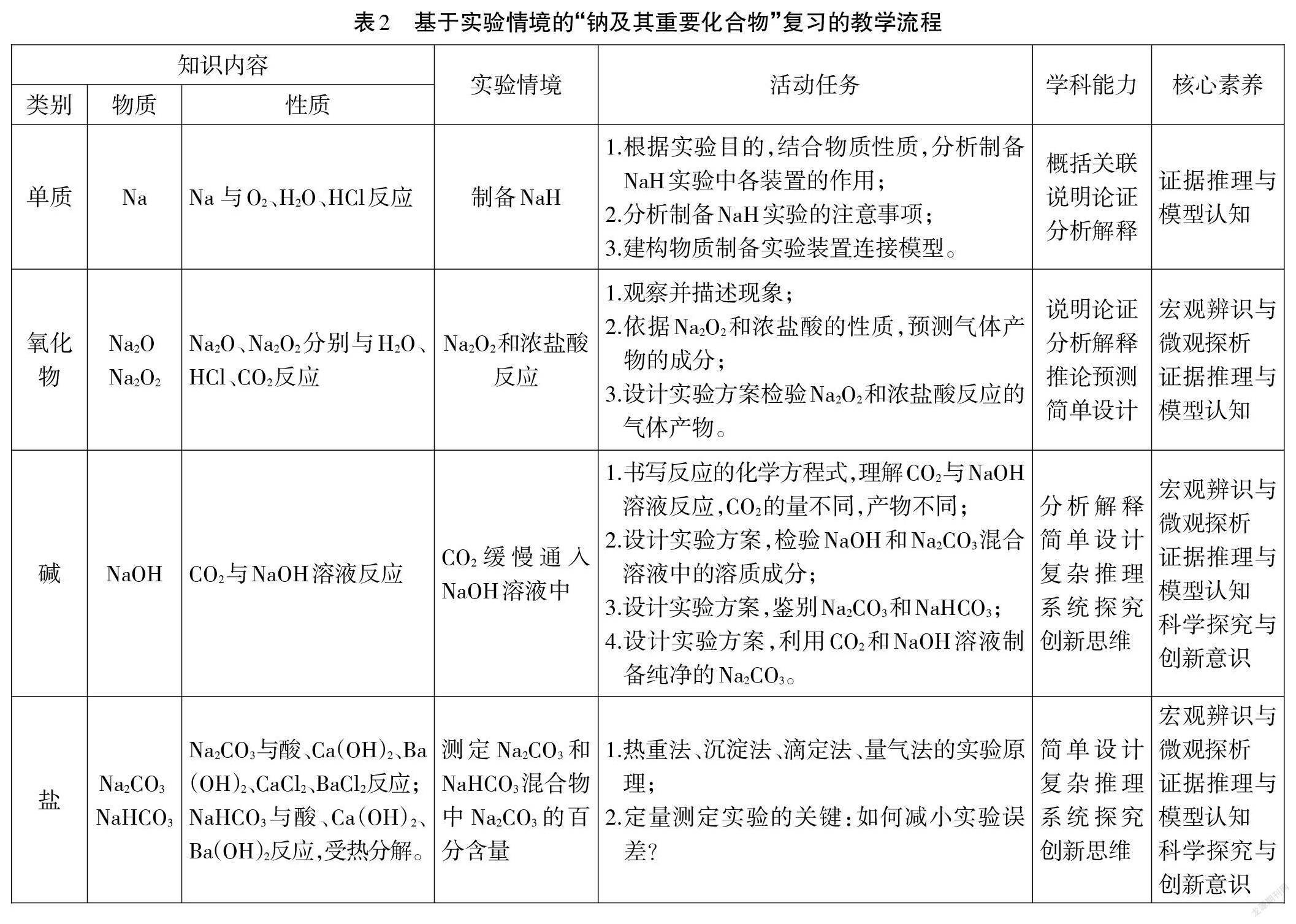
基于上述認識,確定基于實驗情境的“鈉及其重要化合物”復習的教學流程,詳見表2。
六、教學實錄
1.基于實驗“NaH 的制備”復習金屬鈉的性質
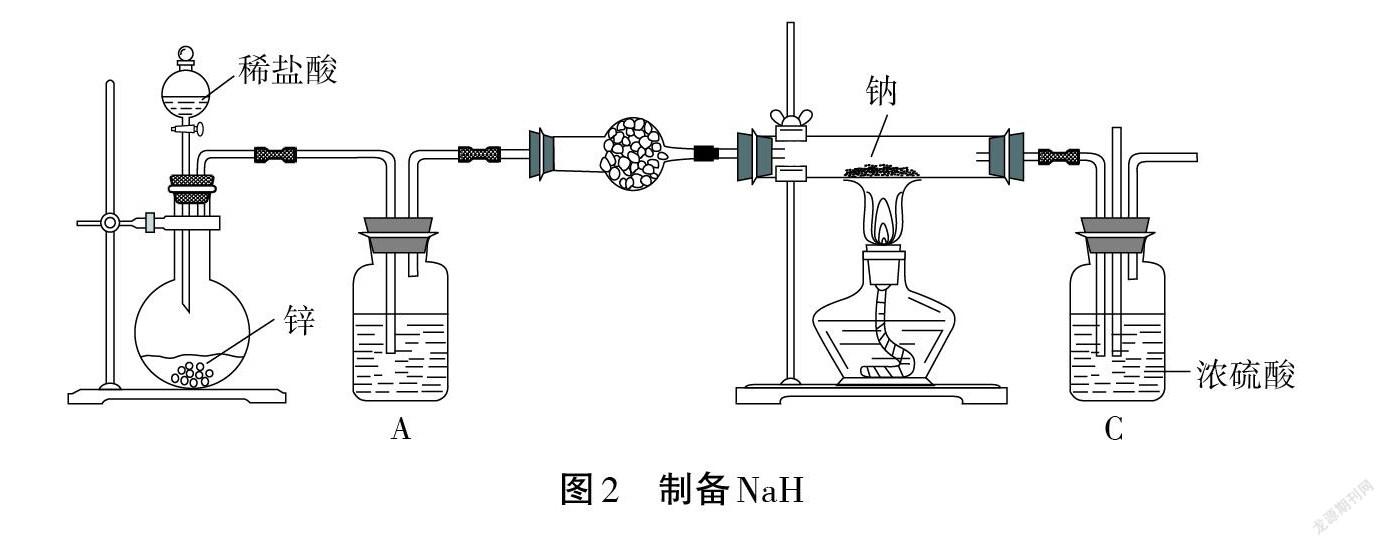
【實驗情境1】氫化鈉(NaH)是有機合成中用途很廣泛的強堿,可與水反應生成H2。實驗室可用氫氣和鈉在高溫下化合制備氫化鈉,裝置如圖2所示。
【問題1】裝置A、B 中分別盛放什么試劑?作用分別是什么?
【問題2】裝置C 中濃硫酸的作用是什么?
【問題3】實驗開始時,應先通一段時間H2,再點燃酒精燈加熱,原因是什么?
【問題4】反應一段時間后,取少量硬質玻璃管中的固體物質與水反應,若能生成 H2,證明得到的 NaH一定是純凈的。該驗純方法是否合理?為什么?
【問題5】該裝置存在明顯缺陷,如何改進?學生思考、分析、交流、回答。
【課堂小結1】(1)鈉是一種非常活潑的金屬,具有很強的還原性,能與 O2、H2O、HCl 等發生反應。(2)物質制備實驗裝置連接模型:氣體發生裝置→除雜裝置→干燥裝置→核心反應裝置→收集裝置→尾氣處理裝置;關注:防氧化、防潮解、防污染、防倒吸、防爆炸、防暴沸。
2.基于實驗“探究 Na2O2和濃鹽酸反應”復習鈉的氧化物的性質
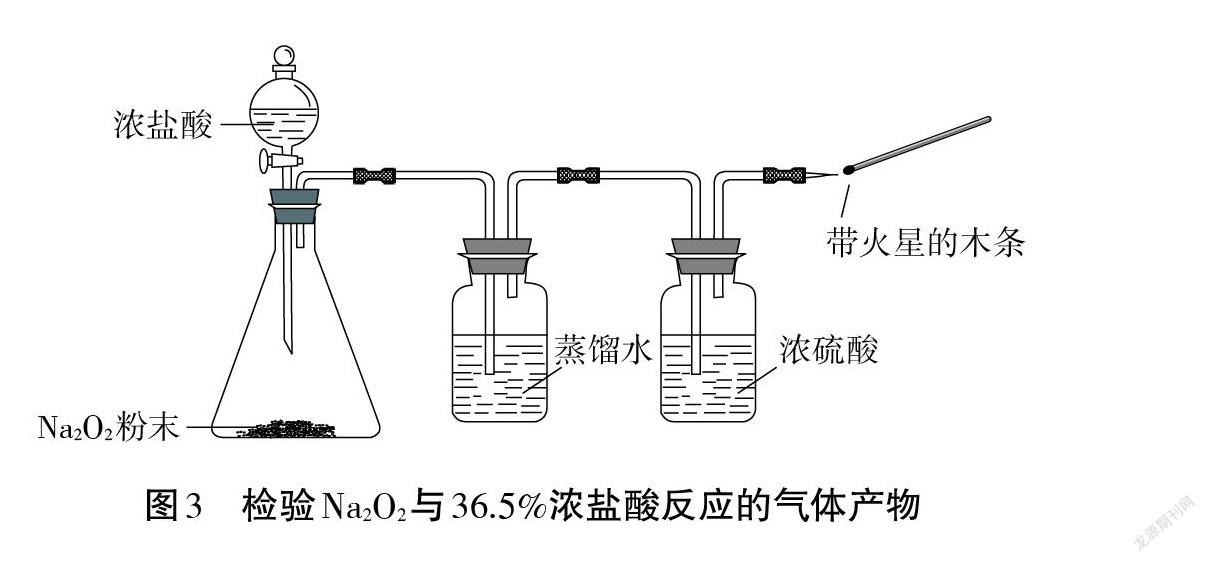
【實驗情境2】在試管中加入少量Na2O2,滴加5滴36.5%濃鹽酸。
【問題1】觀察到什么現象?
【問題2】試管中可能發生的反應有哪些(用化學方程式表示)?
【問題3】對比 Na2O與H2O、HCl 的反應(用化學方程式表示),Na2O2與H2O、HCl 的反應有什么不同?
【問題4】請你設計一個簡單實驗,證明生成的氣體是O2?
【生1】用帶火星的木條,復燃。
【生2】不行。即使生成的是 O2,木條也不一定復燃 。因為濃鹽酸會揮發出大量的 HCl 氣體和水蒸氣。應將生成的氣體依次通過盛有蒸餾水、濃硫酸的洗氣瓶,除去 HCl氣體和水蒸氣,再用帶火星的木條檢驗(見圖3)。
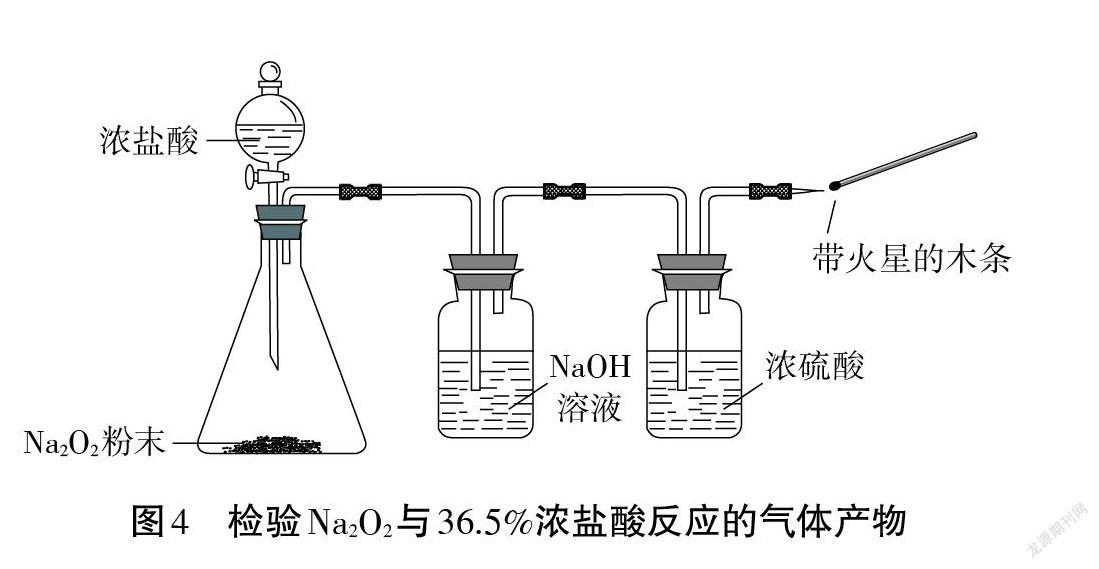
【生3】我覺得還是有問題。因為 Na2O2具有強氧化性,濃鹽酸的還原性比較強,也可能生成Cl2:Na2O2+4HCl(濃)=2NaCl+2H2O+Cl2↑ 。應該用 NaOH溶液代替蒸餾水,同時除去Cl2和HCl(見圖4)。
【問題5】請你設計一個簡單實驗,證明生成的氣體是Cl2?
已知:酸性條件下,O2+ 4I-+ 4H+= 2I2+ 2H2O。
【生1】將生成的氣體通入品紅溶液,若品紅溶液褪色,即可證明是Cl2。
【生2】將生成的氣體通入紫色石蕊溶液中,溶液先變紅后褪色,也可以證明是Cl2。
【生3】用濕潤的藍色石蕊試紙檢驗更方便。
【課堂小結2】(1)Na2O 屬于堿性氧化物,能與 H2O、酸、CO2等發生反應。(2)Na2O2既有氧化性又有還原性,與H2O、(非氧化性)酸、CO2發生歧化反應,放出 O2。(3)設計檢驗物質的實驗方案,要排除可能存在的干擾。
3.基于實驗“探究 CO2與 NaOH 溶液反應”復習氫氧化鈉的性質
【實驗情境3】將CO2緩慢通入NaOH稀溶液中,通入CO2的量不同,產物也不同。
【問題1】上述實驗過程中,依次發生的反應有哪些(用化學方程式表示)?
【問題2】若只通入少量 CO2氣體,所得溶液的溶質是什么?請你設計一個簡單實驗進行驗證。
供選試劑:BaCl2溶液、Ba(OH)2溶液、酚酞試劑;供選儀器:pH計、試管、燒杯、滴管。
提示:25℃時,BaCO3飽和溶液的pH=9.6。
【生】只通入少量 CO2氣體,反應生成 Na2CO3。此時,溶液中的溶質有過量的 NaOH 和生成的 Na2CO3。檢驗方案:加入少量 BaCl2溶液,生成白色沉淀,證明有 Na2CO3;因為 Na2CO3水解顯堿性,會干擾 NaOH 的檢驗;所以,加入過量BaCl2溶液,除去Na2CO3;充分靜置后,取少量上層清液,用pH計測定溶液的pH,如果 pH 明顯大于9.6,證明有NaOH。
【問題3】通入一定量的 CO2氣體后,若溶液中只含一種溶質,該溶質可能是什么?請你設計一個簡單實驗進行驗證。
【生】溶液中只含一種溶質,可能是 Na2CO3或者 NaHCO3。可以用BaCl2溶液驗證,若產生白色沉淀,說明溶質是Na2CO3;反之,則是NaHCO3。
【問題4】如何利用 CO2氣體和 NaOH溶液制備純凈的Na2CO3?請簡要描述實驗方案,用化學方程式說明實驗原理。
【生1】往NaOH溶液中通入適量CO2,控制n(CO2)∶n(NaOH)=1∶2。原理:2NaOH+CO2=Na2CO3+H2O。
【生2】往 NaOH 溶液中通入過量 CO2,將生成的 NaHCO3分離出來,放入坩堝中灼燒至恒重。原理 :NaOH+CO2=NaHCO3,2NaHCO3 Na2CO3+H2O+ CO2↑。
【生3】先將 NaOH 溶液分成兩等份,往其中一份中通入過量CO2,再將二者混合。原理:NaOH+CO2= NaHCO3,NaOH+NaHCO3=Na2CO3+H2O。
【思考與交流】從操作的簡約性角度考慮,你覺得哪種實驗方案最好?
【課堂小結3】(1)CO2和NaOH溶液反應的產物與通 入的 CO2氣 體的 量有 關:CO2少 量,生成 正鹽 (Na2CO3);CO2過量,生成酸式鹽(NaHCO3);(2)設計物質檢驗方案,要排除相互間的干擾。(3)設計實驗方案的原則:科學可行、操作簡單、現象明顯、綠色經濟。
4.基于實驗“測定w(Na2CO3)”復習碳酸鈉和碳酸氫鈉的性質
【實驗情境4】某樣品中含有 Na2CO3和 NaHCO3,請你設計實驗方案,測定樣品中Na2CO3的質量分數w (Na2CO3)。
步驟1:取少量樣品于試管中,稱量,質量記為m1g。
……
要求:簡單描述實驗方案、實驗原理和操作步驟,如有需要,請展示實驗裝置圖。
學生分組討論,派代表匯報方案。
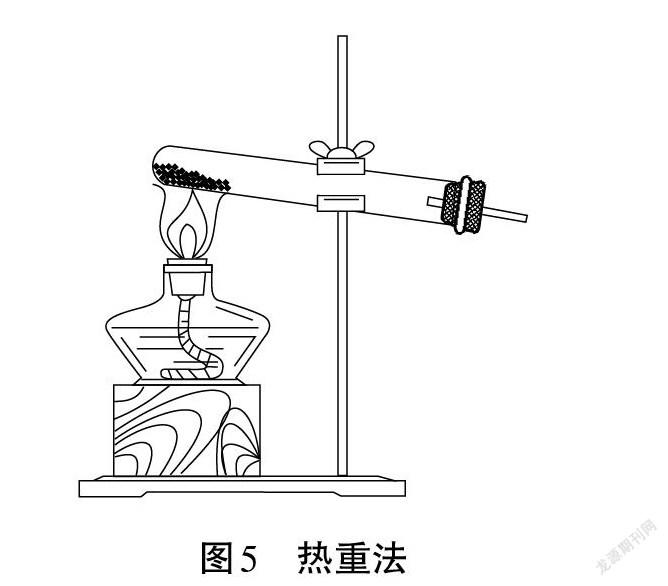
【小組一】我們小組設計的方案采用熱重法,裝置如圖5所示。將固體加熱至恒重,加熱后固體的質量記為m2g。可以計算得到w(Na2CO3)。
【問題】恒重的標準是什么?
【生】多次稱量,結果質量相差很小,就表示恒重。
【教師】一般認為,連續兩次稱量的質量相差小于0.1g,表示恒重。
【小組二】我們小組設計的方案采用沉淀法。將樣品配成溶液,加入足量 Ba(OH)2溶液,過濾、洗滌、干燥、稱量,可計算w(Na2CO3)。
【問題】沉淀劑能不能選擇其它物質?
【生1】也可以選用Ca(OH)2溶液。
【生2】Ca(OH)2溶液不好,因為 Ca(OH)2微溶于水,需要的 Ca(OH)2溶液量會很大,過濾操作耗時太長。因此,我選擇用Ba(OH)2固體作沉淀劑。
【生3】CaCl2溶液或者 BaCl2溶液都可以,都能夠和Na2CO3反應生成沉淀。
【問題】CaCl2溶液和 BaCl2溶液,哪個比較好?為什么?
【生1】CaCl2溶液比較好,因為Ba2+是重金屬離子,容易造成污染。
【生2】從測量結果的準確性考慮,選擇BaCl2溶液更好。因為 Ba 的相對原子質量比 Ca 的大得多,相對誤差更小。
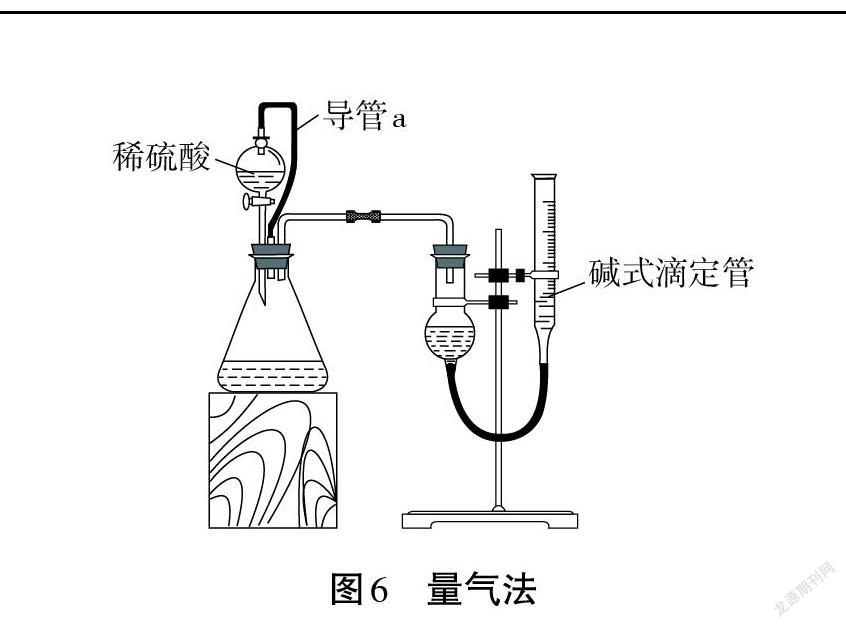
【小組三】我們小組設計的方案采用量氣法,裝置如圖6所示。
【問題1】導管a 的作用是什么?
【生】平衡壓強,使稀硫酸順利流下;還可以減小實驗誤差,使測得的CO2氣體的體積更準確。
【問題2】堿式滴定管中盛放的試劑是什么?理由是什么?
【生】飽和NaHCO3溶液,可以抑制 CO2溶解,使測定結果更準確。
【問題3】為了使測定結果更準確,計數時要注意什么問題?
【生】冷卻到室溫后,上下移動堿式滴定管使兩邊的液面相平,視線要和凹液面的最低處、刻度線在同一直線上。
【小組四】我們小組設計的方案采用滴定法,裝置如圖7所示。
【思考與交流】上述方法中,操作最簡單的是哪
種?測定結果最準確的是哪種?
【課堂小結4】(1)Na2CO3和 NaHCO3的性質總結;(2)定量實驗的思維模型:明確目的→分析原理→設計方案→開展實驗→數據處理→誤差分析;(3)定量實驗的關鍵:減小實驗誤差,保證測量數據的準確性。
七、教學反思
1.發揮化學實驗價值,精心設計實驗活動
以實驗為基礎是化學學科的重要特征之一,化學實驗對于全面發展學生的化學學科核心素養有著極為重要的作用[5]。充分發揮化學實驗的教學功能,精心設計實驗探究活動,對實驗情境素材進行深入探究,完成對實驗本體的開發;深入了解學生學習情況,結合學生思維的最近發展區,分析實驗情境中學生在知識、能力、素養等方面可能的增長點,設置合理的探究臺階,開發有梯度的問題鏈,將復雜實驗情境轉化為學生課堂上可完成的問題解決活動。
2.強化證據推理能力,提升建模用模意識
證據推理是邏輯推理能力在化學學科中的重要的表現形式,要求考生能夠根據證據,對物質組成、結構及性質變化進行分析推理[10]。基于實驗情境開展元素化合物復習,有利于強化學生的證據意識,引導學生基于證據對物質的性質、變化和實驗現象、結論提出可能的假設,通過分析推理加以證實或證偽;建立觀點、結論和證據之間的邏輯關系。在分析和解決實驗問題的過程中,建立元素化合物性質的認知模型、物質制備實驗裝置連接模型、定量實驗的思維模型等思維程序,以期在后續復習過程中應用、遷移、創新。
參考文獻
[1] 教育部考試中心.中國高考評價體系[M].北京:人民教育出版社,2019.11:7.
[2] 崔允漷.學科核心素養呼喚大單元教學設計[J].上海教育科研,2019(4):1.
[3] 人民教育出版社,課程教材研究所,化學課程教材研究開發中心.普通高中課程標準實驗教科書化學1 必修[M].北京:人民教育出版社,2007:46-63.
[4] 人民教育出版社,課程教材研究所,化學課程教材研究開發中心.普通高中教科書化學必修第一冊[M].北京:人民教育出版社.2019:32-40.
[5] 中華人民共和國教育部.普通高中化學課程標準(2017年版)[S].北京:人民教育出版社,2018:15,17,72.
[6] 葉蘭峰,孔琴飛,張禮聰.高三專題復習走出“老套路”,邁向“新情境”——以“鈉及其重要化合物”為例[J].中學化學教學參考,2014(21):36-39.
[7] 鄭雅蘭,劉麗君.改進鈉及其重要化合物的實驗 提升元素化合物復習效率[J].化學教學,2017(3):75-77.
[8] 單旭峰,宋修明.真實情境的高考化學命題理論與實踐[J].中學化學教學參考,2019(9):1-5.
[9] 王磊.基于學生核心素養的化學學科能力研究[M].北京:人民教育出版社,2017.12:207.
[10]教育部考試中心.2018年普通高等學校招生全國統一考試系列用書·高考理科試題分析(理科綜合分冊)[M].北 京:高等教育出版社,2018:8.
3370500338296

