結核分枝桿菌膜蛋白MmpS5-MmpL5的表達及功能研究
李東碩 王彬 陸宇 徐建
貝達喹啉(bedaquiline,Bdq)能夠抑制結核分枝桿菌(Mycobacteriumtuberculosis,MTB)的三磷酸腺苷(adenosine triphosphate,ATP)合成酶,有著重要的滅菌活性,是縮短結核病療程和治療耐藥結核病的關鍵新藥[1]。2018年,世界衛生組織(World Health Organization,WHO)將Bdq列為治療耐多藥結核病(MDR-TB)或利福平耐藥結核病(RR-TB)的A組藥物[2]。Bdq的臨床耐藥株很快出現[3-4],迫切需要對其耐藥機制進行深入研究,以便在臨床大規模使用該藥品時,能夠合理用藥,降低耐藥率的發生。
盡管編碼ATP合成酶的atpE基因突變與Bdq耐藥相關,但在Bdq治療的臨床患者中分離的很少。臨床上首先發現且報道最多的是Rv0678基因突變[3-5]。筆者前期研究也在中國MDR-TB患者中分離到了Bdq和氯法齊明的原發耐藥株,發現MTB的Rv0678突變會導致其對Bdq與氯法齊明的交叉耐藥[6]。Rv0678基因是MmpS5-MmpL5系統的轉錄抑制因子,Rv0678基因突變會引起外排泵基因mmpS5及mmpL5的過表達。
MmpL5是多重跨膜的膜蛋白,其蛋白結構尚無解析,MmpS5-MmpL5的功能尚不清楚。膜蛋白的表達與純化一直是研究膜蛋白功能的技術難題。筆者前期在大腸桿菌中多次嘗試表達但結果仍不理想。考慮到恥垢分枝桿菌基因組與MTB高度同源,恥垢分枝桿菌屬快生長分枝桿菌且具有無致病性及傳染性等優點,筆者采用恥垢分枝桿菌作為模式菌研究,對pMV261載體進行改造,在載體上插入用于調控乙酰胺酶表達的可誘導型啟動子,構建了MmpL5和MmpS5-MmpL5蛋白在恥垢分枝桿菌中的表達體系,并對其功能進行了研究,以期為后續蛋白純化并研究Bdq的轉運機制奠定基礎。
材料和方法
一、實驗菌株
MTB標準株H37Rv(ATCC 27294)和恥垢分枝桿菌MycobacteriumsmegmatisMC2155(ATCC 700084)由首都醫科大學附屬北京胸科醫院/北京市耐藥結核病重點實驗室保存并提供。
二、實驗藥物
Bdq(上海瀚香生物科技公司;批號:20200518;純度≥98%)、異煙肼(美國Sigma公司;批號:MKBV9475V;純度≥99%)。
三、 儀器與試劑
1.儀器:Nuaire701二氧化碳恒溫培養箱(美國Nuaire公司)、Infinite 200多功能酶標儀(瑞士Tecan 公司)、GENEPRO多功能基因擴增儀(杭州博日科技股份有限公司)、Amersham Imager 600蛋白成像儀(美國GE公司)、Max-Q8000低溫搖床(美國賽默飛世爾科技公司)、DS-11FX超微量分光光度計(美國DeNovix公司)、Tanon-4200全自動數碼凝膠成像系統(上海天能科技有限公司)。
2.試劑:pMV261質粒為本實驗室保存;KpnⅠ(R0142V)、BamHⅠ(R0136V)、EcoRⅠ(R0101V)、HpaⅠ(R0105V)、HindⅢ(R0104V)均購自美國紐英倫生物技術公司;E.coliDH5α購自寶生物工程(大連)有限公司(批號:R2015V);pLB零背景快速連接試劑盒購自天根生化科技(北京)有限公司(批號:VT205);ATP檢測試劑盒(S0026)、特超敏ECL化學發光試劑盒(P0018AS)、苯甲基磺酰氟(PMSF;ST506)、細胞膜蛋白與細胞漿蛋白提取試劑盒(P0033)均購自上海碧云天生物技術有限公司。
四、構建帶有組氨酸標簽的乙酰胺誘導型載體pMV261s
采用PCR的方法從恥垢分枝桿菌中擴增乙酰胺酶基因,引物序列如下:AI-F:5′-ctaggtaccagtgacgcggtctcaagcg-3′(KpnⅠ),AI-R:5′-ctaggatcc-aaaactacctcgggcatgtgg-3′(BamHⅠ),下劃線處為酶切位點。PCR反應后目的基因與pLB克隆載體連接,目的片段經瓊脂糖凝膠電泳回收與pMV261載體雙酶切后連接。設計一段在N端含有6×His組氨酸標簽的序列,并引入BamHⅠ及HpaⅠ的酶切位點黏性末端,序列如下:261-F:5′-gatcctcaccaccaccaccaccacactagtcagctgcagaattcatatgcatcgatggtt-3′(斜體標示序列為6×His組氨酸標簽序列);261-R:5′-aaccatcgatgcatatgaattctgcagctgactagtgtggtgg-tggtggtggtgag-3′,將上述質粒經BamHⅠ及HpaⅠ雙酶切后,與此序列連接,構建帶有組氨酸標簽的乙酰胺誘導型載體,命名為pMV261s。
五、目的基因與pMV261s的連接及轉化
根據NCBI中MTB標準株H37Rv的mmpS5及mmpL5的基因序列設計引物,引物序列如下:mmpS5-F:5′-ccggaattcgatgattggaactctcaagc-3′和mmpL5-F:5′-ccggaattcgatgatcgtgcaaaggac-3′ (EcoRⅠ);mmpL5-R:5′-ccggttaactcagaccaaggcgaagg-3′(HpaⅠ);構建mmpS5-mmpL5全長基因,前引物為mmpS5-F,后引物直接為mmpL5-R。PCR擴增,瓊脂糖凝膠電泳,切膠回收,pLB載體過夜連接提取目的基因。EcoRⅠ及HpaⅠ雙酶切的目的基因與pMV261s載體連接,轉化連接產物至E.coliDH5α大腸桿菌感受態細胞,挑取陽性克隆并測序驗證。
將測序驗證正確的含mmpL5及mmpS5-mmpL5基因的質粒及空質粒電轉入恥垢分枝桿菌感受態細胞,電轉條件為電壓2500 V、電容25 μF,電阻1000 Ω,電轉化杯厚度2 mm。轉化后于含10% OADC添加劑的7H9培養基中37 ℃恒溫搖床繼續培養4 h,吸取一定體積涂布在含終濃度為50 μg/ml的卡那霉素的LB平板上,挑取單克隆于7H9+10% OADC+50 μg/ml卡那霉素培養基培養。
六、MmpL5及MmpS5-MmpL5蛋白的表達
待菌液培養至波長600 nm處吸光度值(A600值)等于0.8,加入終濃度為0.2%的乙酰胺溶液誘導蛋白表達,37 ℃條件下繼續培養20 h,收集誘導表達后的菌液,離心后棄上清,菌沉淀用預冷的磷酸鹽緩沖液(PBS)重懸,離心棄上清,菌沉淀加入細胞膜蛋白與細胞漿蛋白抽提試劑A和PMSF,懸浮后冰浴10~15 min,高壓破碎儀破碎菌體,4 ℃ 1200×g離心10 min,收集上清液,繼續14 000×g離心30 min,吸除上清,沉淀加入膜蛋白抽提試劑B,振蕩后冰浴,14 000×g離心5 min,抽提膜蛋白。
七、蛋白免疫印跡分析
提取的蛋白進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE),轉移至聚偏氟乙烯(PVDF)膜,用含5%脫脂奶粉的TBST緩沖液封閉2 h,加入1∶2000的抗組氨酸鼠源IgG單克隆抗體一抗,TBST緩沖液洗去一抗,加入1∶5000的羊抗鼠IgG二抗孵育,TBST緩沖液洗去二抗,加入辣根過氧化物酶顯色劑孵育后,進行化學顯色檢測。
八、生長曲線的測定
為了驗證外源基因表達對恥垢分枝桿菌生長的影響,測定了空質粒、表達MmpL5及MmpS5-MmpL5的菌株的生長曲線。將這3種細菌培養至對數生長期后,調整A600值一致,之后按1%接種在含0.05%吐溫-80的7H9+10%OADC培養基中,37 ℃恒溫搖床繼續培養,每隔5 h測定1次A600值,每個樣品設置2個生物學重復,繪制生長曲線。
九、檢測抗菌藥物對恥垢分枝桿菌的最小抑菌濃度(minimal inhibitory concentration,MIC)
將3種細菌培養至對數生長期,用7H9+10%OADC培養基將菌液稀釋至終濃度為1×105CFU/ml。取96孔黑色培養板,依次將異煙肼及Bdq倍比稀釋。37 ℃培養3 d后,各孔加入20 μl的阿爾瑪藍和12.5 μl的20%吐溫-80,37 ℃繼續培養24 h,記錄各孔顏色,藍色表示菌株無生長,紅色表示有菌生長,MIC表示由藍色變為紅色的的最低藥物濃度。
十、恥垢分枝桿菌對溴化乙錠(ethidium bromide,EtBr)的積累實驗
MmpS5-MmpL5蛋白屬于RND超家族外排泵,EtBr常被用作測試藥物外排泵活性的通用型底物。離心收集培養至對數生長期的3種細菌,并用PBS重懸洗滌菌體2次,調節各菌A600值為0.4,吸取198 μl重懸菌液,加入2 μl濃度為100 μg/ml的EtBr至終濃度為1 μg/ml,混勻,立即用Infinite M200多功能酶標儀檢測熒光值,設置激發波長為545 nm,發射波長為590 nm,每隔5 min檢測1次,共檢測60 min,設置3個生物學重復。
十一、恥垢分枝桿菌ATP含量測定
取培養至對數生長期的3種細菌,用7H9培養基調節A600值為0.4,向菌液中加入終濃度為1/2 MIC(0.125 μg/ml)的Bdq,孵育24 h,離心收集等體積的3種細菌,離心后棄上清,菌沉淀加入裂解液,振蕩混勻。96孔黑色培養板中加入100 μl裂解菌液和100 μl稀釋后的ATP檢測液,酶標儀測定相對光單位(relative light unit,RLU)值,根據標準曲線及測定的RLU值計算出各菌液中的ATP含量。
十二、統計學處理
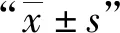
結 果
一、帶有組氨酸標簽的乙酰胺誘導型載體pMV261s的構建
通過改造pMV261穿梭載體,添加乙酰胺酶啟動子基因(pACE),并添加組氨酸標簽便于重組蛋白的驗證及純化,建立帶有組氨酸標簽的乙酰胺可誘導型表達載體pMV261s。對恥垢分枝桿菌乙酰胺酶啟動子基因進行PCR擴增,片段長度為2618 bp(圖1),連接pLB克隆載體成pLB-pACE,KpnⅠ及BamHⅠ雙酶切后目的條帶大小正確(圖2),在乙酰胺酶啟動子基因上有HindⅢ酶切位點,在含組氨酸標簽的序列上有EcoRⅠ酶切位點,雙酶切后片段長度為1584 bp(圖3)。由此證明組氨酸標簽連接成功,同時測序驗證正確,pMV261s載體構建成功。

注 泳道M為DL 5000 DNA Marker;圖1中泳道1和2均為pACE基因;圖2中泳道1為pLB-pACE載體單酶切,泳道2和3均為pLB-pACE載體雙酶切驗證;圖3中泳道1為pMV261s載體單酶切,泳道2和3均為pMV261s載體雙酶切驗證圖1~3 帶有組氨酸標簽的乙酰胺誘導型pMV261s載體的構建

注 泳道M為DL 5000 DNA Marker;圖4中泳道1和2均為mmpL5基因;泳道3和4均為mmpS5-mmpL5基因。圖5中泳道1為pMV261s-mmpL5載體單酶切;泳道2為pMV261s-mmpL5載體雙酶切。圖6中泳道1為pMV261s-mmpS5-mmpL5單酶切;泳道2為pMV261s-mmpS5-mmpL5雙酶切圖4~6 目的基因與pMV261s載體的連接與驗證
二、pMV261s-mmpL5和pMV261s-mmpS5-mmpL5表達載體的構建
PCR方法擴增MTB的mmpL5及mmpS5-mmpL5基因,mmpL5片段長度為2895 bp,mmpS5-mmpL5片段長度為3320 bp,目的基因條帶大小正確(圖4),EcoRⅠ和HpaⅠ雙酶切目的基因及pMV261s表達載體,雙酶切條帶大小正確(圖5,6),測序結果無突變。
三、MmpS5-MmpL5及MmpL5蛋白在恥垢分枝桿菌中的表達

注 泳道1為pMV261s-mmpS5-mmpL5重組菌株;泳道2為pMV261s-mmpL5重組菌株;泳道3為pMV261s菌株;泳道M為蛋白質相對分子質量標準圖7 蛋白免疫印跡分析重組恥垢分枝桿菌的MmpS5-MmpL5和MmpL5蛋白
對經乙酰胺誘導的pMV261s-mmpL5、pMV261s-mmpS5-mmpL5重組菌株及pMV261s空質粒菌株進行蛋白免疫印跡分析,MmpL5蛋白相對分子質量為104 800,MmpS5-MmpL5蛋白相對分子質量為120 100,加上6×His組氨酸標簽組成的重組蛋白,在相對分子質量為110 000~130 000處出現目的條帶,而空質粒菌株沒有條帶(圖7),表明MmpL5及MmpS5-MmpL5蛋白在恥垢分枝桿菌中成功表達。
四、MmpL5和MmpS5-MmpL5蛋白的表達對恥垢分枝桿菌生長無影響
為考察MmpL5和MmpS5-MmpL5蛋白的表達是否影響恥垢分枝桿菌的生長特性,比較3種細菌的生長曲線,發現表達mmpL5及mmpS5-mmpL5基因的恥垢分枝桿菌與攜帶pMV261s空質粒的恥垢分枝桿菌,均在15 h之后進入對數生長期,25 h達到平臺期,三者生長特性沒有明顯差異(圖8)。

圖8 不同重組的恥垢分枝桿菌的生長曲線
五、Bdq對表達MmpS5-MmpL5蛋白的恥垢分枝桿菌的敏感性降低
異煙肼對表達MmpL5及MmpS5-MmpL5蛋白的重組恥垢分枝桿菌及攜帶空質粒的恥垢分枝桿菌的MIC均為1 μg/ml,表明異煙肼不是MmpS5-MmpL5蛋白外排系統的底物。Bdq對表達MmpL5蛋白及帶有空質粒的恥垢分枝桿菌的MIC值為0.25 μg/ml,而對表達MmpS5-MmpL5蛋白的恥垢分枝桿菌的MIC為2 μg/ml,MIC值提高了8倍。由此證明,MmpL5與MmpS5蛋白共表達才能發揮作用,且MmpS5-MmpL5蛋白的表達導致Bdq的耐藥。
六、表達MmpS5-MmpL5蛋白的恥垢分枝桿菌外排能力增強
檢測重組恥垢分枝桿菌對EtBr的積累,發現表達MmpL5蛋白與攜帶有pMV261s空質粒的恥垢分枝桿菌對EtBr的積累大致相同(△熒光強度值分別為655和642),而表達MmpS5-MmpL5蛋白的恥垢分枝桿菌對EtBr的積累(△熒光強度值為395)較MmpL5組和pMV261s空質粒組減少約40%(表1),說明MmpS5-MmpL5蛋白具有外排能力,而沒有MmpS5的MmpL5蛋白不能形成外排泵。

表1 不同重組的恥垢分枝桿菌對溴化乙錠的積累影響
七、Bdq對表達MmpS5-MmpL5蛋白的恥垢分枝桿菌體內ATP含量影響較小
使用1/2 MIC濃度的Bdq作用24 h后,比較藥物作用前后菌體內ATP含量的變化。Bdq作用前表達MmpL5蛋白組菌體ATP水平[(0.193±0.028) μmol/L)]、表達MmpS5-MmpL5蛋白組菌體ATP水平[(0.197±0.018) μmol/L]與攜帶pMV261s質粒組菌體ATP水平[(0.181±0.013) μmol/L]相比,差異無統計學意義(F=0.539,P=0.609)。Bdq作用后,表達MmpL5蛋白組菌體ATP水平[(0.056±0.009) μmol/L]與pMV261s空質粒組菌體內ATP水平[(0.055±0.008) μmol/L]相比,差異無統計學意義(F=62.914,P=0.929)。藥物作用后,表達MmpS5-MmpL5蛋白的重組恥垢分枝桿菌內ATP水平[(0.125±0.010) μmol/L]降低36.49%,而表達MmpL5蛋白組菌體ATP水平降低71.21%,空質粒組菌體ATP水平降低69.49%,表達MmpS5-MmpL5蛋白組菌體ATP水平明顯高于表達MmpL5蛋白組和空質粒組,差異有統計學意義(F=5.172,P=0.049)。這提示MmpS5與MmpL5蛋白作為復合體導致菌體外排Bdq能力增加,使Bdq作用于ATP合成酶的量減少,從而使菌體內ATP水平下降較少。
討 論
外排泵能夠將菌體內藥物泵出,外排泵過表達使得菌體內藥物濃度不能有效抑制分枝桿菌生長,是MTB耐藥的重要原因之一。MmpL是分枝桿菌基因組編碼的一組膜蛋白,屬于外排泵RND蛋白超家族,在脂質、聚合物和免疫調節劑的運輸過程中發揮重要作用[7]。筆者團隊前期研究發現,Bdq和氯法齊明對Rv0678突變的MTB交叉耐藥[6, 8-9],Rv0678突變導致mmpL5和mmpS5表達的上調[5, 10]。近年研究表明,MmpS5-MmpL5系統也可以轉運分枝菌素[11]。MTB編碼13種MmpL蛋白,其中,MmpL5蛋白(Rv0676c基因編碼)由964個氨基酸組成,理論相對分子質量為104 800,由12個跨膜結構域及2個周質結構域組成[12]。附屬蛋白MmpS5(Rv0677c基因編碼)由142個氨基酸組成,理論相對分子質量為15 200。mmpL5在轉錄上與mmpS5基因相偶聯,二者位于同一操縱子內,受下游的轉錄抑制因子Rv0678的調控[13]。Andries 等[5]在MTB中單獨過表達MmpS5蛋白沒有改變Bdq對其的MIC值,提示單一的MmpS5蛋白對藥物外排無影響,因此,本研究中沒有單獨構建MmpS5蛋白。
膜蛋白的表達與純化一直是蛋白研究的技術難題,筆者課題組前期在BL21plys大腸桿菌及C43大腸桿菌中多次嘗試表達膜蛋白MmpL5蛋白都未能獲得理想結果,可能是外源膜蛋白在大腸桿菌中的毒性、錯誤折疊、聚集等導致表達量低。MTB的MmpL5與恥垢分枝桿菌同源MSMEG_1382的序列相似性為62.96%,表明MmpL5蛋白表達相應的條件在恥垢分枝桿菌可能具備。恥垢分枝桿菌無傳染性和致病性,生長較快、操作較為容易[14]。這些特點都是恥垢分枝桿菌作為表達宿主菌的優勢。乙酰胺酶啟動子是一種強啟動子,在恥垢分枝桿菌中受到嚴謹調控, 誘導后高水平表達[14]。Zhang等[15]利用乙酰胺酶啟動子構建了MmpL3表達載體,成功實現了在恥垢分枝桿菌中表達和純化。本研究通過改造pMV261穿梭載體,建立了帶有組氨酸標簽的乙酰胺誘導型表達載體pMV261s-mmpL5和pMV261s-mmpS5-mmpL5,蛋白免疫印跡驗證了蛋白在恥垢分枝桿菌的成功表達。
本研究通過Bdq對3種重組菌株的藥物敏感性試驗發現,共表達MmpS5-MmpL5蛋白的恥垢分枝桿菌會降低Bdq對其的活性,而僅表達MmpL5蛋白的重組恥垢分枝桿菌對Bdq的藥物敏感性無影響。這與Yamamoto 等[16]發現MmpS5促使MmpL5蛋白單聚體組裝成三聚體發揮功能的結果一致。EtBr是一種熒光染料,是多數外排泵的轉運底物,通常被用作測試藥物外排泵活性的通用型底物[17]。重組恥垢分枝桿菌對EtBr的積累實驗表明,MmpS5-MmpL5蛋白表達比MmpL5蛋白單獨表達和空質粒組對EtBr的積累量較少,其外排能力增加。單獨MmpL5蛋白表達與空質粒相比沒有差異,進一步說明MmpS5和MmpL5蛋白共表達形成外排泵,發揮生物學功能。貝達喹啉的作用靶點是ATP合成酶,進而導致菌體內的ATP合成減少而發揮抗菌作用。為了考察Bdq通過MmpS5-MmpL5蛋白外排影響菌體內ATP水平,筆者在1/2 MIC濃度的Bdq作用下,發現共表達MmpS5-MmpL5蛋白的恥垢分枝桿菌菌體內ATP含量較表達MmpL5蛋白和攜帶空質粒組變化小。結合MmpS5-MmpL5蛋白共表達導致的外排能力增強,表明MmpS5-MmpL5蛋白外排系統以Bdq為底物,通過增加Bdq的外排量使菌體內Bdq的含量降低,進而使Bdq抑制靶點ATP合成酶的量減少,導致菌體內ATP水平的變化較少。
綜上所述,筆者構建了MTB的膜蛋白MmpL5及外排泵MmpS5-MmpL5在恥垢分枝桿菌中的表達體系。功能實驗也表明了MmpS5-MmpL5蛋白共表達形成外排泵發揮作用,降低Bdq的藥物敏感性。本研究深化了對Bdq耐藥機制的理解,而膜蛋白表達體系的建立為蛋白的純化和進一步研究Bdq的轉運機制奠定了基礎。

