紫杉醇藥物涂層球囊對癥狀性股腘動脈硬化閉塞癥的療效分析
官澤宇,宋濤,任天才,余朝文
(蚌埠醫學院第一附屬醫院血管外科,安徽 蚌埠 233004)
下肢動脈硬化閉塞癥是指下肢動脈粥樣硬化斑塊形成導致下肢動脈狹窄、閉塞,進而造成肢體慢性缺血[1]。股腘動脈硬化閉塞患者肢體發涼麻木、靜息痛、間歇性跛行、肢體潰瘍壞疽,嚴重時需要截肢[2]。目前,對于股腘動脈硬化閉塞癥,國內治療主要采用PTA結合支架治療的形式。然而,臨床研究[3]也顯示,支架植入后,存在斷裂、慢性刺激等問題。隨著腔內技術進步,藥物球囊逐漸應用于臨床下肢動脈疾病治療中,該技術將紫杉醇等血管增生抑制藥物,涂抹于球囊表面,藥物經輸送系統進入到靶血管中,經球囊使血管壁擴張,減輕血管狹窄,同時涂層藥物與病變血管壁接觸釋放,抑制血管壁內膜增生狀態,減少再狹窄風險[4]。為進一步分析股腘動脈硬化閉塞癥患者治療中應用紫杉醇藥物涂層球囊的療效和安全性,本研究通過與常規外周動脈金屬支架進行對比,闡述紫杉醇藥物涂層球囊的應用效果,為臨床提供參考。
1 資料與方法
1.1 一般資料
選取2017年1月至2020年8月蚌埠醫學院第一附屬醫院62例癥狀性下肢動脈硬化閉塞癥患者為研究對象,依據按治療方式不同分為觀察組與對照組,每組各31例。觀察組中,男性20例,女性11例;年齡61~85歲,平均(75.26±7.41)歲。對照組中,男性21例,女性10例;年齡57~89歲,平均(73.47±10.11)歲。本研究經醫院倫理委員會通過,患者及家屬知情同意,兩組患者一般資料比較,差異無統計學意義(P>0.05)。納入標準(1)臨床診斷為癥狀性股腘動脈硬化閉塞癥,Rutherford分級2~5級,患者有明顯的下肢缺血現象,且存在間歇性跛行、靜息痛等癥狀;(2)股淺動脈或(和)腘動脈重度狹窄或閉塞;(3)初發病例;(4)病變遠端至少1支膝下動脈通暢或經干預后維持血流通暢。排除標準 (1)非動脈硬化閉塞性病變;(2)形成急性下肢動脈血栓;(3)合并嚴重腎功能不全;(4)合并凝血功能異常;(5)對紫杉醇、造影劑等過敏,以及不能耐受抗凝和抗血小板藥物治療者;(6)血管造影顯示重度鈣化;(7)其他不耐受手術者。
1.2 方法
所有患者術前均接受降脂、抗凝、血管擴張等治療,對于合并其它基礎病變者予以相應對癥處理。術前,患者平臥位,首選局部麻醉,如不能配合可根據需要選擇全身麻醉。根據病變情況選擇合適穿刺部位,經同側或對側穿刺股總動脈,成功后置入4-6 F動脈血管鞘,靜脈給予30~40 mg肝素鈉半肝素化,下肢動脈造影了解病變位置、長度等。先以普通球囊預擴張,維持2~3 min,復造影,確認無殘余狹窄、限流性夾層、遠端閉塞等。之后,觀察組患者采用紫杉醇藥物涂層球囊擴張成形,接受紫杉醇藥物涂層球囊(北京先瑞達醫療科技,3 mg/mm2紫杉醇涂層),擴張3~5 min。對照組接受普通金屬裸支架進行血管再通,行支架內再擴張。球囊與金屬支架長度超靶病變近遠端10 mm,球囊和支架各枚間重疊>10 mm。再次行血管造影,記錄最小管腔直徑及狹窄程度,如不能滿足血流需要可后擴張或補救支架。如遠端肢體壞疽范圍較大可二期清除。
1.3 觀察指標
(1)疼痛程度與間歇性跛行距離:術前、術后1周、術后1個月疼痛評分(VAS評分)與間歇性跛行距離。VAS評分標準[5]:VAS量表將疼痛程度以0~10分表示,患者依據自身情況從其中選擇一個代表疼痛嚴重程度,分數越高則疼痛程度越強。間歇性跛行距離:患者從開始走路到出現單側或雙側腰酸腿痛、下肢麻木無力以至跛行間的距離。(2)Rutherford 分級[6]:術前、術后12個月進行。0級為無癥狀;1級為輕度間歇性跛行(跛行距離>500 m);2級為中度間歇性跛行(跛行距離300~500 m);3級為重度間歇性跛行(跛行距離<300 m);4級為靜息痛;5級為輕微組織缺損;6級為組織潰瘍、壞疽。(3)血管最小管腔直徑及晚期管腔丟失:術前、術后即刻、術后6個月、術后12個月最小管腔直徑(MLD)變化及術后6個月、術后12個月晚期管腔丟失(LLL)。通過靶血管下肢動脈多普勒超聲計算靶病變MLD。LLL是首次試驗球囊擴張后MLD與術后6個月、12個月復查時同一部位MLD差值,LLL越大代表血管重塑越嚴重,管腔面積丟失率越高。(4)踝肱指數(ABI):比較兩組術前、術后1周、術后3個月、術后6個月、術后12個月患肢ABI,即踝部動脈、肱動脈收縮壓比值,ABI越低代表患肢缺血越嚴重。(5)一期通暢率與再狹窄率:術后一期通暢率和再狹窄率。一期通暢率定義為隨訪期間治療段血管無明顯閉塞。再狹窄定義:患者術后12 個月復查多普勒超聲,狹窄率=[1-(狹窄動脈/正常動脈直徑)]×100%),狹窄率≥50%為再狹窄。(6)截肢和死亡率。
1.4 統計學分析

2 結果
2.1 兩組疼痛程度與間歇性跛行距離比較
術前、術后1周、術后1個月,兩組患者VAS評分與間歇性跛行距離比較,差異無統計學意義(P>0.05)。術后1周,兩組患者VAS評分較術前降低(P<0.05),且術后1個月低于術后1周(P<0.05);間歇性跛行距離較術后1周增加(P<0.05)。見表1。
2.2 兩組患者Rutherford 分級比較
術后,兩組患者Rutherford 分級均較術前改善(P<0.05);術后12個月,兩組Rutherford 分級比較,差異無統計學意義(P>0.05)。見表2。
表1 兩組疼痛程度與間歇性跛行距離比較
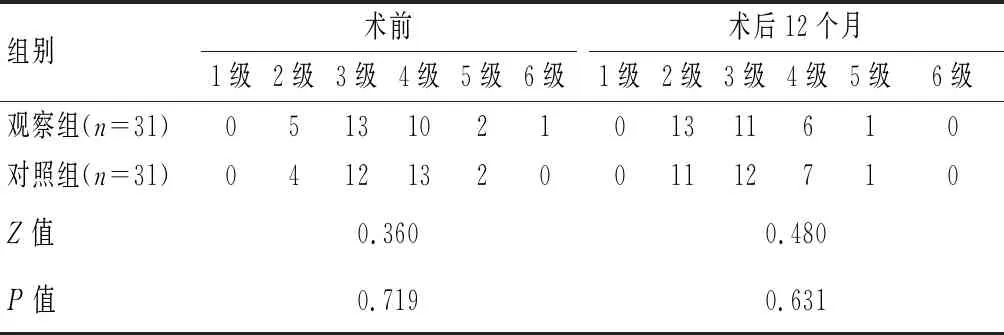
表2 兩組Rutherford 分級比較(例)
2.3 兩組患者血管MLD及LLL比較
兩組患者術前、術后即刻、術后6個月、術后12個月MLD及術后6個月、術后12個月LLL比較,差異無統計學意義(P>0.05);兩組術后即刻MLD較術前增大,差異有統計學意義(P<0.05)。見表3。
表3 兩組患者血管MLD及LLL比較
2.4 兩組患者ABI比較
術前、術后1周、術后3個月、術后6個月,兩組患者ABI比較,差異無統計學意義(P>0.05);兩組患者術后ABI較術前升高,差異有統計學意義(P<0.05);觀察組術后12個月ABI高于對照組(P<0.05)。見表4。
表4 兩組踝肱指數ABI變化比較
2.5 兩組患者術后12個月一期通暢率與再狹窄率比較
兩組患者術后12個月一期通暢率比較,差異無統計學意義(P>0.05);觀察組術后12個月再狹窄率低于對照組(P<0.05)。見表5。
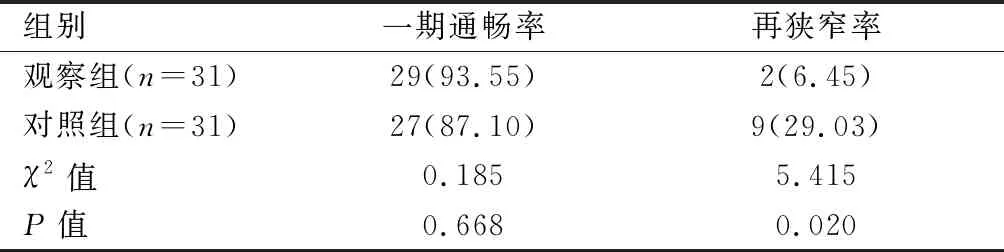
表5 兩組術后12個月一期通暢率與再狹窄率比較[n(%)]
2.6 兩組患者截肢和死亡率比較
兩組患者隨訪過程中均未出現死亡病例和新發壞疽導致的大截肢。
3 討論
股腘動脈因低速率、高阻力血流特點,動脈硬化斑塊易沉積,是下肢動脈硬化閉塞常發部位。腔內治療為股腘動脈硬化閉塞癥主要治療形式,然而由于活動過程中大腿肌肉壓縮、扭曲、平滑肌細胞增生,腔內介入術后發生再狹窄的風險較高[7]。近年來,為降低再狹窄風險,提高通暢率,各種治療新形式不斷涌現。
支架在血管腔內介入治療中血管壁支撐效果良好,其中金屬裸支架為目前臨床應用最廣泛的支架之一。然而,支架植入存在斷裂風險,同時金屬支架作為異體會刺激患者血管,導致局部炎癥,引發血管內膜細胞增生,進而管腔變狹窄。球囊擴張成形術使用球囊擴張,充分伸展血管壁,使得增生斑塊組織斷裂,擴大管壁[8]。研究[9]發現,紫杉醇可抑制血管增生和遷移,抑制內膜增生,減輕血栓形成,組織穿透性與持久性良好。術中紫杉醇釋放到血管壁中,起到提高晚期通暢率效果。紫杉醇藥物涂層球囊擴張成形術操作簡單,適應各類直徑和解剖血管,可在有效抑制血管內膜增生的同時,避免腔內支架植入,為再次腔內治療提供了更多機會。
本研究中,下肢間歇性跛行、靜息痛均是疾病癥典型癥狀。對比兩組患者療效顯示,術后1周、術后1個月,兩組患者VAS評分較術前降低(P<0.05),下肢間歇性跛行距離較術前增加(P<0.05),但兩組差異無統計學意義(P>0.05),說明二種治療方式均有利于患者臨床癥狀的緩解,且二者短期作用效果相當,Merinopoulos等[10]研究結果也支持本結論。兩組患者術后12個月Rutherford 分級差異無統計學意義(P>0.05),說明紫杉醇藥物涂層球囊擴張成形術在改善患者臨床癥狀方面的遠期作用效果不亞于外周動脈金屬支架。
ABI是指踝部、肱動脈收縮壓比值。本研究中,兩組患者術后ABI均較術前改善,兩種治療方式均有利于改善患者缺血癥狀,且觀察組術后12個月ABI大于對照組(P<0.05),但兩組最小管腔直徑、晚期管腔丟失、一期通暢率無統計學差異(P>0.05),說明紫杉醇藥物涂層球囊擴張成形術與外周動脈金屬支架相比一期通暢率及管腔直徑改善效果無明顯差異,但紫杉醇藥物涂層球囊擴張成形術對于ABI的維持效果略優于外周動脈金屬支架。盡管兩種手術方式均可增加管腔直徑,減少再狹窄風險,且支架植入可改善血管通暢性,但相關報告[11]顯示,支架植入1 年再狹窄率達18%~37%,限制了長期通暢率。本研究中觀察組再狹窄率低于對照組(P<0.05),說明紫杉醇藥物涂層球囊擴張成形術的應用有利于降低股腘動脈硬化閉塞癥患者術后再狹窄率,金屬支架對患者血管壁造成長期刺激,細胞外基質堆積,新內膜形成,引起狹窄或閉塞;而藥物涂層球囊表面負載紫杉醇,抗內膜增生,具有良好組織穿透性,球囊擴張時迅速彌散,與細胞內微管蛋白結合,抑制細胞有絲分裂,降低再狹窄風險[12]。
綜上,紫杉醇藥物涂層球囊擴張成形術可有效改善癥狀性股腘動脈硬化閉塞癥患者下肢血管的通暢性,療效顯著,其對于患者臨床癥狀的改善、管腔的擴張和維持效果與金屬支架相當,在術后1年ABI及其維持方面略優于金屬支架,其相較于金屬支架更明顯的優勢在于再狹窄率低。同時藥涂球囊組患者血管內無金屬異物存在,為癥狀復發后的腔內再干預創造了便利條件;同時此類患者為心腦血管意外高危人群,藥涂球囊的使用避免了金屬異物存留給MRI檢查帶來的麻煩。

