測定嬰幼兒配方乳粉中酪蛋白磷酸肽(CPP)樣品前處理方法的優化
◎ 王澤琪,唐 輝,劉 洋,李金龍
(飛鶴(甘南)乳品有限公司,黑龍江 齊齊哈爾 162100)
酪蛋白磷酸肽(Casein Phosphopeptides,CPP)是以牛乳酪蛋白為原料,通過生物技術制得的具有生物活性的多肽,CPP分子由二十到三十幾個氨基酸殘基組成,其中包括4~7個成簇存在的磷酸絲氨酸殘基。大量試驗證明,CPP能有效促進人體對鈣、鐵、鋅等二價礦物營養素的吸收和利用[1]。我國居民膳食組成以植物性食物為主,其中植酸、草酸、纖維素等物質會對鈣、鐵、鋅吸收產生極大的影響,目前,酪蛋白磷酸肽作為營養強化劑應用在嬰幼兒食品中[2]。
目前,對于CPP的檢測主要有電泳法、鋇鹽沉淀法、高效液相色譜法、高效液相色譜-串聯質譜法等[3]。高效液相色譜法檢測CPP操作相對簡單快捷,但由于嬰幼兒配方乳粉樣品基質復雜,在CPP特征峰附近常有干擾峰存在,影響CPP的定量準確性[4]。有文獻報道,利用離子交換固相萃取柱對樣品進行了凈化處理,減少了樣液中的雜質,但經過后續實驗發現凈化效果未能有效適用于所實驗用的嬰幼兒配方奶粉;在對照配料表后,使用RP柱對樣品進行凈化處理,有效去除了對樣品中CPP干擾較大的水解蛋白類原料,該方法可以使樣品中CPP含量的定量更為精準[5]。
1 材料與方法
1.1 材料與試劑
嬰兒配方乳粉、幼兒配方乳粉及對應CPP原料。
實驗室用水為GB/T 6682—2008所規定一級水;乙腈(色譜純,默克公司);乙酸(優級純,天津科密歐公司);0.1%乙酸溶液,10%乙酸溶液。
1.2 儀器與設備
0.22 μm水系濾膜;cleanert IC-RP固相萃取柱,2.5 mL;PCX陽離子交換柱;Waters2695型高效液相色譜儀,配備紫外檢測器(2489),Waters公司;電子天平、pH計(梅特勒-托利多公司);數控超聲波清洗器(昆山市超聲儀器有限公司);渦旋混合器(其林貝爾儀器制造有限公司)。
1.3 試驗方法
1.3.1 樣品前處理
(1)溶解。稱取配方乳粉1 g(精確至0.000 1 g)于100 mL燒杯中,試樣用15 mL約40 ℃的熱水溶解,超聲 10 min。
(2)沉淀及過濾。使用10%乙酸溶液調節樣液pH至4.60±0.05,轉移至25 mL具塞比色管中,用一級水定容,混勻,過濾待凈化。
(3)樣液的凈化。IC-RP柱依次用10 mL甲醇和10 mL水活化(流速2~4 mL·min-1),將樣液用0.22 μm濾膜過濾,之后過活化后的IC-RP柱,棄去前8 mL樣液(流速2~4 mL·min-1),收集3 mL樣液(流速2~4 mL·min-1),渦旋混勻后等待上機測定。
1.3.2 標準儲備液的制備
稱取酪蛋白磷酸肽原料0.05 g(精確至0.000 01 g)于100 mL燒杯中,用25 mL約40 ℃的熱水溶解,超聲10 min后,用10%乙酸溶液調節pH至4.60±0.05,轉移至50 mL容量瓶中,用一級水定容至刻度線。
1.3.3 標準工作液的制備
分別吸取1 mL、2 mL、4 mL、6 mL、8 mL和10 mL酪蛋白磷酸肽標準儲備液至50 mL容量瓶中,用一級水定容至50 mL后,配制成濃度為20 μg·mL-1、40 μg·mL-1、80 μg·mL-1、120 μg·mL-1、160 μg·mL-1和200 μg·mL-1的酪蛋白磷酸肽標準工作液,標準工作液按照1.3.1中(3)進行凈化后等待上機測定。
1.4 色譜條件
色譜柱:Diamonsil C1(8250 mm×4.6 mm,5 μm);柱溫:30 ℃;流動相:A:0.1%乙酸溶液,B:乙腈;檢測波長:280 nm;流速:0.8 mL·min-1;進樣量:20 μL,梯度洗脫參數如表1所示。
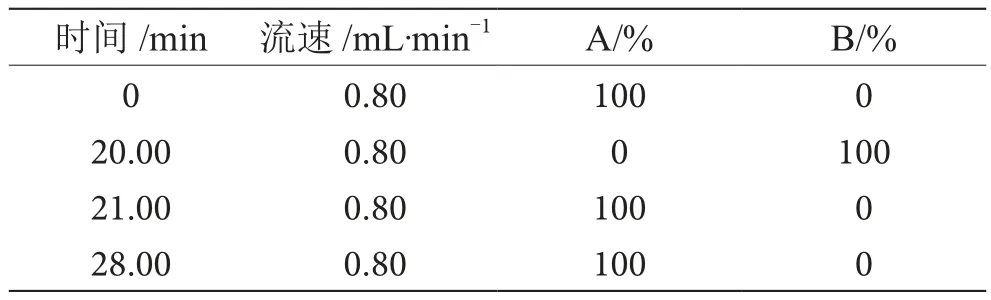
表1 梯度洗脫參數表
2 結果與分析
2.1 嬰幼兒配方乳粉樣品前處理方法優化
對酪蛋白磷酸肽(CPP)原料理論添加量相同的嬰兒配方乳粉和幼兒配方乳粉Ⅱ的CPP含量進行檢測,色譜圖如圖1、圖2所示。結果表明,嬰兒配方乳粉中CPP含量較幼兒配方乳粉中CPP含量低30%。由于嬰幼兒配方乳粉樣品基質復雜,在CPP特征峰附近常有干擾峰存在,影響CPP的定量準確性,根據嬰兒配方奶粉CPP色譜峰(圖1)和幼兒配方奶粉CPP色譜峰(圖2)峰后干擾峰峰面積的差異,選擇根據配料表的差異來測試是何種原料帶來的后方干擾峰。
根據二者后干擾峰峰面積不同選擇二者配料表中存在差異原料對原料進行篩查,選擇對脫鹽乳清粉D90、脫鹽乳清粉D70、乳白蛋白粉、濃縮乳清蛋白粉這幾種原料進行實驗對比,同時也對在嬰兒配方奶粉和幼兒奶粉中添加量差異較大的乳清蛋白粉(水解工藝)進行實驗對比,通過保留時間定性,探究CPP特征峰后的干擾峰是何種原料帶來的影響,根據試驗結果,發現干擾峰來自于乳清蛋白粉(水解工藝)原料。根據配料表中原料乳清蛋白粉(水解工藝)的添加量模擬該原料在嬰兒配方奶粉中添加量和幼兒奶粉添加量,得到與樣品后干擾峰峰型一致的峰型,如圖3所示。選擇可以對有機大分子產生過濾效果的IC-RP柱進行過濾,過柱后該原料所帶來的干擾峰被有效凈化,如圖4所示,使用嬰兒配方奶粉進行驗證,過柱前后CPP特征峰處凈化效果良好,如圖5所示。
2.2 前處理方法優化及方法優化后的線性、重復性、定量限、加標回收結果
2.2.1 前處理方法優化
稱取配方乳粉1 g(精確至0.000 1 g),放入100 mL燒杯中,試樣用15 mL約40 ℃的熱水溶解,超聲10 min;使用10%乙酸溶液調節樣液pH至4.60±0.05,轉移至25 mL具塞比色管中,用一級水定容,混勻,過濾待凈化;IC-RP柱依次用甲醇10 mL和10 mL水活化(流速2~4 mL·min-1),樣液分別過0.22 μm濾膜和活化后的RP柱,棄去前8 mL樣液(流速2~4 mL·min-1),收集3 mL樣液(流速2~4 mL·min-1),渦旋混勻后等待上機測定,過柱凈化后樣品濃度得到有效提升,如表2所示。
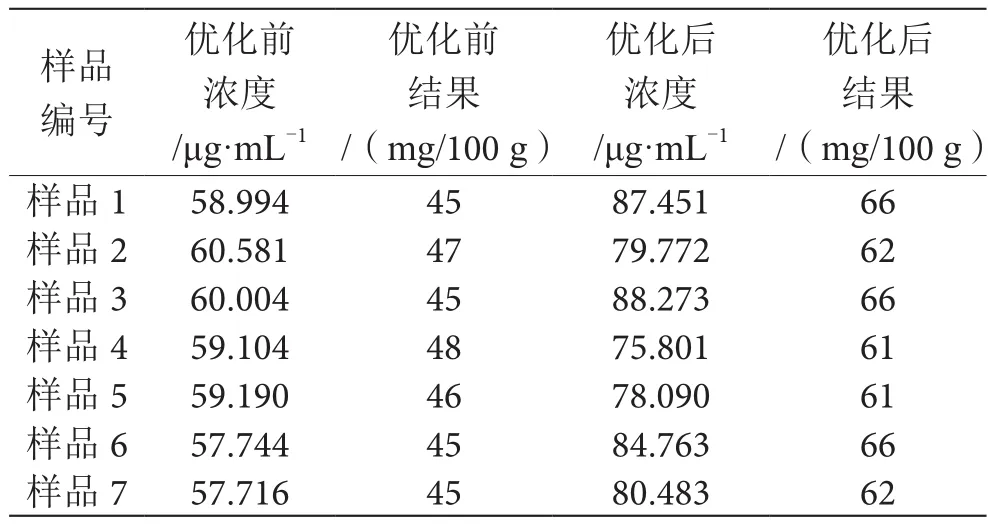
表2 樣品過柱前后數值對比表
2.2.2 線性結果
采用優化方案,對系列標準工作溶液(1.3.3)進行色譜分析,結果如圖6所示。以峰面積為縱坐標,濃度為橫坐標繪制標準曲線,20~200 μg·mL-1線性關系良好,相關系數r2=0.999 723。
2.2.3 重復性
選取嬰兒配方奶粉,采用優化方案對其進行7次平行測定,所得重復性結果見表3,相對標準偏差(Relative Standard Deviation,RSD)為4.06%,精密度良好。
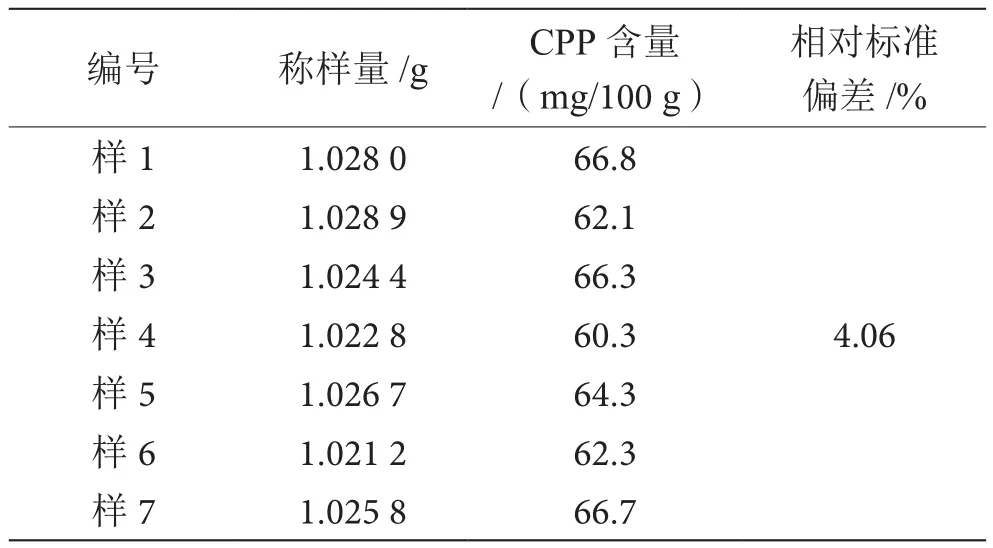
表3 方法精密度表
2.2.4 定量限
如圖7所示,采用優化方案后在稱樣量為1 g定容25 mL時,信噪比為8.7,檢出限為4 mg/100 g,定量限為12 mg/100 g。
2.2.5 加標回收結果
采用優化方案進行6次加標回收試驗,結果見表4,回收率為95.6%~100%(RSD<2.31%),說明方法重復性良好,回收率穩定。

表4 加標回收率結果表
3 結論
本實驗探究了影響CPP特征峰定量的原料,且通過對前處理步驟中沉淀去除蛋白質雜質的方法進行優化,發現采用乙酸調節pH后,過IC-RP柱凈化,能夠有效去除水解蛋白對CPP檢測的干擾;經過優化后的前處理方法準確度高,精密度好,在20~200 μg·mL-1線性關系良好,平均回收率為97.1%;優化后的方法去除了由水解蛋白引起的定量誤差,準確度更高。

