加減半夏瀉心湯治療幽門螺桿菌相關性胃炎的作用機制*
劉令令,段飛,杜巧婷,崔晨輝
1.河南中醫藥大學,河南 鄭州 450046;2.河南中醫藥大學第一附屬醫院,河南 鄭州 450000
幽門螺桿菌是一種單極、多鞭毛、末端鈍圓、螺旋線彎曲,定植于胃黏膜上皮細胞的一種需氧的革蘭陰性桿菌[1],被世界衛生組織列為第一類致癌因子[2]。幽門螺桿菌在全世界各地感染率高達50%[3],傳播方式多樣且傳染力強[4]。幽門螺桿菌感染與多種消化系統疾病的發生關系密切,如幽門螺桿菌陽性可導致消化性潰瘍、慢性胃炎、胃癌等[5-6]。因此,幽門螺桿菌感染是影響消化系統健康狀況的主要誘因。慢性胃炎是由各種病因引起的胃黏膜慢性炎癥,其中由幽門螺桿菌感染引起的慢性胃炎稱為幽門螺桿菌相關性胃炎,幽門螺桿菌的感染是該病發生的主要誘因[7]。目前,臨床上幽門螺桿菌相關性胃炎的治療主要采用抗生素,療效確切,但是依賴抗生素會使得病菌耐藥性增強,用藥療效下降[8]。
中醫藥治療幽門螺桿菌感染有獨特的優勢[9]。幽門螺桿菌感染相關性胃炎屬中醫“胃脘痛”“痞滿”范疇[10]。其是由脾胃損傷,脾氣虛,脾不健運,濕阻中焦,脾失升清,胃失和降,濕邪郁久化生為熱所致,病機主要為虛實相存、寒熱錯雜、升降失調,致心下痞滿、嘔吐、脘痛、反酸等[11]。因此,中醫治療應以調暢氣機、平寒調熱、清熱和胃、降逆止嘔、消痞散結為主要治則[12]。有研究報道,加減半夏瀉心湯治療幽門螺桿菌相關性胃炎作用顯著[13]。
中藥具有多成分、多靶點、多途徑的復雜作用特征[14]。這種復雜性使得中藥藥效物質基礎不明確、作用機制不清楚,在臨床用藥以及在新藥的開發方面帶來了許多的局限性。而網絡藥理學是基于系統生物學的理論,從整體的角度探究藥物與疾病之間的關聯,在一定程度上解決了單靶點機制通路難以解釋中藥多成分、多靶點協同作用的問題,使中藥藥物研發具有可預測性[15],為中醫從經驗醫學轉化為循證醫學提供新的范例[16]。因此,本研究根據世界中醫藥學會聯合會發布的《網絡藥理學評價方法指南》[17],采用網絡藥理學方法對加減半夏瀉心湯治療幽門螺桿菌相關性胃炎的作用進行分析,預測其潛在作用機制。
1 資料與方法
1.1 數據庫與軟件運用的數據庫和軟件詳見表1。

表1 運用的數據庫和軟件
1.2 加減半夏瀉心湯化合物與靶標獲取運用中藥系統藥理學數據庫和分析平臺(traditional Chinese medicine systems pharmacology,TCMSP)獲取中藥相應的化合物。以口服利用度(oral bioavailability,OB)≥30%,類藥性(drug likeness,DL)≥0.18,半衰期(half-life,HL)≥4 h為條件進行化合物篩選。并運用TCMSP查找篩選所得化合物對應的靶標信息,將所得靶標信息中的PubChem CId搜索到Canonical SMILES,之后進入Swiss Target Prediction將靶點的“相關靶點(Related targets)”統一轉化成基因名。
1.3 幽門螺桿菌相關性胃炎基因獲取以“Helicobacter Pylori-Associated Gastritis”為關鍵詞從Gene Cards數據庫和疾病-基因組合DisGeNET 數據庫,搜索已發表過的與幽門螺桿菌相關性胃炎有關的基因,刪除重復基因和假陽性基因,與加減半夏瀉心湯中藥復方藥物基因進行匹配,搜集兩數據的交集。
1.4 構建“疾病-中藥-化合物-交集靶標(基因)”網絡將中藥復方藥物有效成分、有效成分所對應的靶點以及幽門螺桿菌相關性胃炎疾病對應的靶點輸入Cytoscape 3.7.2軟件,構建“藥物-成分-疾病-靶點”網絡圖。在網絡圖中,節點(node)代表藥物以及其有效活性成分、疾病、靶點等;邊(edge)分別代表藥物與活性成分、活性成分與活性成分作用靶點、疾病與活性成分作用靶點等之間的相互關系;節點的度值(degree)代表網絡中節點與節點相連的數目,度值越大,越有可能成為化合物的關鍵作用靶點。
1.5 蛋白互作網絡(protein interaction,PPI)構建將加減半夏瀉心湯-幽門螺桿菌相關性胃炎共同作用靶點的基因導入STRING數據庫,獲取蛋白相互作用關系,分值越高說明蛋白相互作用置信度越高,數據可靠性越高,因此設置分值>0.9,篩選高置信度數據,將結果以TSV格式導出。將所得數據導入Cytoscape 3.7.2軟件進行可視化,繪制PPI圖。
1.6 GO富集以及KEGG通路富集分析將關鍵靶點基因輸入DAVID數據庫功能注釋工具中Version 6.8,對加減半夏瀉心湯作用靶點進行GO富集分析選擇生物過程(biological process,BP)、分子功能(molecular function,MF)和細胞組成(cellular component,CC)3個模塊以及KEGG通路分析,設定P<0.05以確定關鍵靶點富集通路。采用GraphPad Prism 8.0軟件將圖富集結果繪制BP、MF、CC富集分析圖。借助微生信數據分析和可視化在線平臺進行數據可視化處理,制成KEGG富集分析圖,以闡釋加減半夏瀉心湯治療幽門螺桿菌相關性胃炎的生物功能及相關信號通路。
1.7 分子對接選取“有效成分-靶點”拓撲分析所得度值較高的前10種成分,在 TCMSP數據庫中下載其3D結構,保存pbd格式。在拓撲性質排名靠前的靶蛋白中挑選4個靶蛋白基因,并從PDB數據庫中下載核心靶點蛋白質結構,保存pbd格式,利用Autodock Tools 1.5.6軟件刪除水分子、加氫及加電荷,保存為pdbqt格式,同樣利用Autodock Tools 1.5.6軟件進行分子對接。將靶蛋白中的原配體抽離后與靶點對接,最后用PyMol 2.4軟件實現對接結果可視化,建立對接相互作用模式圖。
2 結果
2.1 加減半夏瀉心湯治療幽門螺桿菌相關性胃炎主要成分分析檢索TCMSP,輸入“半夏、黃連、黃芩、黃柏、大黃、延胡索、干姜、人參、甘草、大棗”,得到1 367個活性成分及相關信息,再以OB≥30%、DL≥0.18、HL≥4 h作為篩選條件,最終篩選出255個活性成分,見表2。
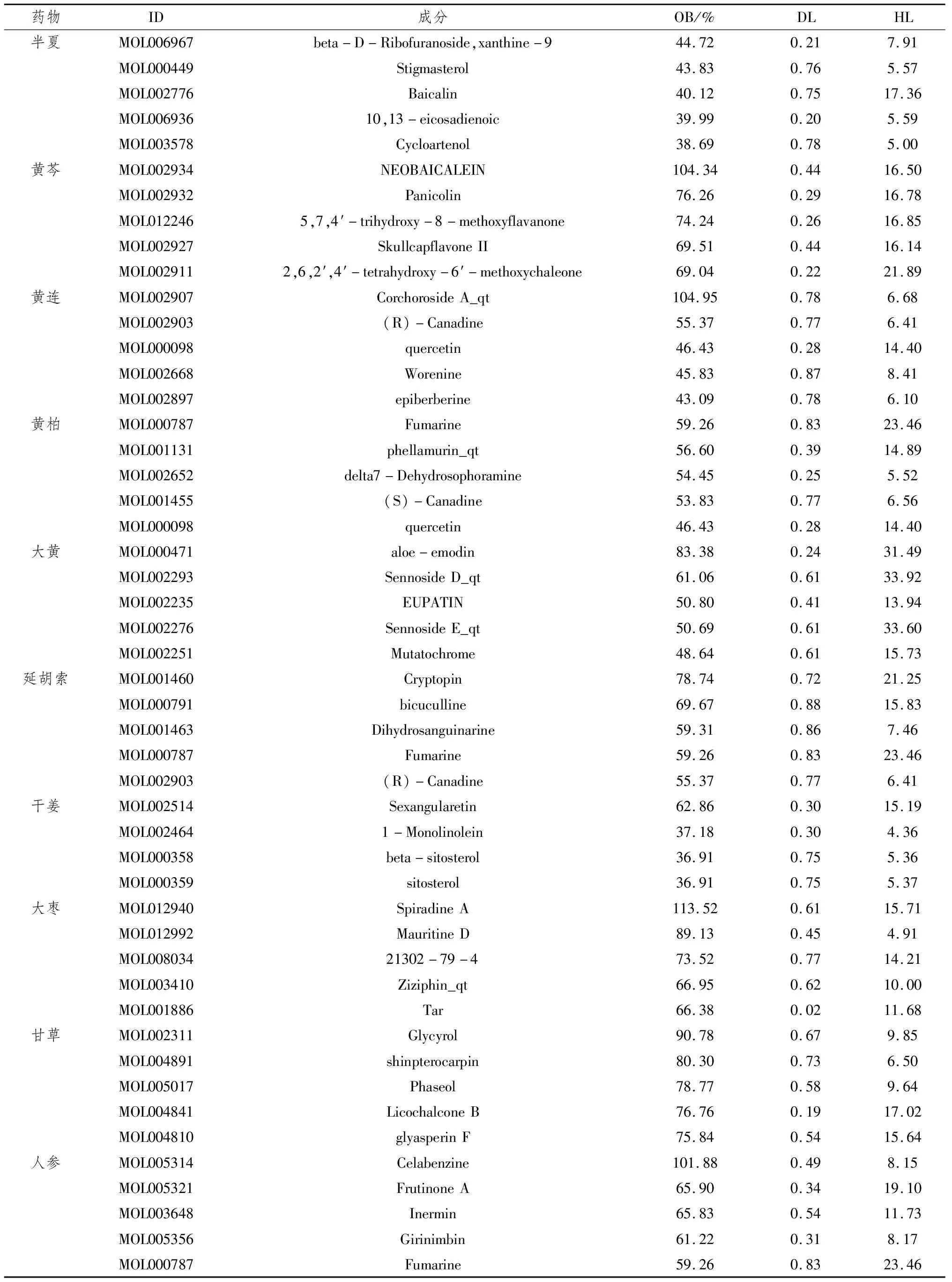
表2 加減半夏瀉心湯藥物活性成分
2.2 加減半夏瀉心湯-幽門螺桿菌相關性胃炎共同靶點的篩選在Gene Cards 數據庫中以“Helicobacter Pylori-Associated Gastritis”為關鍵詞進行搜索,發現871個潛在作用靶點的基因。在韋恩圖在線繪制平臺中分別錄入加減半夏瀉心湯藥物成分的344個靶點對應的基因與幽門螺桿菌相關性胃炎的871個基因,繪制韋恩圖,兩者取交集后獲得藥物-疾病共同靶點94個,見圖1。

圖1 加減半夏瀉心湯與幽門螺桿菌相關性胃炎交集靶點韋恩圖
2.3 構建“藥物-成分-疾病-靶點”網絡使用Cytoscape 3.7.2軟件構建加減半夏瀉心湯治療幽門螺桿菌相關性胃炎作用靶點網絡圖,見圖2。其中共有322個節點,103 362條邊,每條邊代表活性成分與治療幽門螺桿菌相關性胃炎靶點的相互作用。綠色表示幽門螺桿菌相關性胃炎,藍色表示藥物,橘色表示加減半夏瀉心湯藥物所含活性成分,紫色表示這些活性成分對應的治療幽門螺桿菌相關性胃炎作用的相關靶點。并根據Degree值進行分析,度值越高,說明其在網絡中越重要。結果顯示,槲皮素(quercetin)、漢黃芩素(wogonin)、β-谷甾醇(beta-sitosterol)、蘆薈大黃素(aloe-emodin)、豆甾醇(Stigmasterol)、黃芩素(baicalein)在網絡中排名較高,可認為是加減半夏瀉心湯治療幽門螺桿菌相關性胃炎的主要活性成分。

圖2 加減半夏瀉心湯與幽門螺桿菌相關性胃炎的“藥物-成分-疾病-靶點”網絡
2.4 構建PPI將加減半夏瀉心湯藥物成分對應的靶點基因與疾病對應的靶點基因所得的交集基因輸入STRING數據分析平臺,進行蛋白互相作用分析后,下載其關系表格后,根據關聯分數(combined score)≥0.9進行篩選,再運用Cytoscape 3.7.2軟件繪制PPI,見圖3。網絡圖中包含 77個節點,圖中圓形節點代表一個基因蛋白,邊代表連接著的兩個蛋白有相互作用關系。然后按照度值的多少,得到互作關系排名前4的蛋白為腫瘤壞死因子(tumor necrosis factor,TNF)、JUN、絲裂原活化蛋白激酶1(mitogen activated protein kinases 1,MAPK1)、MAPK14,見表3。

表3 加減半夏瀉心湯與幽門螺桿菌相關性胃炎的關鍵靶點及其拓撲性質
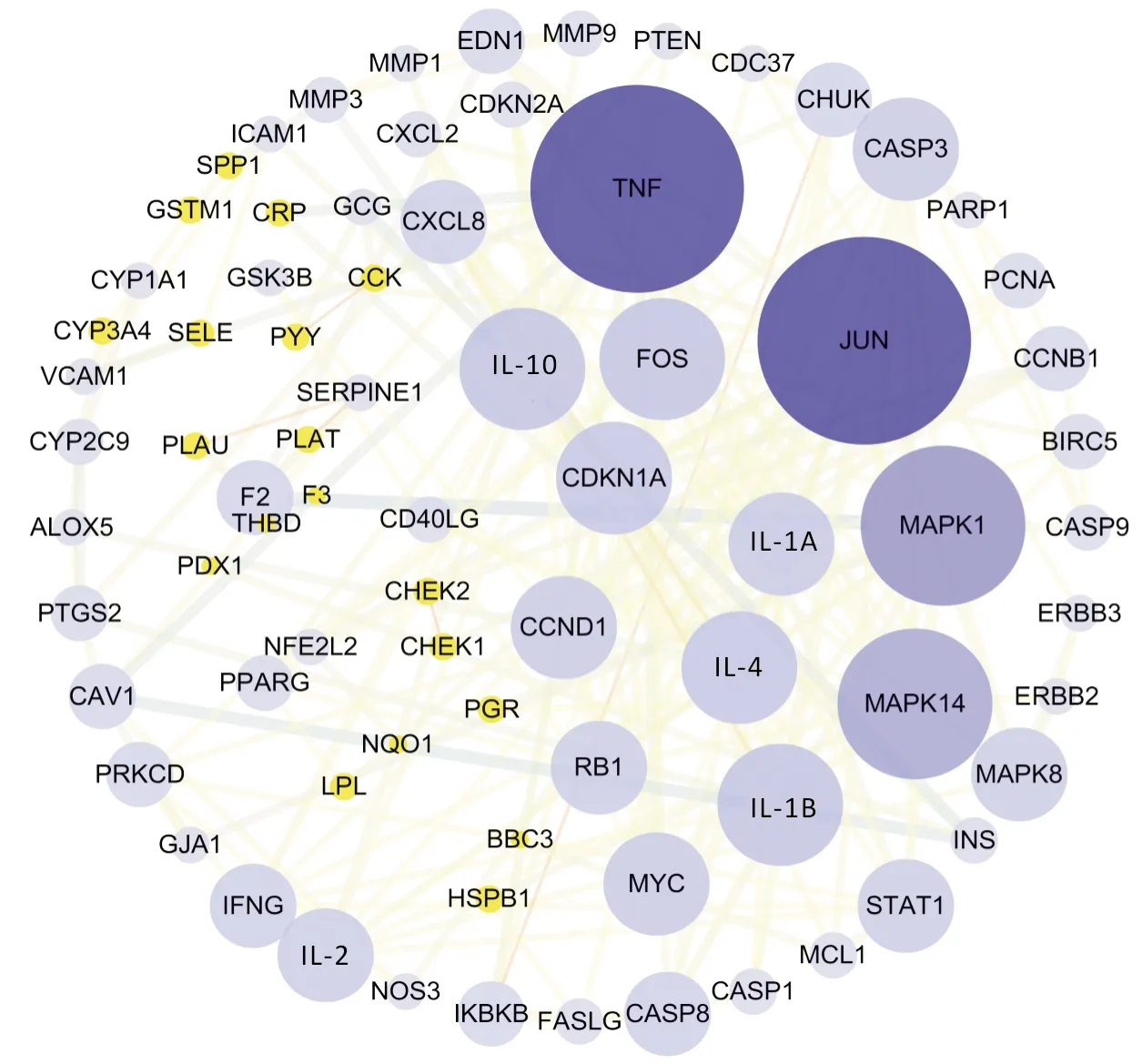
圖3 蛋白-蛋白相互作用網絡
2.5 GO富集分析及KEGG通路富集分析把得到的47個共同靶點導入DAVID數據庫進行GO生物功能注釋,獲得GO條目482個(P<0.05),分別包括生物過程(BP)383個,分子功能(MF)59個,細胞組成(CC)40個;其中生物過程包括對藥物反應(response to drug)、對脂多糖的反應(response to lipopolysaccharide)、基因表達的正向調節(positive regulation of gene expression)、炎癥反應(inflammatory response)等,分子功能主要包括蛋白質結合(protein binding)、絲氨酸型內肽酶活性(serine-type endopeptidase activity)、細胞因子活性(cytokine activity)、蛋白激酶活性(protein kinase activity)等,細胞組成主要包含細胞外液(extracellular space)、線粒體(mitochondrion)、基底外側質膜(basolateral plasma membrane)、核質(nucleoplasm)等。根據Count值選取各自排名前10的條目繪制條形圖,見圖4。

圖4 加減半夏瀉心湯藥物活性成分作用幽門螺桿菌相關性胃炎靶點的GO富集分析
KEGG通路富集分析共富集101個條目(P<0.05),篩選排名靠前20的條目進行可視化分析,繪制氣泡圖,見圖5。主要包括TNF信號通路(signaling pathway)、P53信號通路(p53 signaling pathway)、T細胞受體信號通路(T cell receptor signaling pathway)、FoxO信號通路(Foxo signaling pathway)、Nf-kappa B信號通路(NF-kappa B signaling pathway)、PI3k-Akt信號通路(PI3K-Akt signaling pathway)等。

圖5 加減半夏瀉心湯藥物活性成分作用幽門螺桿菌相關性胃炎靶點的KEGG通路富集分析
2.6 分子對接結果與分析將“藥物-成分-疾病-靶點”網絡中的10個化合物與靶蛋白基因進行對接,DockThor在線對接結果具體信息見表4。當結合能小于0時,蛋白和小分子便可以自發地進行結合。分子對接結果表明,經TCMSP數據庫篩選得到的10個化合物與靶蛋白結合的結合能都遠小于0,可能是治療幽門螺桿菌相關性胃炎疾病的主要作用成分。選取與關鍵靶點結合能較好的化合物用Autodock Tools 1.5.6軟件進行分析,然后將化合物與關鍵靶點的相互作用模式用PyMol 2.4軟件進行展示,見圖6。

表4 10個主要化學成分與靶蛋白的結合能

圖6 加減半夏瀉心湯主要活性成分與關鍵靶點的分子對接圖
3 討論
中醫藥治療疾病機制復雜,網絡藥理學能夠從整體上系統研究中藥成分靶點與疾病靶點之間的作用關系,初步探討中藥復方治療疾病的內在機制[12]。為了進一步闡明加減半夏瀉心湯在幽門螺桿菌相關性胃炎中的藥效基礎與作用機制,本研究運用網絡藥理學的方法進行探討,以期為進一步實驗研究和臨床應用提供參考。
通過TCMSP數據庫進行加減半夏瀉心湯成分的篩選及預測靶點,并與幽門螺桿菌相關性胃炎靶點進行映射,發現94個共同靶點共對應255個主要活性成分,其中槲皮素(quercetin)、漢黃芩素(wogonin)、β-谷甾醇(beta-sitosterol)、蘆薈大黃素(aloe-emodin)、豆甾醇(stigmasterol)、黃芩素(baicalein)在網絡中排名較高,且這3種成分均為黃酮類化合物,可能是加減半夏瀉心湯發揮治療作用的主要成分。黃連、甘草和大棗中均含有槲皮素。研究表明,槲皮素具有廣泛的抗炎、抗腫瘤、保護神經系統等作用[21]。黃芩的主要活性成分中漢黃芩素、黃芩素等均為黃酮類化合物,具有抗炎、抗氧化等多種藥理作用[22]。目前,針對黃芩抗炎機制的網絡藥理學研究表明,其抗炎作用的發揮依賴于減少促炎細胞因子的產生以及減少其與特異性受體結合、抑制啟動炎癥反應的關鍵蛋白的表達[23]。同時,漢黃芩素對胃癌細胞的增殖具有抑制作用,可誘導其凋亡并抑制其遷移和侵襲。研究表明,其作用機制可能與抑制Wnt/β-catenin通路激活有關,從而抑制胃癌SGC-7901細胞的增殖,并誘導其凋亡[24]。黃芩素能夠通過干擾花生四烯酸的代謝通路、抑制細胞因子的活性產生抗炎效用[25]。蘆薈大黃素具有抗炎作用,對真菌、細菌、病毒有明顯的抑制作用[26]。β-谷甾醇通過誘導人胃癌SGC-7901凋亡從而抑制細胞生長[27],并且通過介導AMPK、PTEN、Hsp90等途徑在體內體外抑制人胃癌AGS細胞的生長[28]。研究證明,豆甾醇通過增加過氧化氫酶、超氧化物歧化酶、谷胱甘肽的活性發揮抗氧化作用,抑制環氧化酶-2、誘生型一氧化氮合酶的表達發揮抗炎作用[29]。
加減半夏瀉心湯治療幽門螺桿菌相關性胃炎共有94個共同靶點,進行拓撲分析后共篩選出核心靶點22個,排名靠前的是TNF、JUN、MAPK1、MAPK14、IL-10等。這些靶點主要與炎癥、氧化應激、新生血管生成及免疫相關。TNF是具有介導炎癥反應、參與免疫及內分泌調節等廣泛生物學作用的細胞因子[30]。研究證明,TNF-α表達與幽門螺桿菌感染和疾病嚴重程度密切相關,TNF-α表達水平在幽門螺桿菌相關性胃炎進展至胃癌過程中逐漸升高[31]。MAPK1、MAPK14屬于絲裂原活化蛋白激酶家族,主要參與細胞生長、分化、應激、炎癥反應等多種細胞活動。其介導的信號通路在幽門螺桿菌相關性胃炎發生發展過程中發揮著重要作用[32-33]。MAPK1參與多細胞生理活動[34],同時MAPK14在正常的免疫和炎癥反應中非常重要[35]。MAPK14(p38α)的激活是一種氧化和觸發黏附蛋白的調節器[36],主要存在于細胞質中,可通過磷酸化激活MAPKAP2來增強炎性因子的表達和分泌。幽門螺桿菌感染胃上皮細胞后可激活多條MAPK信號轉導途徑,其中包括ERK1/2、JNK以及p38 MAPK,誘導TNF-α、IL-8、IL-1β和IL-17等炎性因子分泌[37-38]。因此,MAPK抑制劑可顯著抑制幽門螺桿菌感染觸發的炎性因子的產生。JUN由c-Fos和c-JUN組成,可介導炎癥反應[39]。同時JUN的顯性突變體減弱了各種人類腫瘤細胞系的生長行為,它們也干擾了與Ras通路相關的癌基因的轉化[40]。IL-10是一種具有抗炎特性的細胞因子,通過限制對病原體的免疫反應,從而防止對宿主的損害,在感染中起著核心作用[41]。
對加減半夏瀉心湯治療幽門螺旋桿菌相關性胃炎共有靶點進行GO功能富集分析發現,其作用機制主要與基因表達的正向調節、炎癥反應等生物學過程,酶結合、蛋白質結合、細胞因子活性等分子功能,胞質溶膠、細胞外間質、細胞外液等細胞組成有關。KEGG富集分析之中,主要涉及T細胞受體信號通路、Toll樣受體信號通路、FoxO信號通路、NF-κB 信號通路、PI3k-Akt信號通路、HIF-1信號通路等。T細胞受體是由6種不同的多肽形成的蛋白質復合物,通過復合物之間的相互平衡,確保了T細胞對各種抗原刺激的有效反應,同時防止自身免疫[42]。Toll樣受體在自身免疫性疾病的發病機制中起著重要作用。Toll的異常激活可能導致不受限制的炎癥反應。因此,Toll家族可能在自身免疫性疾病的發展中發揮關鍵作用[43]。Foxo信號通路為多信號通路交匯作用通路,Foxo轉錄因子廣泛存在于真核生物中,上游信號通路,如PI3K/AKT信號通路[44]、MAPK信號通路[45]均能通過激活Foxo轉錄因子啟動下游靶點基因轉錄,在細胞周期調控以及細胞凋亡中起著重要作用。核因子-κB通路長期以來一直被認為是一種典型的促炎信號通路,當核因子-κB活化后,可激活下游細胞因子,如TNF-α、IL-1、IL-6等調節免疫或產生炎癥反應[46]。PI3K/Akt 信號通路是生物體中重要的信號傳導途徑,HIF-1 轉錄因子是一種由HIF-1α和一個穩定的組成性表達的HIF-1β組成的異源二聚體。HIF-1 亞基屬于堿性-螺旋-環-螺旋和PER的蛋白家族-ARNT-SIM含結構域的轉錄因子[47]。HIF-1是一種在機體缺氧條件下轉錄的活性核蛋白,與炎癥、血管舒張、血管生成和造血功能密切相關[48]。
DockThor在線分子對接結果中發現,根據結合能的數值推出,10種主要活性成分(槲皮素、山柰酚、漢黃芩素、豆甾醇、β-谷固醇、黃芩素、蘆薈大黃素、刺芒柄花素、異鼠李素)均能與TNF、JUN、MAPK1、MAPK14蛋白基因結合并形成氫鍵(以TNF and wogonin、MAPK1 and aloe-emodin、JUN and beta-sitosterol、MAPK14 and baicalein的分子對接可視化為例,說明這10種活性成分有潛在的成藥性,能發揮治療幽門螺桿菌相關性胃炎作用,但也需要進一步的藥效學研究。
綜上所述,本研究通過網絡藥理學的方法對加減半夏瀉心湯治療幽門螺桿菌相關性胃炎作用機制進行了初步探討,為進一步的實驗研究奠定了基礎。

