脂多糖對Raw264.7巨噬細胞線粒體功能的作用效應
鄧威,陳倩,郭金,張璐懿,龔作炯
脂多糖(lipopolysaccharide,LPS)是革蘭陰性細菌外膜的組成部分,同時也是刺激機體產生免疫反應的重要微生物觸發因子[1]。LPS可以激活巨噬細胞以促進多種炎性因子如腫瘤壞死因子-α、干擾素-γ及IL-6等的增加,還可導致內毒素血癥,如腸源性內毒素血癥[2]。巨噬細胞是一種功能異質性的細胞群,主要受各種微環境刺激形成不同的細胞群[3],在宿主防御病原性感染和宿主炎性反應中發揮重要作用。LPS可誘導巨噬細胞(M1型)的經典激活,體外實驗中炎性細胞模型的建立常采用LPS誘導Raw264.7巨噬細胞,激活的巨噬細胞需要細胞內代謝的重新編程來實現適當的極化和功能[4]。而LPS不僅可刺激Raw264.7巨噬細胞產生多種炎性物質,而且對細胞自身的能量代謝與重新編程等相關方面也會產生一定影響,但目前對此方向研究較少。本實驗主要研究脂多糖對Raw264.7巨噬細胞氧化磷酸化過程中重要線粒體呼吸鏈復合體Ⅰ~Ⅲ、三羧酸循環過程中關鍵酶異檸檬酸脫氫酶(isocitrate dehydrogenase, IDH1)的活性及含量變化和細胞內乳酸含量的影響,報道如下。
1 材料與方法
1.1 材料 (1)研究對象:小鼠Raw264.7巨噬細胞購自中國典型培養物保藏中心。(2)試藥試劑:脂多糖(LPS)購自美國 Sigma-Aldrich 公司;線粒體呼吸鏈復合體Ⅰ~Ⅲ活性檢測試劑盒購自北京索萊寶科技有限公司。小鼠異檸檬酸脫氫酶酶聯免疫吸附測定試劑盒購自上海江萊生物科技有限公司。乳酸檢測試劑盒購自南京建成生物工程研究所。抗-IDH1抗體和GAPDH抗體購自武漢三鷹公司。BCA蛋白定量試劑盒購自武漢碧云天公司。DMEM高糖培養基購自美國Hyclone公司;胎牛血清購自杭州四季青公司。胰酶購自合肥Biosharp公司。(3)儀器設備:酶標儀(美國Perkin Elmer公司,型號EnSight); CO2恒溫培養箱(美國Thermo公司,型號HERAcell 150i);離心機(德國Thermo公司,型號Heraeus Fresco 21);顯微鏡(日本Olympus公司,型號BX51); 超聲碎膜儀(美國Fisher Scientific公司,型號Model 120)。
1.2 實驗方法 本實驗于2020年9月—2021年2月在武漢大學第一臨床學院中心實驗室進行。
1.2.1 細胞培養:取小鼠Raw264.7巨噬細胞離心,去掉細胞凍存液后加入DMEM完全培養基(含10%胎牛血清,1%鏈霉素—青霉素),于37 ℃、5% CO2恒溫培養箱中,適當濕度環境中培養。顯微鏡下觀察細胞貼壁及生長情況,待細胞生長至對數生長期用于進一步實驗。
1.2.2 細胞造模:將培養的Raw264.7巨噬細胞均勻種植于細胞大皿中,隨機分為4組:空白對照組、高劑量LPS組、中劑量LPS組及低劑量LPS組。進行細胞計數,待細胞長至約5×106個/皿密度時。空白對照組細胞進行更換細胞培養液,不加任何其他藥物處理。高劑量、中劑量和低劑量LPS組分別更換為含10 μg/ml、5 μg/ml 及1 μg/ml LPS細胞培養液。細胞培養箱內孵育24 h后待測 。
1.3 觀測指標與方法
1.3.1 線粒體呼吸鏈復合體Ⅰ~Ⅲ活性檢測:以分光光度法檢測Raw264.7細胞內線粒體呼吸鏈復合體Ⅰ~Ⅲ活性。按照對應操作說明書提取對應的Raw264.7細胞內線粒體呼吸鏈復合體后,分別于340 nm、605 nm和550 nm波長處讀取對應的吸光度(OD)值,具體按照說明書公式進一步計算各組Raw264.7細胞內線粒體呼吸鏈復合體Ⅰ~Ⅲ活性。進一步控制實驗變量,同時按照BCA蛋白含量檢測試劑盒說明書檢測對應的蛋白濃度。
1.3.2 異檸檬酸脫氫酶活性檢測:采用雙抗體一步夾心法酶聯免疫吸附試驗(ELISA)檢測。各組Raw264.7細胞經過胰酶消化后,轉移至1.5 ml EP管內,去掉上清液,然后每組細胞加入PBS 200 μl,再經超聲碎膜儀破膜后進行檢測。向預先包被小鼠異檸檬酸脫氫酶捕獲抗體的包被微孔中,依次加入標本、標準品、HRP 標記的檢測抗體,經過溫育并徹底洗滌。用底物 TMB 顯色,四甲基聯苯胺(TMB )在過氧化物酶的催化下轉化成藍色,并在酸的作用下轉化成最終的黃色。顏色的深淺與樣品中的小鼠IDH1呈正相關。用酶標儀在450 nm 波長下測定OD 值,計算樣品濃度。
1.3.3 異檸檬酸脫氫酶蛋白檢測: 采用蛋白免疫印跡法檢測。 將各組Raw264.7細胞胰酶消化后置于4 ml EP管內,使用超聲碎膜儀進行處理后,提取總蛋白,BCA 法測定蛋白含量。每組所提取蛋白上樣量為每孔10 μg,電泳后進行轉膜,5%脫脂奶粉進行封閉1 h;加入一抗4℃搖床過夜,TBST進行洗膜,二抗室溫下避光孵育1 h,洗膜后使用Odyssey系統掃描分析。檢測每組細胞IDH1蛋白表達含量。
1.3.4 免疫熒光法檢測胞質內IDH1表達含量:各組Raw264.7細胞經過造模處理后,用細胞固定液固定25 min, 固定后用PBS清洗3次。0.2%Triton透化20 min后,0.5%BSA封閉30 min。IDH1一抗孵育過夜。次日,二抗孵育1 h,DAPI染核3 min, PBS清洗5次,滴加抗熒光猝滅劑后封片,再于熒光顯微鏡下觀察。
1.3.5 乳酸含量檢測:各組Raw264.7細胞經過胰酶消化后,轉移至1.5 ml EP管內,去掉上清液,然后每組細胞加入200 μl PBS,再經超聲碎膜儀破膜后進行檢測。以NAD+為氫受體,LDH催化乳酸脫氫產生丙酮酸,使NAD+轉化成NADH。PMS遞氫使NBT還原為紫色呈色物,呈色物的吸光度在530 nm時與乳酸含量呈線性關系。具體實驗步驟參照南京建成乳酸測試盒說明書。
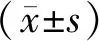
2 結 果
2.1 各組線粒體呼吸鏈復合體Ⅰ~Ⅲ活性比較 Raw264.7細胞內呼吸鏈復合體Ⅰ~Ⅲ活性空白對照組>低劑量LPS組>中劑量LPS組>高劑量LPS組 (F=139.363、95.123、86.795,P均<0.01),見圖1。

注: 與空白對照組比較 ,aP<0.01; 與低劑量LPS組比較,bP<0.01;與中劑量LPS組比較,cP< 0.01
2.2 各組Raw264.7細胞IDH1活性比較 Raw264.7細胞IDH1活性空白對照組、低劑量LPS組、中劑量LPS組、高劑量LPS組分別為32.95±1.35、26.56±0.92、22.61±1.12、16.89±0.79,依次降低,各組間比較差異有統計學意義(F=240.796,P<0.001)。
2.3 各組Raw264.7細胞內IDH1蛋白含量比較
Raw264.7細胞內IDH1蛋白含量空白對照組、低劑量LPS組、中劑量LPS組、高劑量LPS組分別為0.84±0.03、0.52±0.02、0.33±0.02、0.19±0.02,依次降低,各組間比較差異有統計學意義(F=624.261,P<0.001),見圖2。

圖2 各組Raw264.7細胞內IDH1蛋白電泳圖
2.4 各組胞質內IDH1免疫熒光比較 Raw264.7胞質內IDH1相對熒光值空白對照組、低劑量LPS組、中劑量LPS組、高劑量LPS組分別為1.00±0.00、0.82±0.04、0.56±0.02、0.32±0.05,依次降低,各組間比較差異有統計學意義(F=278.540,P<0.001),見圖3(紅色部分為IDH1表達),見圖3。
2.5 各組細胞內乳酸含量比較 Raw264.7細胞內乳酸含量空白對照組、低劑量LPS組、中劑量LPS組、高劑量LPS組分別為0.35±0.11、0.73±0.09、0.91±0.13、1.18±0.13,依次升高,各組間比較差異有統計學意義(F=55.987,P<0.001)。
3 討 論
巨噬細胞在各種炎性疾病如敗血癥、急性肝衰竭及多種慢性疾病等的發生發展過程中扮演著重要角色。此外,巨噬細胞是人體重要的天然性免疫細胞,廣泛存在于人體各個組織和器官,正常情況下其處于靜息狀態。而在感染、內毒素(如LPS)等致炎因素刺激下,巨噬細胞可發生M1型極化,并釋放多種致炎因子介導炎性反應來對抗感染從而保護機體,然而革蘭陰性菌引起的內毒素血癥會使過度激活的巨噬細胞分泌大量炎性因子,可能會造成組織器官的功能衰竭[5]。LPS可刺激巨噬細胞產生多種炎性物質,涉及的調控通路主要以TLR4通路及MAPK通路為主[6-7]。不同劑量LPS對機體影響不同,將大劑量LPS靜脈注射到動物模型體內,是常用的膿毒血癥造模方法,且研究指出這種造模方式呈現一種劑量依賴性死亡方式[8]。

圖3 各組Raw264.7細胞內IDH1免疫熒光檢查表現 (山羊抗兔Cy3-IDH1染色,×100)
一方面,LPS會刺激機體產生過度的炎性反應。另一方面,LPS也可改變機體自身免疫細胞的代謝過程。在三羧酸循環過程中,異檸檬酸脫氫酶的主要作用是將異檸檬酸轉化成α-酮戊二酸,而此反應是不可逆的,同時也是三羧酸循環中的限速步驟,并且IDH1利用NADP為輔因子可以生成NADPH[9-10]。氧化磷酸化途徑為呼吸鏈復合體偶聯生成ATP的過程,是機體功能的主要方式,而線粒體呼吸鏈復合體主要參與細胞內氧化磷酸化過程中氫質子和電子的傳遞過程[11]。既往研究發現,LPS可以通過TLR4通路損害免疫細胞線粒體呼吸鏈,抑制三羧酸循環活性[12]。LPS誘導刺激會使巨噬細胞中IDH1受到抑制,并且可能與Ⅰ型自分泌干擾素途徑有關[13]。LPS還可以抑制免疫細胞的氧化磷酸化途徑,但可通過增強糖酵解途徑代償性快速產生ATP及激活巨噬細胞所需的底物,部分補償氧化磷酸化所缺失的能量及激活底物[14]。Michelucci等[15]在細胞實驗中發現,LPS可以使三羧酸循環中異檸檬酸裂解酶與琥珀酸脫氫酶活性下降,從而影響線粒體功能。而在本研究發現,LPS可抑制Raw264.7巨噬細胞的線粒體呼吸鏈復合體Ⅰ~Ⅲ的活性來抑制氧化磷酸化途徑,降低異檸檬酸脫氫酶1的活性和蛋白含量來抑制三羧酸循環活性,且這些改變均與LPS的濃度呈現劑量依賴性。Jha等[16]研究發現,更低濃度的LPS可能并不會導致細胞氧化磷酸化的減少,提示LPS對巨噬細胞的能量代謝與其劑量密切相關。
細胞經過糖酵解后產生乳酸,本研究發現,Raw264.7細胞內乳酸含量在LPS刺激后顯著增加,表明LPS可刺激巨噬細胞的糖酵解發生。Wang等[17]研究發現,巨噬細胞在受LPS刺激向M1型巨噬細胞轉化時,其代謝也向糖酵解方向重新編程。此外,經IDH1途徑生成細胞內NADPH可以起到保護細胞免受LPS誘導氧化應激的生理作用[18]。本實驗中低IDH1活性與含量可能會使其保護作用喪失,而氧化應激也可以促使巨噬細胞線粒體功能受損,使細胞向糖酵解重新編程,與相關研究結果一致[19]。
結合既往及本實驗研究,LPS可改變巨噬細胞自身的代謝情況。細胞在外界刺激下出現的代謝重新編程也是目前研究的熱點問題。巨噬細胞的浸潤與極化后代謝重新編程不僅與敗血癥、肝衰竭等急性疾病有關,還與多種慢性疾病如腫瘤、肥胖、2型糖尿病、動脈粥樣硬化及自身免疫性疾病等的發生相關[20- 21]。因此,對巨噬細胞激活過程中細胞內代謝重新編程的特性及其分子調控網絡的研究,將有助于理解生理和病理情況下細胞代謝與巨噬細胞功能的雙向作用,為巨噬細胞相關疾病的治療提供新的治療靶點。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
鄧威: 設計研究方案,數據獲取,實施研究過程,論文撰寫,論文修改;陳倩、郭金、張璐懿:實施研究過程,分析研究數據,進行統計學分析,補充數據;龔作炯:提出選題及研究方向,論文終審

