miR-181c-5p靶向TRIM71調控非小細胞肺癌細胞A549的凋亡研究
邊紅芝 韓俊壘 胡建平 丁成智
肺癌是癌癥相關死亡率的主要原因,其5年生存率一直很差[1]。盡管監測和臨床治療策略有所改善,但美國的5年總生存率仍約為16%[2]。2012年,全世界有180萬人罹患肺癌,導致160萬人死亡。不幸的是,其總發病率在世界范圍內急劇增加[3]。大多數肺癌臨床病例分為兩種亞型:小細胞肺癌(SCLC)和非小細胞肺癌(NSCLC)[4]。大約70%的新診斷為肺癌亞型的患者在切除后出現局部復發或轉移性病變[5]。毫無疑問,闡明肺癌的發病機理對于有效治療該疾病很重要。MicroRNA(miRNA)是一類短的,內源性的非編碼RNA,可調節基因表達[6]。盡管miRNA僅占表達基因組的一小部分,但已證明它們在各種細胞過程中具有重要作用,包括增殖,凋亡,分化和惡性轉化[7]。據估計,有60%的基因受miRNA調控,miRNA表達的變化會影響生理和病理過程[8]。已有研究發現肺癌組織和正常肺組織的miRNA表達差異極大,并且已經鑒定出一些在肺癌發生和發展中具有關鍵功能的miRNA[9]。然而,仍然有許多miRNA的功能亟待剖析,包括miR-181c-5p。基于此,本研究旨在探討miR-181c-5p調控非小細胞肺癌細胞A549的潛在機制。
1 材料與方法
1.1 材料
HLF-a(人肺細胞)和非小細胞肺癌細胞A549均購自procell(貨號:CL-0359、CL-0016)。miR-181c-5p mimics、miR-181c-5p inhibitor、siRNA均由吉凱基因合成。TRIM71的過表達載體由A549 cDNA擴增片段后連接至PCDNA3.1載體上。RevertAidHMinus第一鏈cDNA合成試劑盒購自北京鼎國昌盛生物技術有限責任公司(貨號:TER016-1)。SYBR Green PCR Master Mix購自廣州一科生物科技有限公司(貨號:RBWG5-10 ml,400T)。pmiR-RB-REPORTTM載體購自銳博生物。RIPA裂解液購自上海碧云天生物技術有限公司(貨號:P0013B)。Lipofectamine 3000購自上海齊正生物科技有限公司(貨號:L3000008)。泛素蛋白酶體抑制劑MG132購自selleck(貨號:S2619)。
1.2 方法
1.2.1 細胞培養與轉染 HLF-a使用MEM培養基(補充有10%胎牛血清和1%雙抗)培養,A549使用DMEM培養基(補充有10%胎牛血清和1%雙抗)培養。miR-181c-5p mimics、miR-181c-5p inhibitor、siRNA和質粒均用Lipofectamine 3000轉染。泛素蛋白酶體抑制劑MG132的使用終濃度為20 μM。
1.2.2 RNA抽取與實時熒光定量PCR 按照制造商的說明,使用Trizol試劑提取總RNA。通過分光光度法定量后,使用1 μg總RNA通過RevertAidHMinus第一鏈cDNA合成試劑盒合成第一鏈cDNA。使用SYBR Green PCR Master Mix在Applied Bio-system 7500儀器上進行實時PCR分析。所有反應均按照以下程序進行:95 ℃ 3 min,在95 ℃下進行42個循環30 s,在60 ℃下進行30 s退火,并在72 ℃下延伸40 s。用2-△△CT法計算靶基因的相對表達。使用U6或GAPDH作為內部對照對CT值進行標準化。特異性引物如下:miR-181c-5p,(正向)5-GGGAACATTCAACCTGTCG-3和(反向)5-GTGCGTGTCGTGGAGTCG-3;U6,(正向)5-GCTTCGGCAGCACATATACTAAAAT-3和(反向)5-CGCTTCACGAATTTGCGTGTCAT-3;GAPDH,(正向)5-GGGAAACTGTGGCGTGAT-3和(反向)5-GAGTGGGTGTCGCTGTTGA-3。
1.2.3 免疫印跡 將腫瘤組織或細胞在冰冷的磷酸鹽緩沖液中沖洗,并在RIPA裂解緩沖液中裂解以收集蛋白質。將樣品以12000 g離心20 min,并通過BCA蛋白質測定試劑盒確定蛋白質濃度。等量的蛋白質在12%SDS-PAGE上電泳,并轉移到PVDF膜上。然后在室溫下用5%脫脂牛奶封閉膜1小時。隨后,將膜與一抗(TRIM71,p53,GAPDH),然后與結合HRP的二抗用于檢測蛋白質-抗體復合物。GAPDH用作對照蛋白以定量相關蛋白的表達。
1.2.4 熒光素酶報告實驗 通過插入TRIM71 mRNA的3-UTR片段來構建pmiR-RB-REPORTTM載體,該片段包含推定的miR-181c-5p結合位點。 作為突變載體,TRIM71的3-UTR片段的種子結合位點發生了突變,從TGAATGT到ACTTACT。為了進行報告基因分析,使用Lipofectamine 3000將100 ng野生型或突變質粒和50 μnM miR-181c-5p mimics或陰性對照轉染293T細胞。轉染后24小時使用Dual-GloTM熒光素酶測定系統測量螢火蟲和海腎熒光素酶的活性。
1.3 統計學分析
本研究應用SPSS 17.0軟件進行統計分析。所有實驗一式兩份進行,并重復至少三遍。組間差異通過t檢驗進行評估,P<0.05被認為具有統計學意義。
2 結果
2.1 miR-181c-5p促進非小細胞肺癌細胞A549的凋亡
miR-181c-5p在非小細胞肺癌細胞A549中的表達水平低于人正常肺細胞HLF-a(P<0.05),見圖1A。轉染miR-181c-5p mimics過表達miR-181c-5p后,發現非小細胞肺癌細胞A549的凋亡上升(P<0.05);轉染miR-181c-5p inhibitor敲低miR-181c-5p后,發現非小細胞肺癌細胞A549的凋亡下降(P<0.05),見圖1B。

圖1 miR-181c-5p促進非小細胞肺癌細胞A549的凋亡
2.2 miR-181c-5p靶向TRIM71
通過miRDB在線分析,發現miR-181c-5p潛在靶向74個基因。基于此,在A549細胞中過表達miR-181c-5p后,通過實時熒光定量PCR發現有15個基因的表達水平被調節了6倍以上(P<0.05),見圖2A。通過siRNA敲低上述15個基因后,發現當敲低TRIM71時,非小細胞肺癌細胞A549的凋亡水平上升(P<0.05),見圖2B。過表達TRIM71后,非小細胞肺癌細胞A549的凋亡水平下降(P<0.05),見圖2C。過表達miR-181c-5p后,TRIM71的蛋白水平下降;而敲低miR-181c-5p后,TRIM71的蛋白水平上升,見圖2E和圖2F。此外,miR-181c-5p靶向TRIM71 mRNA的3端非編碼區(P<0.05),見圖2D。
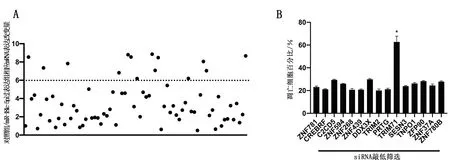
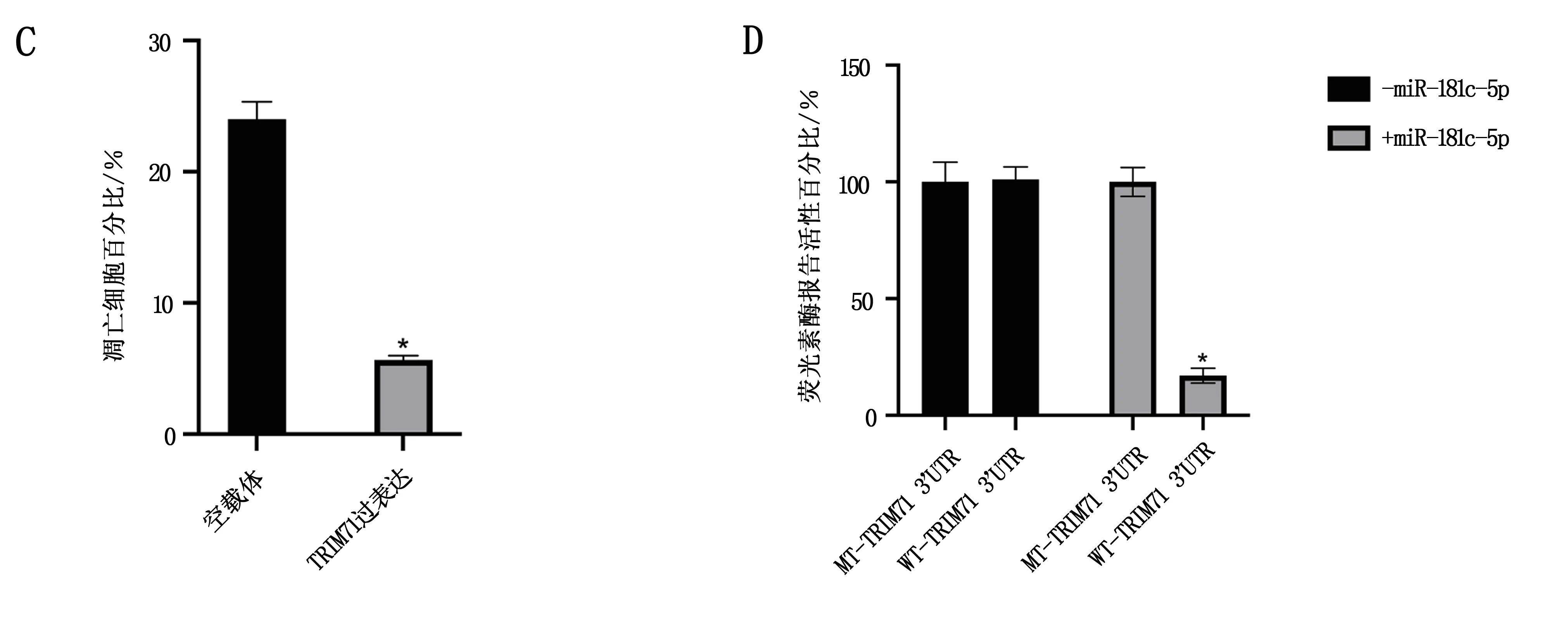

圖2 miR-181c-5p靶向TRIM71
2.3 miR-181c-5p抑制TRIM71泛素化P53
敲低TRIM71后,非小細胞肺癌細胞A549的p53水平上升;而過表達TRIM71后,非小細胞肺癌細胞A549的p53水平下降,見圖3A和圖3B。過表達miR-181c-5p后,非小細胞肺癌細胞A549的p53水平上升;而敲低miR-181c-5p后,非小細胞肺癌細胞A549的p53水平下降,見圖3C和圖3D。泛素蛋白酶體抑制劑MG132處理后,過表達miR-181c-5p后,非小細胞肺癌細胞A549的p53水平沒有明顯變化;敲低miR-181c-5p后,非小細胞肺癌細胞A549的p53水平沒有明顯變化,見圖3E和圖3F。
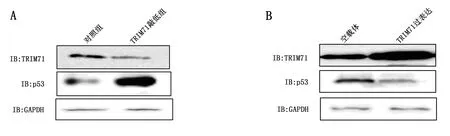
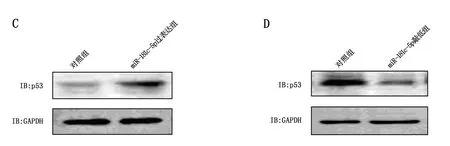
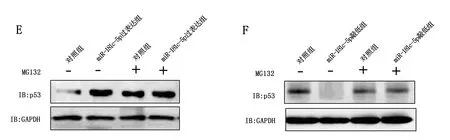
圖3 miR-181c-5p抑制TRIM71泛素化p53
3 討論
肺癌是最常見的惡性腫瘤之一,并且仍然是全球癌癥相關死亡的主要原因[10]。盡管有諸如靶向治療等巨大成就,但是,找到一種徹底治愈肺癌的方法仍然是一個挑戰。腫瘤的發展是一個復雜而復雜的過程,可能會受到環境或個人因素的影響。盡管已經廣泛研究了與腫瘤相關的致癌因素,但促成腫瘤發生的潛在機制仍然難以捉摸。因此,確定此類機制至關重要。
miRNA是一類小的非編碼RNA,參與多個細胞生物學過程,包括上皮到間質轉化、凋亡、增殖、侵襲和轉移[11]。miRNA通過與目標mRNA的3'非翻譯區(UTR)結合來調節轉錄后水平來抑制基因[12]。新興證據表明,可以通過抑制或過表達某些miRNA的水平來在體外或體內調節癌癥的發展[13]。因此,miRNA可能成為有希望的癌癥治療靶點。在本研究中,miR-181c-5p在非小細胞肺癌細胞A549中的表達水平低于人正常肺細胞HLF-a(P<0.05)。過表達miR-181c-5p后,非小細胞肺癌細胞A549的凋亡上升(P<0.05);敲低miR-181c-5p后,非小細胞肺癌細胞A549的凋亡下降(P<0.05)。已有研究表明miR-181c-5p的過表達加劇了缺氧誘導的心肌細胞損傷,并加劇了缺氧誘導的心肌細胞凋亡[14]。本研究并未給予A549細胞缺氧條件,但是miR-181c-5p依舊促進了凋亡,提示miR-181c-5p在腫瘤細胞和心肌細胞中的促凋亡機制并不相同。miR-181家族包含四個miRNA(miR-181a,miR-181b,miR-181c和miR-181d),它們被發現具有高度同源性,并在體內廣泛分布[15]。除了miR-181c-5p,miR-181家族的其他是否也與細胞凋亡相關仍然值得探討。
miRDB在線分析發現miR-181c-5p潛在靶向74個基因。過表達miR-181c-5p后,發現有15個基因的表達水平被調節了6倍以上(P<0.05)。敲低上述15個基因后,發現當敲低TRIM71時,非小細胞肺癌細胞A549的凋亡水平上升(P<0.05)。過表達TRIM71后,非小細胞肺癌細胞A549的凋亡水平下降(P<0.05)。過表達miR-181c-5p后,TRIM71的蛋白水平下降;而敲低miR-181c-5p后,TRIM71的蛋白水平上升。此外,miR-181c-5p靶向TRIM71 mRNA的3端非編碼區(P<0.05)。TRIM71是Trim-NHL蛋白家族的成員[16]。已有研究發現TRIM71能夠通過泛素化降解p53[17]。因此,A549細胞可能存在miR-181c-5p/TRIM71/p53調控軸以促進細胞凋亡。在本研究中,敲低TRIM71后,非小細胞肺癌細胞A549的p53水平上升;而過表達TRIM71后,非小細胞肺癌細胞A549的p53水平下降。過表達miR-181c-5p后,非小細胞肺癌細胞A549的p53水平上升;而敲低miR-181c-5p后,非小細胞肺癌細胞A549的p53水平下降。泛素蛋白酶體抑制劑MG132處理并過表達miR-181c-5p后,非小細胞肺癌細胞A549的p53水平沒有明顯變化;泛素蛋白酶體抑制劑MG132處理并敲低miR-181c-5p后,非小細胞肺癌細胞A549的p53水平沒有明顯變化。由p53誘導的凋亡被牢固地確立為腫瘤抑制的主要機制[18]。除了其作為核轉錄因子的復雜功能外,p53還可以在細胞溶質和線粒體中發揮作用,通過不依賴轉錄的機制促進細胞凋亡。
綜上所述,miR-181c-5p通過靶向TRIM71 mRNA的3端非編碼區后減少了TRIM71的表達水平,隨后凋亡活化基因p53的蛋白水平上升,最后促進了非小細胞肺癌細胞A549的凋亡。

