黑豆種皮花色苷酶法輔助提取工藝優化及其抗氧化活性分析
張寬朝,汪煒姿,余 平,湯雲星,羅會濤,王康威
安徽農業大學生命科學學院,合肥 230036
黑豆,別名烏豆、冬豆子、櫓豆等,是豆科植物大豆Glycinemax(L.) Merr的干燥成熟黑色種子,其環境適應性強,抗旱耐瘠,能在絕大多數地方,甚至是鹽堿地種植[1,2]。黑豆在我國種植面積較廣,且區域性分布相對集中,黑龍江、安徽、山西等地種植較為普遍,資源豐富,類型多樣[1,3]。黑豆是著名的傳統藥食同源農產品,富含不飽和脂肪酸、蛋白質、維生素、多糖、異黃酮等生物活性物質[4,5]。黑豆種皮呈黑紅色或紫紅色,有光澤,薄而脆,易破碎,含有膳食纖維、維生素、色素、多糖、黃酮等多種活性物質[6,7]。黑豆種皮中的花色苷不僅賦予了黑豆的顏色,而且對人體有著多種保健功效,可以抗氧化、潤腸通便、保護肝臟、預防糖尿病、降血糖、降血脂、改善記憶力、保護視力、抗腫瘤、預防和治療哮喘等[8,9]。
花色苷提取技術的逐步改良,為其工業化應用提供了基礎,使其得以廣泛用于新型化妝品、醫療保健、食品、天然染料等行業領域[10]。黑豆種皮花色苷傳統提取方法主要有水提法、有機溶劑提取法等,但這些方法存在著提取時間長、溶劑消耗量大、提取率低、花色苷穩定性差等缺點[11]。近年來,超聲輔助提取[12]、微波輔助提取[13]、離子液體提取[14]等方法因具有提取時間短、提取率更高等特點在黑豆種皮花色苷研究中進行了探索。已有研究發現,生物酶法輔助提取花色苷等生物活性物質具有低能耗、高性價比以及提取產物穩定性及活性高等優勢[15],但生物酶法輔助提取黑豆種皮花色苷的研究尚未見報道。本研究采用生物酶法輔助提取黑豆種皮花色苷,并以花色苷含量為指標,通過響應面法優化花色苷提取工藝,同時體外試驗分析黑豆種皮花色苷提取液的抗氧化活性,以期為黑豆種皮花色苷的提取、綜合開發利用提供理論和技術參考。
1 材料與方法
1.1 材料
1.1.1 樣品
黑豆種皮,購自安徽亳州,批號20191209,粉碎,過100目篩,備用。
1.1.2 試劑
纖維素酶(最適pH4.8、最適溫度50 ℃,上海源葉生物科技有限公司);α-淀粉酶(最適pH6.0、最適溫度60 ℃,上海源葉生物科技有限公司);無水乙醇、ABTS、過硫酸鉀、1,1-二苯基-2-三硝基苯肼、磷酸二氫鈉、磷酸氫二鈉、氯化鈉、鐵氰化鉀、三氯乙酸、氯化鐵、三羥甲基氨基甲烷、鄰苯三酚、抗壞血酸、濃鹽酸、對氨基苯磺酸、鹽酸萘乙二胺、亞硝酸鈉等均為國產分析純。
1.1.3 儀器
722型可見分光光度計(上海光譜儀器有限公司);HH-2型數顯恒溫水浴鍋(常州普天儀器制造有限公司);YP3002型電子天平(上海佑科儀器儀表有限公司);L-600型低速離心機(湖南湘儀實驗室儀器開發有限公司);UV-1600型紫外可見分光光度計(北京瑞利分析儀器公司);FW-100型粉碎機(天津市泰斯特儀器有限公司)。
1.2 方法
1.2.1 黑豆種皮花色苷提取與含量分析
參考Zhao等[16]法進行黑豆種皮花色苷提取與含量測定。
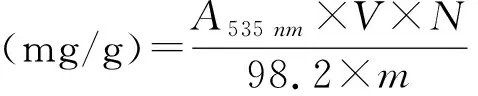
式中,V:定容體積(mL);N:稀釋倍數;98.2:花色苷在535 nm處的平均消光系數;m:黑豆種皮質量(g)。
1.2.2 不同酶解方法對黑豆種皮花色苷提取影響
準確稱取0.30 g黑豆種皮粉末,按照液料比25∶1 mL/g加入體積分數為65%的乙醇,分別加入纖維素酶400 U/g、α-淀粉酶50 U/g、復合酶(纖維素酶400 U/g +α-淀粉酶50 U/g),50 ℃恒溫水浴浸提60 min,4 000 rpm離心10 min,取上清液535 nm處測定吸光度值[16]。以與乙醇等量的純水(不加酶)為空白對照。
1.2.3 單因素試驗
準確稱取0.30 g的黑豆種皮粉末、一定量復合酶,分別考察溫度(30、40、50、60、70 ℃)、液料比(15∶1、20∶1、25∶1、30∶1、35∶1 mL/g)、乙醇體積分數(55%、60%、65%、70%、75%、80%)、酶解時間(20、40、60、80、100 min)對黑豆種皮花色苷生物酶法輔助提取的影響。溫度、液料比、乙醇體積分數、酶解時間四個因素的固定水平分別為50 ℃、25∶1 mL/g、65%、60 min。在對各因素進行單因素試驗時,其他因素及相應水平固定。
1.2.4 響應面試驗優化
根據以上單因素試驗結果,以花色苷含量(Y)為響應值,選擇復合酶酶解,選取液料比(A)、酶解溫度(B)、乙醇體積分數(C)、酶解時間(D)四個因素為自變量,進行響應面分析試驗。響應曲面優化設計因素與水平見表1。

表1 響應曲面優化設計因素與水平
1.2.5 黑豆種皮花色苷抗氧化活性測定
1.2.5.1 黑豆種皮花色苷還原能力分析
參考Hao等[17]方法。吸取不同濃度花色苷提取液各2.5 mL,分別加入2.5 mL pH6.6磷酸鹽緩沖液、2.5 mL 1%K4[Fe(CN)6]溶液,混勻,50 ℃水浴20 min,再加入2.5 mL 10%的三氯乙酸溶液,混勻,300 0 rpm離心10 min,取上清液3 mL加入3 mL純水和0.5 mL 0.1% FeCl3溶液,混勻,700 nm處測定吸光度。以抗壞血酸為對照。
1.2.5.2 黑豆種皮花色苷對超氧陰離子自由基清除能力測定
采用鄰苯三酚法[18]。取4.5 mL 0.05 mol/L Tris-HC1緩沖溶液(pH8.2),加入1 mL不同濃度的花色苷提取液和0.1 mL 6 mmol/L的鄰苯三酚溶液,混勻,暗處反應5 min,在299 nm處測定吸光度Ai,以等體積的純水代替鄰苯三酚,測量吸光度Ai0;以等體積乙醇浸取液代替試樣溶液測得A0。以抗壞血酸為對照。
1.2.5.3 黑豆種皮花色苷對亞硝酸根離子清除能力測定
參考Li等[19]方法。吸取不同濃度花色苷提取液各2 mL,分別與2 mL 5 mg/L NaNO2溶液混合均勻,25 ℃水浴30 min后,加入1 mL 4 g/L對氨基苯磺酸溶液,搖勻,25 ℃水浴5 min后,再加入1mL 2 g/L鹽酸萘乙二胺溶液,搖勻,25 ℃水浴15 min,538 nm處測定吸光度Ax。空白對照液吸光度記為A0,花色苷提取液本底吸光度記為Axo。以抗壞血酸為對照。
1.2.5.4 黑豆種皮花色苷對DPPH自由基清除能力測定
參考Wang等[20]方法。吸取不同濃度花色苷提取液各2 mL,加入2 mL 0.1 mol/L DPPH溶液,搖勻,暗處反應30 min,517 nm處測定吸光度Ai;用2 mL 70%乙醇分別代替DPPH溶液和花色苷試樣液,重復上述操作,分別測定吸光度Aj、A0。以抗壞血酸為對照。
1.2.5.5 黑豆種皮花色苷對ABTS自由基清除能力測定
參考Yan等[21]方法。配制ABTS儲備液:分別配制7 mmol/L ABTS溶液和4.9 mmol/L過硫酸鉀溶液,等體積混合均勻,室溫暗處靜置12~16 h后備用。使用時稀釋至其稀釋液在734 nm處的吸光度為0.7±0.02。
吸取不同濃度花色苷提取液各2 mL,加入4 mL ABTS稀釋溶液,振蕩搖勻,室溫暗處靜置6 min,724 nm處測定吸光值Ai;用浸提體系的乙醇分別代替花色苷試樣液和ABTS稀釋溶液,重復上述操作,測定吸光度A0和Aj。以抗壞血酸為對照。
1.3 數據處理
所有試驗均重復3次。Microsoft Excel 2016繪制圖表,Design Expert 10.0軟件進行響應面優化試驗的設計、多元回歸擬合分析及工藝參數優化,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果與分析
2.1 不同酶解方法對黑豆種皮花色苷提取的影響
不同酶解方法對黑豆種皮花色苷提取的影響如圖1所示。可以看出,α-淀粉酶和纖維素酶對提高黑豆種皮花色苷的提取量都有明顯效果,且纖維素酶的酶解效果略優于α-淀粉酶。復合酶對黑豆種皮花色苷輔助提取的效果最好,可達未加酶條件下的近2倍。因此,本試驗后續選用纖維素酶和α-淀粉酶混合而成的復合酶輔助提取黑豆種皮花色苷,并結合纖維素酶、α-淀粉酶的單一酶解進一步探討具體試驗參數優化。

圖1 不同酶解方法對黑豆種皮花色苷提取的影響Fig.1 Effect of different enzymolysis methods on extraction of anthocyanins from black bean seed coat
2.2 溫度對黑豆種皮花色苷生物酶法輔助提取的影響
溫度對黑豆種皮花色苷生物酶法輔助提取的影響如圖2所示。分析可知,在試驗范圍內,以α-淀粉酶、纖維素酶、復合酶輔助提取黑豆種皮花色苷含量均隨溫度的增加呈先上升后下降的趨勢。這可能是因為溫度太低時酶的催化活性過低,不利于花色苷的溶出。隨著溫度的升高,酶的催化活性逐漸增強,同時細胞膜的通透性也隨之提高,酶輔助花色苷提取的速率加快,花色苷含量上升。當溫度為50 ℃時,三種酶解方法輔助提取的花色苷含量都達到最大,復合酶的輔助提取效果優于α-淀粉酶、纖維素酶,達到2.203 mg/g。隨著溫度的繼續升高,花色苷因不穩定而分解,同時,酶的活性下降甚至失活,花色苷提取含量逐漸降低。

圖2 溫度對黑豆種皮花色苷生物酶法輔助提取的影響Fig.2 Effect of temperature on enzymatic extraction of anthocyanins from black bean seed coat
2.3 液料比對黑豆種皮花色苷生物酶法輔助提取的影響
液料比對黑豆種皮花色苷生物酶法輔助提取的影響如圖3所示。可以看出,在液料比為25∶1 mL/g時,α-淀粉酶、纖維素酶、復合酶輔助提取黑豆種皮花色苷含量達到最大,復合酶輔助提取最高達到2.217 mg/g。其后花色苷提取含量隨液料比的增加而減少,可能由于隨著液料比的增加,提取體系中酶的濃度減小,酶活性降低,酶的輔助提取效能減弱,不利于花色苷溶出[16]。

圖3 液料比對黑豆種皮花色苷生物酶法輔助提取的影響Fig.3 Effect of liquid to material ratio on enzymatic extraction of anthocyanins from black bean seed coat
2.4 乙醇體積分數對黑豆種皮花色苷生物酶法輔助提取的影響
生物酶法輔助提取黑豆種皮花色苷提取含量隨乙醇體積分數的增加呈先上升后下降的趨勢(圖4)。在乙醇體積分數為65%時,花色苷含量均達到最高,復合酶輔助提取的花色苷含量為2.043 mg/g。這可能由于花色苷溶于乙醇,當乙醇體積分數增大時,花色苷溶解速度加快,花色苷含量增加,乙醇體積分數為65%時最大;之后乙醇體積分數繼續增大,α-淀粉酶、纖維素酶的活性受到抑制甚至變性失活,同時,反應體系中的蛋白質、糖類等大分子物質發生凝聚反應,影響花色苷的析出,導致花色苷含量下降。
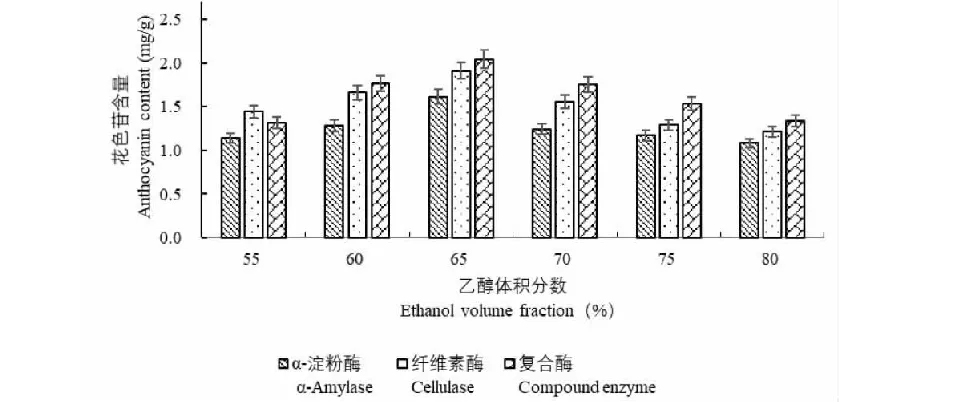
圖4 乙醇體積分數對黑豆種皮花色苷生物酶法輔助提取的影響Fig.4 Effect of ethanol volume fraction on enzymatic extraction of anthocyanins from black bean seed coat
2.5 酶解時間對黑豆種皮花色苷生物酶法輔助提取影響
酶解時間對黑豆種皮花色苷生物酶法輔助提取的影響見圖5。分析發現,當酶解時間為60 min時,黑豆種皮花色苷提取含量均最高,其中復合酶輔助提取的花色苷含量為2.016 mg/g。酶解時間大于60 min時,α-淀粉酶、纖維素酶、復合酶輔助提取黑豆種皮花色苷含量雖略有下降,但下降幅度相對平穩。這一結果可能是由于短時間內生物酶沒有得到充分利用,花色苷在溶液中溶解不充分,而隨著酶解時間增大,生物酶作用能力逐漸增強,花色苷更多地溶解于溶液,其含量逐漸提高,但隨著酶解時間的進一步延長,花色苷易氧化分解,導致含量下降。
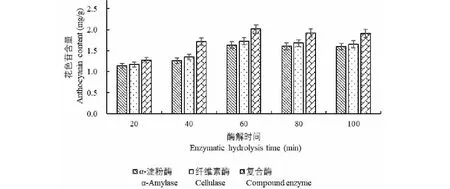
圖5 酶解時間對黑豆種皮花色苷生物酶法輔助提取的影響Fig.5 Effect of enzymolysis time on enzymatic assisted extraction of anthocyanins from black bean seed coat
2.6 響應面法優化復合酶輔助提取黑豆種皮花色苷工藝
2.6.1 響應面分析
根據單因素試驗結果,選擇復合酶酶解,響應面設計試驗的結果見表2,方差分析見表3,并對試驗所得數據進行多元回歸擬合,得到黑豆種皮花色苷含量(Y)對液料比(A)、酶解溫度(B)、乙醇體積分數(C)、酶解時間(D)的回歸方程為:Y=2.06+0.082A-0.049B-0.053C+0.030D-0.067AB-0.029AC+0.023AD-0.087BC+0.040BD+0.077CD-0.18A2-0.24B2-0.21C2-0.15D2。
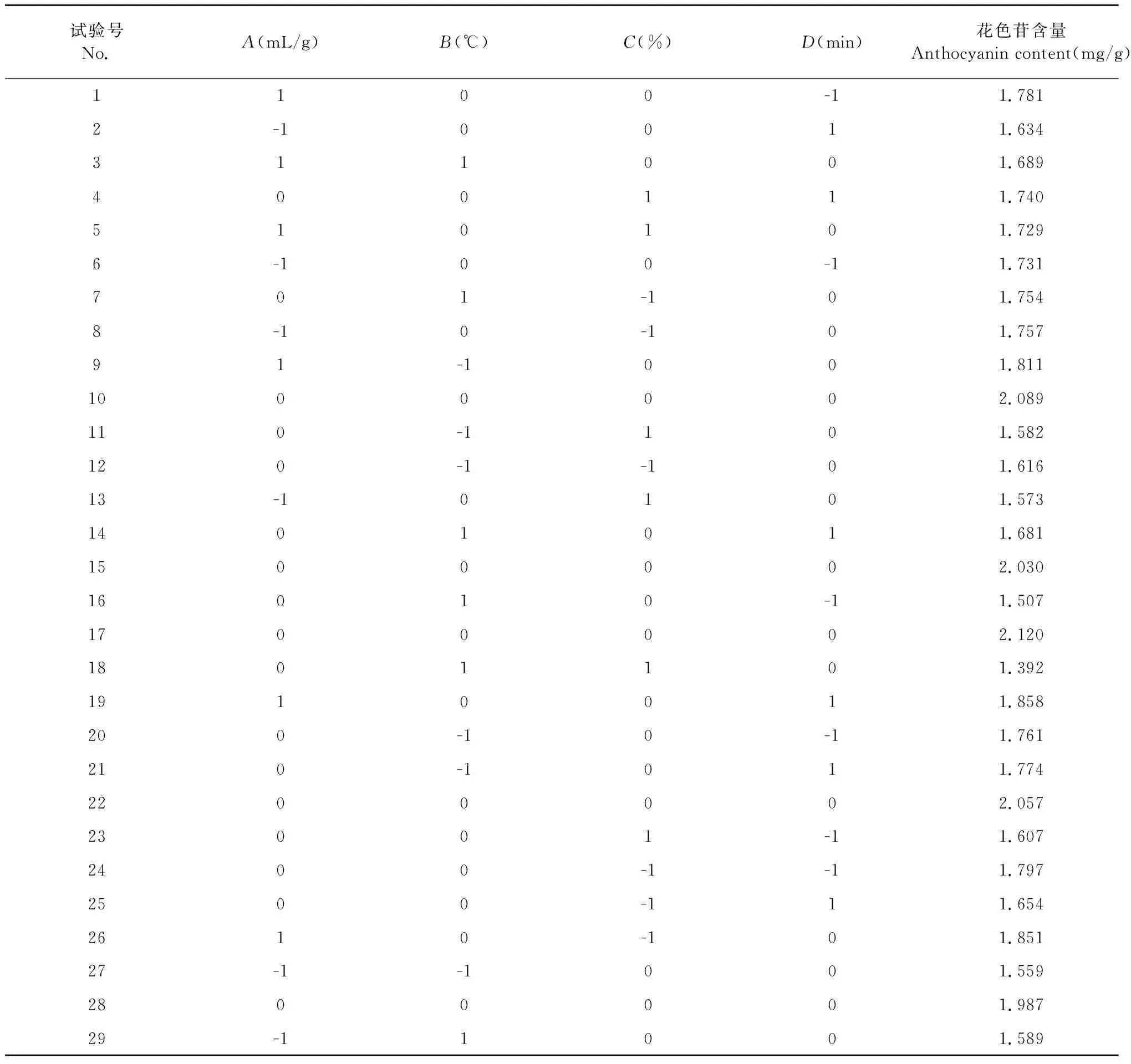
表2 響應面試驗設計及結果分析
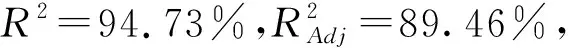
該回歸模型能較好反映各因素與響應值之間的關系。根據表3所得P值大小得出所選因素對花色苷含量的影響的強弱程度順序為:液料比>乙醇體積分數>酶解溫度>酶解時間。

表3 回歸模型方差分析結果
由回歸模型和方差分析可得,方程一次項A、C和二次項A2、B2、C2、D2對提取花色苷含量達到極顯著水平。試驗中AB(液料比與酶解溫度)、BC(酶解溫度與乙醇體積分數)和CD(乙醇體積分數與酶解時間)對提取黑豆種皮花色苷含量影響顯著,各試驗影響因素之間的交互作用響應面圖和等高線圖見圖6~8。因素D、AC、AD、BD對提取花色苷含量影響不顯著。

圖6 液料比和酶解溫度對花色苷含量影響的響應面圖(A)及等高線圖(B)Fig.6 Response surface (A) and contour (B) of the effects of liquid-solid ratio and enzymolysis temperature on anthocyanin content

圖8 乙醇體積分數和酶解時間對花色苷含量影響的響應面圖(A)及等高線圖(B)Fig.8 Response surface (A) and contour (B) of the effects of ethanol concentration and enzymolysis time on anthocyanin content
2.6.2 最佳工藝驗證性試驗結果
根據“2.6.1”的回歸方程,可得試驗范圍內生物酶法輔助提取黑豆種皮花色苷最佳條件為:液料比26.3∶1 mL/g、酶解溫度48.9 ℃、乙醇體積分數63.9%、酶解時間59.22 min,黑豆種皮花色苷含量理論值為2.074mg/g。結合實際操作調整后優化提取參數:液料比26∶1 mL/g、酶解溫度50 ℃、乙醇體積分數64%、酶解時間59 min。在此條件下驗證試驗得到的實際提取花色苷含量為2.019 mg/g,與理論值比較接近,一定程度上驗證了回歸模型的有效性。響應面優化提取方法對復合酶提取黑豆種皮花色苷的回歸分析有一定參考價值。
2.7 黑豆種皮花色苷抗氧化活性
2.7.1 黑豆種皮花色苷還原能力
試驗條件下,隨著花色苷提取液和抗壞血酸質量濃度的增加,反應體系在700 nm的吸光值均呈明顯上升(見圖9),表明黑豆種皮花色苷具有一定還原能力。分析發現,當質量濃度在5~15 μg/mL時,二者吸光值差距逐漸縮小,在15 μg/mL時達到最小,其后又持續增大,表明二者還原能力在15 μg/mL時最接近。吸光值達到0.5時,兩者所需樣品的有效質量濃度IC50值分別是6.59、5.36 μg/mL,花色苷提取液的還原能力低于對照抗壞血酸。
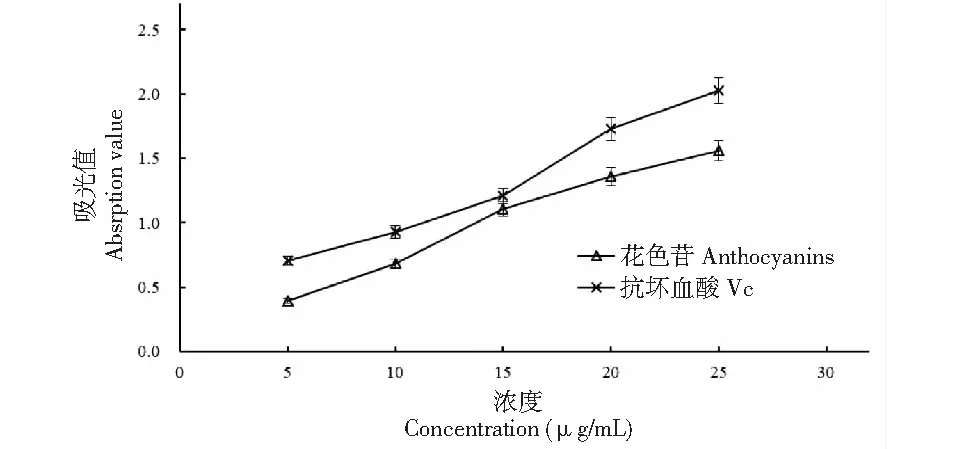
圖9 黑豆種皮花色苷還原能力的測定Fig.9 Determination of reducing ability of anthocyanins in black bean seed coat
2.7.2 超氧陰離子自由基清除能力
還原能力的測定表明花色苷具有抗氧化性,為清除自由基試驗奠定基礎。隨著花色苷提取溶液和抗壞血酸質量濃度的增大,對超氧陰離子自由基的清除率逐漸增加,呈平滑式上升(見圖10),表明兩者對超氧陰離子自由基清除能力的變化規律較為一致。與鐵離子還原能力的測定結果相對應,花色苷提取溶液和抗壞血酸通過自身給出電子的還原能力作用捕獲并中和自由基。兩者對超氧陰離子自由基清除作用的IC50值(清除率為50%時,所需要樣品的有效質量濃度)分別為119.07、93.00 μg/mL,試驗條件下花色苷提取溶液超氧陰離子自由基清除能力略弱于抗壞血酸。

圖10 超氧陰離子自由基清除能力的測定Fig.10 Determination of superoxide anion radical scavenging capacity
2.7.3 亞硝酸根離子清除能力
由圖11可以看出,在試驗條件下,隨著花色苷提取溶液和抗壞血酸質量濃度的增大,其對亞硝酸根離子的清除率也逐漸升高,且清除率均可超過50%,說明二者都能很高效地清除亞硝酸根離子。分析發現,質量濃度較低時,抗壞血酸的清除效果優于花色苷提取溶液,但隨著質量濃度的逐漸上升,花色苷提取溶液對亞硝酸根離子清除能力表現出明顯的增強。花色苷提取溶液和抗壞血酸對亞硝酸根離子清除作用的IC50值分別為13.66、16.70 μg/mL,表明花色苷提取溶液的亞硝酸根離子清除能力強于抗壞血酸。

圖11 亞硝酸根離子清除能力的測定Fig.11 Determination of nitrite ion scavenging capacity
2.7.4 DPPH自由基清除能力
反應體系中的抗氧化劑能給DPPH自由基提供電子和氫原子從而使DPPH自由基溶液發生褪色,褪色程度越大說明清除DPPH自由基的能力越強。質量濃度在10~50 μg/mL范圍時,花色苷提取液和抗壞血酸對DPPH自由基有明顯的清除作用,且隨著樣品質量濃度的升高,其清除能力逐漸升高(見圖12)。兩者對DPPH自由基清除作用的IC50值分別為31.31、36.17 μg/mL,表明試驗條件下花色苷提取溶液的DPPH自由基清除能力強于抗壞血酸。

圖12 DPPH自由基清除能力的測定Fig.12 Determination of DPPH radical scavenging capacity
2.7.5 ABTS自由基清除能力
試驗條件下,花色苷提取溶液對ABTS自由基有明顯的清除能力,且隨其濃度的增加,清除率也逐漸上升,遠高于相同濃度下抗壞血酸對ABTS自由基的清除率(見圖13)。花色苷提取溶液和抗壞血酸對ABTS自由基清除作用的IC50值分別為17.63、29.39 μg/mL,進一步驗證花色苷提取溶液對ABTS自由基清除效果強于抗壞血酸。

圖13 ABTS自由基清除能力的測定Fig.13 Determination of ABTS radical scavenging ability
3 討論與結論
本試驗以乙醇為提取液,對生物酶輔助的方法提取黑豆種皮花色苷進行了工藝優化研究。生物酶法輔助提取植物活性成分具有綠色、無污染、無毒無害等優點,主要根據有效活性成分大多存在于植物細胞的胞質中,可利用纖維素酶、α-淀粉酶等對細胞壁纖維素等的生物降解作用,達到破壞細胞壁的致密結構、實現細胞壁與細胞間質等屏障通透性增強的目的,最大限度促進有效成分由細胞的原生質向提取介質擴散釋放,高效提取生物活性物質[22]。
在單因素試驗基礎上,響應面優化推導最佳提取方案,并進行驗證。結果表明,響應面模型回歸極顯著(P<0.000 1),失擬項不顯著(P>0.05),模型可以比較準確地用來預測黑豆種皮花色苷提取含量隨各試驗因素改變的規律。優化得到的最佳工藝條件:復合酶(纖維素酶400 U/g+α-淀粉酶50 U/g),酶解溫度為50 ℃,液料比為26∶1 mL/g,乙醇體積分數64%,酶解時間為59 min。在此試驗條件下,提取花色苷含量為2.019 mg/g。
對黑豆種皮花色苷抗氧化性的初步研究表明,黑豆種皮花色苷具有較好的抗氧化性,且表現出劑量效應。在試驗范圍內,其還原能力、對超氧陰離子自由基清除能力略低于抗壞血酸,但對亞硝酸根離子和DPPH自由基、ABTS自由基清除能力強于抗壞血酸,這與Xu[23]、Wu等[24]研究結果相一致。花色苷抗氧化能力的產生是因為其具有的共軛結構,并且花色苷穩定性和反應性又受到B環上發生羥基化和甲基化程度與位置的不同的影響,進而產生對花色苷抗氧化活性的影響[25]。研究表明,矢車菊素-3-O-葡萄糖苷(C3G)是黑豆種皮花色苷的最主要成分[26],結構中具有酚羥基,可用作為羥基供體,捕捉、結合游離自由基形成穩定的結構,終止自由基鏈式反應的發生,從而表現出抗氧化能力[27,28]。
試驗表明,黑豆種皮花色苷具有較高的藥用價值和廣泛的應用前景。但生物酶法輔助提取天然有效成分是一個較為復雜的固-液相轉移過程,細胞更多內容物的溶出,可能導致更多雜質同步帶入粗提物中[29]。黑豆種皮中花色苷含量較高,其花色苷粗提物表現出一定的抗氧化能力,具有開發新的花色苷資源的潛力。花色苷并不是黑豆種皮中唯一的抗氧化物質,因此,后續進一步純化黑豆種皮花色苷,對深入研究其有效成分、化學結構、理化性質以及確定構效關系具有一定的指導意義。

