一種快速高效檢測轉基因玉米方法的建立
周德龍 孟令聰 鄭淑波 王 楠 李 穆王薪淇 盧 實 王 敏 劉文國 路 明
(1吉林省農業科學院玉米研究所/玉米國家工程實驗室(長春)/國家玉米工程技術研究中心(吉林)/農業農村部東北中部玉米生物學與遺傳育種重點實驗室/吉林省農作物育種南繁基地開放實驗室,130033,吉林長春;2吉林吉農高新技術發展股份有限公司,136100,吉林公主嶺)
玉米作為全球第一大糧食作物,在保障糧食安全方面起到尤為重要的作用[1]。自20世紀90年代轉基因玉米獲批商業化許可推廣至今,其種植面積逐年增加,2019年全球轉基因玉米種植面積達6090萬hm2,轉基因玉米應用率為31%[2]。近些年來,我國轉基因玉米研發取得顯著進展,2020年抗蟲耐除草劑玉米“DBN9936”、“DBN9501”和“瑞豐 125”,以及耐除草劑玉米“DBN9858”相繼獲得生產應用安全證書,這是繼2009年向國產轉基因植酸酶玉米發放生產應用安全證書之后,再次在主糧領域向國產轉基因玉米頒發批準生產應用安全證書,這將大大推動轉基因玉米產業化進程,使品種研發進入新的發展階段。育種工作中能夠快速準確篩選出含目的基因的新材料,建立高效快速的目的基因鑒定技術尤為重要。
隨著分子技術的快速發展,相關的檢測方法也在更新換代。目前應用比較廣泛的是在常規PCR技術基礎上相繼發展的多重 PCR、數字 PCR、復合PCR和熒光定量PCR等轉基因檢測技術方法[3-9]。常規PCR和熒光定量PCR的檢測方法均需要預先采用 CTAB法或試劑盒等方法提取待檢測樣品DNA,耗時長且工作量較大,無法實現高效快速的轉基因玉米篩選。
本研究通過常規PCR法、TaqMan探針實時熒光PCR法及葉片直接PCR法檢測轉基因玉米植株葉片CaMV35S啟動子和NOS終止子2個元件,比較3種檢測方法的優、劣勢,為快速精準篩查轉基因玉米提供技術支撐。
1 材料與方法
1.1 試驗材料
轉基因玉米材料T561、T661、T841和非轉基因玉米品種吉單27由吉林省農業科學院玉米研究所提供。
1.2 PCR前處理
將4份供試材料播種于沙盤中,待其長至2葉1心時,用取樣器分別取直徑為0.6cm葉片,采用CTAB法提取DNA用于常規PCR,結合瓊脂糖凝膠電泳及熒光定量 PCR進行轉基因檢測。取直徑為0.2cm的葉片用于直接PCR結合毛細管電泳的方法進行轉基因檢測。
1.3 試劑及引物信息
Primerdesign?LtdTM(GMO)定量檢測試劑盒購于北京科奧明生物技術有限公司;2×Taq PCR MasterMix購于博邁德生物有限公司;快速DNA提取擴增試劑盒購于北京天根生化科技有限公司;2×M5 Hiper超光速mix和M5 Hiper超光速mix直接擴增最佳伴侶購于北京聚合美生物科技有限公司。 引物信息見表1。

表1 轉基因檢測引物信息Table 1 Primer informations for genetically modified detection
1.4 試驗方法
1.4.1 常規PCR擴增 采用CTAB法提取待測樣本DNA,用Nano-Drop2000測定待測樣品濃度,將待測樣品DNA濃度稀釋到50~100ng/μL。PCR反應體系按照轉基因植物及其產品成分檢測基本標準物質制備技術規范執行,用 1%瓊脂糖凝膠電泳檢測所得PCR產物,用凝膠成像儀記錄試驗結果。
1.4.2 TaqMan探針實時熒光PCR擴增 采用試劑盒提取樣本DNA,對每份待測樣品采用TaqMan特異性熒光標記法,反應設置3次重復,每批反應同時設有陰性對照、陽性質控和空白對照,RT-PCR擴增反應體系轉基因植物及其產品成分檢測按基本標準物質制備技術規范執行。
1.4.3 葉片直接PCR擴增 取玉米直徑0.2mm的幼嫩葉片少許裝入1.5mL離心管中,加入20μL裂解液M5 Hiper超光速預混液,用移液槍尖簡單研磨即可,如果待檢樣品為老葉片或組織,需要加入50μL裂解液充分研磨1~2min。研磨后95℃熱水浴10min,使其充分裂解后,將樣品管置于離心機中12000轉/min離心 1min,即可得粗提物用于后續PCR反應。粗提物可短期保存在4℃條件下,長期保存需-20℃條件。取粗提物上清液進行 PCR擴增,3次重復,同時設置陰性對照、陽性質控和空白對照,擴增反應總體系 10μL:超純水 ddH2O 3μL、2×M5 Hiper 超光速預混液 5μL、上游引物(10μmol/L)0.5μL、下游引物(10μmol/L)0.5μL和模板DNA 1.0μL。反應條件為95℃預變性3min;94℃變性25s、58℃退火25s、72℃延伸60s(PCR延伸速度設為60s/kb,由于所用DNA模板為粗提物,所以速度慢),共37個循環(較常規PCR增加 2~3個循環所擴增出的條帶會更清晰明亮);72℃終延伸5min。所得PCR產物用毛細管電泳進行分析。
2 結果與分析
2.1 常規PCR檢測分析
利用常規PCR法進行轉基因元件CaMV35S啟動子和NOS終止子檢測(圖1和圖2),除空白對照和陰性對照外,其余材料均擴增出CaMV35S啟動子和NOS終止子,且目的條帶非常清晰,擴增片段大小分別為195bp(CaMV35S啟動子)和182bp(NOS終止子),與目的片段大小一致,表明這些材料均含有轉基因成分。
2.2 TaqMan探針實時熒光PCR檢測分析
利用TaqMan特異性熒光標記法檢測玉米轉基因成分時,無需繪制標準曲線,可直接作定性分析。結果(圖3和圖4)表明,陰性對照無典型擴增曲線,而待測樣品T561、T661、T841和陽性質控對轉基因元件CaMV35S啟動子和NOS終止子均有典型擴增曲線。
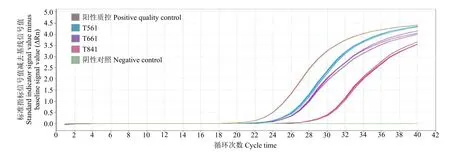
圖3 CaMV35S實時熒光反應擴增曲線Fig.3 Real time expansion reaction curves of CaMV35S
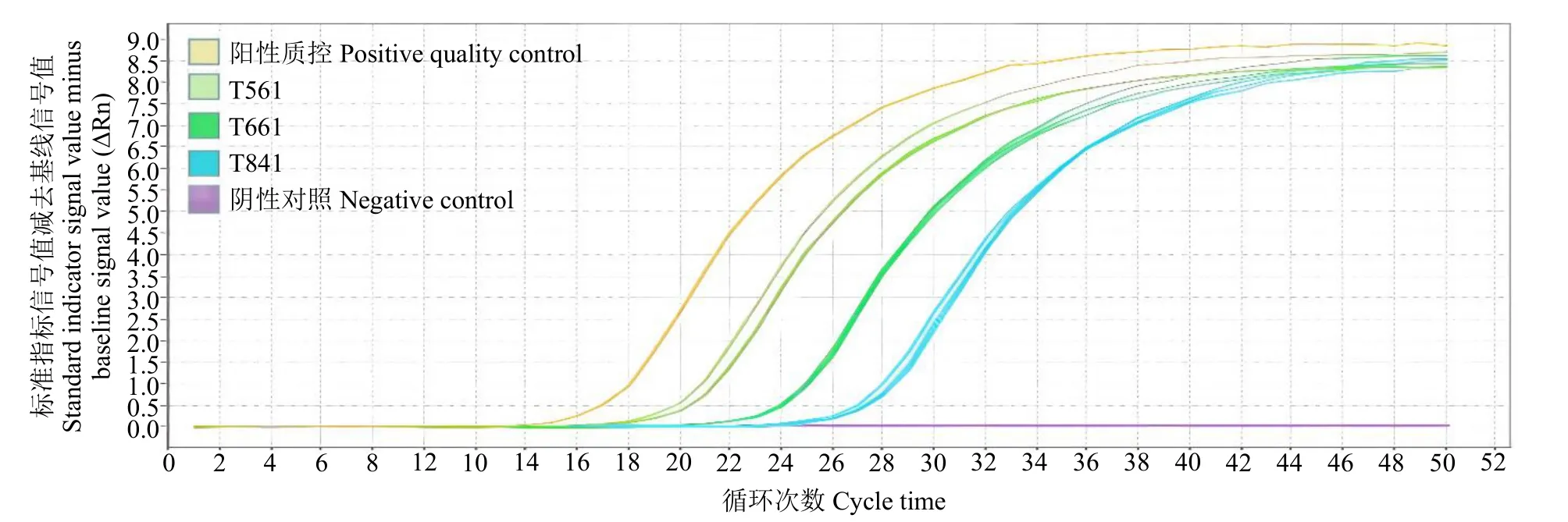
圖4 NOS實時熒光反應擴增曲線Fig.4 Real time expansion reaction curves of NOS
2.3 葉片直接PCR檢測分析
通過葉片直接PCR后,對PCR產物進行毛細管電泳(圖5和圖6),表明除空白對照和陰性對照外,其余材料均擴增出與CaMV35S啟動子和NOS終止子目的條帶片段大小一致的特異性條帶,且擴增效果清晰可見、無雜帶。通過毛細管電泳峰圖結果(圖7)進一步驗證葉片直接PCR法擴增出的目的條帶峰圖清晰可見,并且無影子峰和非特異性峰。因此,采用葉片直接PCR法結果真實準確,并且操作簡單、方便、快捷。
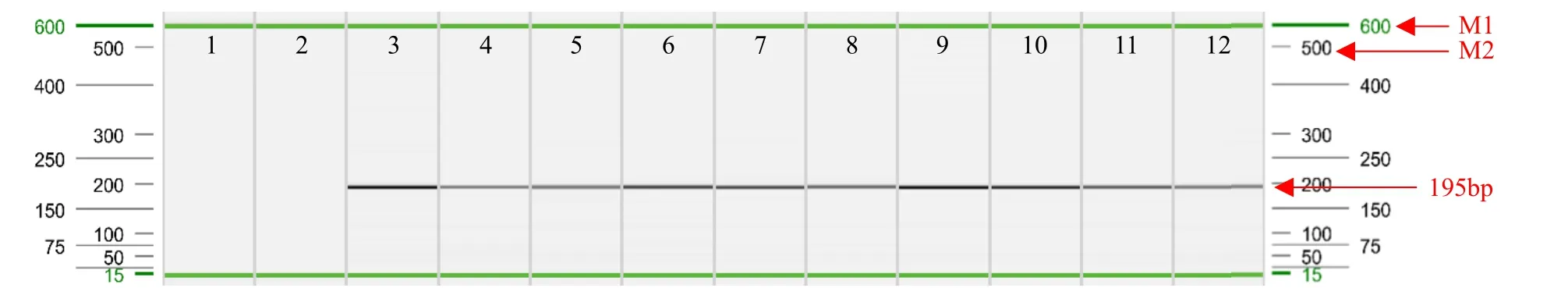
圖5 CaMV35S啟動子直接PCR檢測Fig.5 Direct PCR detection of CaMV35S promoter

圖6 NOS終止子直接PCR檢測Fig.6 Direct PCR test results of NOS terminator

圖7 CaMV35S啟動子和NOS終止子毛細管電泳峰值結果Fig.7 Peak results of capillary electrophoresis of CaMV35S promoter and NOS terminator
2.4 3種方法耗時與成本比較
通過3種轉基因檢測方法的對比(表2)得出,常規PCR法從DNA的提取至電泳結果分析結束耗時307min,3種方法試劑耗材花費80元。TaqMan探針實時熒光PCR法從DNA的提取至熒光PCR結果分析結束耗時223min,使用試劑耗材花費106元。葉片直接 PCR法從葉片的預處理至電泳結果分析結束耗時117min,使用試劑耗材花費60元。葉片直接PCR法在耗時和成本上均優于常規PCR法和TaqMan探針實時熒光PCR法。
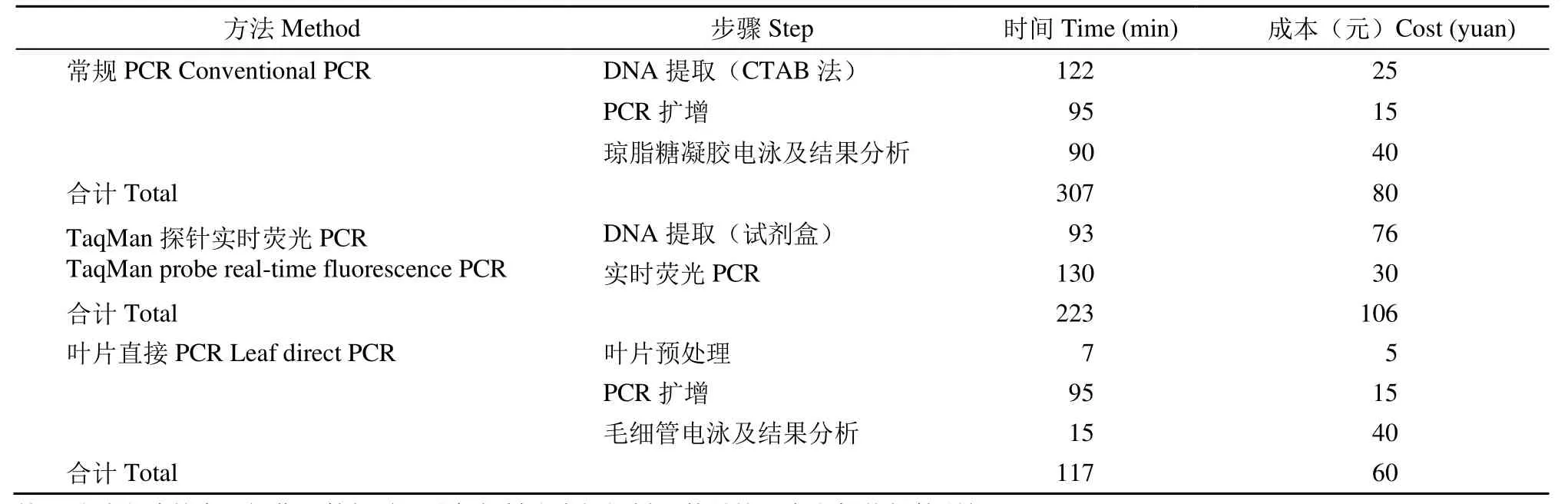
表2 3種方法消耗時間及成本Table 2 Time and cost consumed of three methods
3 討論
隨著分子檢測技術的快速發展,如何準確快速篩選出含有目標性狀的基因通常是育種家最關心的問題,同時也促成了 TaqMan探針實時熒光PCR、數字PCR、多重PCR和單管巢式PCR方法的出現[10-11]。國內外建立的轉基因成分檢測方法中,PCR是應用最普遍的技術,包括常規PCR和TaqMan探針實時熒光PCR[12-14]。常規PCR法檢測工作量大,且存在一定污染,并且在提取DNA時無論采用傳統的CTAB法還是采用試劑盒法,均耗費時間較長且成本較高,尤其是在樣本量比較大的情況下,DNA的提取直接制約著后續檢測工作的效率。利用TaqMan探針實時熒光PCR法篩查玉米中轉基因成分時,操作簡單、定性快速、結果準確,同時可避免對環境及人造成危害,但是定量檢測試劑盒成本較高,前期同樣需要提取DNA,對DNA的純度要求較高。葉片直接 PCR法無需單獨提取DNA,所用試劑為單組分試劑,不含強酸強堿成分,保證了后續PCR反應的穩定可靠,不僅操作簡單,而且避免了樣本交叉污染,只需幾分鐘即可得到DNA模板粗提物,操作安全、快速、無污染。
4 結論
通過常規PCR法、TaqMan探針實時熒光PCR法及葉片直接PCR法檢測CaMV35S啟動子和NOS終止子2個轉基因元件,在檢測樣本數量相同的情況下,葉片直接 PCR法分別較常規 PCR方法和TaqMan探針實時熒光PCR法節約62%和48%的時間以及25%和43%的成本,并且所擴增出的目的條帶清晰可見,符合目的片段大小,結果真實可靠。因此,葉片直接PCR法可以作為1種快速、高效、準確、環保且低成本的轉基因檢測方法廣泛使用。

