水稻細胞質雄性不育及其育性恢復基因的研究進展
段琉穎 吳 婷 李 霞 謝建坤 胡標林
(1江西師范大學生命科學學院,330022,江西南昌;2江西省農業科學院水稻研究所/水稻國家工程實驗室(南昌),330200,江西南昌)
雄性不育(male sterility,MS)在自然界高等植物中廣泛存在,是指雌配子發育正常而雄配子發育異常,且與外來花粉正常受精結實的遺傳現象,主要包括細胞質雄性不育(cytoplasmic male sterility,CMS)和細胞核雄性不育(genic male sterility,GMS)。CMS又稱核質互作雄性不育,是一種由花粉敗育進而導致受精結實異常的母性遺傳現象,受線粒體不育基因和育性恢復(restorer of fertility,Rf)基因共同調控。CMS和Rf作用模式主要由細胞質線粒體基因導致雄性不育,而 Rf能改變線粒體中不育基因的轉錄或表達,使育性得以恢復[1]。水稻(Oryza sativa L.)是全球最重要的三大糧食作物之一,世界上超過50%的人群以稻米為主食,因此水稻的高產、穩產與全球糧食安全和社會穩定密切相關。利用雜種優勢能有效提高農作物產量、品質和抗性,而水稻CMS是三系雜交稻雜種優勢利用的重要途徑。水稻三系的CMS和Rf系統成功配套極大推動了水稻雜種優勢的利用和雜交水稻在中國大規模推廣應用。中國雜交水稻種植面積超過50%,占全國水稻總產量的60%以上[2],為我國乃至世界糧食增產做出了卓越的貢獻。
1954年Sampath和Mohauty首次報道了水稻CMS現象后,國內外學者開始設想通過不育系選育實現雜種優勢在水稻生產上應用;隨后在 1958年,日本 Katsuo等利用中國紅芒野生稻與日本粳稻藤板5號雜交,育成世界上首個具有中國紅芒野生稻細胞質的藤板5號不育系[3]。
1964年,袁隆平[4]提出了利用三系法實現水稻雜種優勢利用的構想,開啟了我國雜交水稻研究的征程。隨著分子生物學研究的發展,分子克隆與生物信息學技術不斷成熟并得到廣泛應用,對各種不育類型育性恢復機理的研究也越來越深入。本文主要綜述了水稻CMS機制、Rf基因的來源、育性恢復遺傳、定位克隆以及育種應用等方面的研究工作。
1 水稻細胞質雄性不育基因的克隆及其不育機理研究
發現并利用水稻雄性不育系是發展雜交水稻的必要前提和重要的物質基礎。迄今為止,育成的水稻CMS胞質類型十分豐富,已達60多種,主要包括野敗型(CMS-WA)、矮敗型(CMS-DA)、D型、岡型(CMS-GA)、印水型(CMS-ID)、紅蓮型(CMS-HL)、馬協型(CMS-MX)、萬恢型(CMSNX)、爪哇型(CMS-LX)、Y型、K52型(CMSK)、包臺型(CMS-BT)、滇型(CMS-DT)和D1型(CMS-D1)[5-7],其中前10種主要用于秈稻,而后4種用于粳稻,這些不同類型CMS根據其恢保關系大致分為CMS-WA、CMS-HL和CMS-BT三大類型。CMS-D1是孢子體雄性不育,無花粉型敗育,為東鄉野生稻特有,其恢保關系不同于其他孢子體不育類型[7]。目前已有7個水稻CMS相關基因被克隆,分別是CMS-WA型的WA352、CMS-BT型的 orf79、CMS-HL型的 orfH79、CMS-CW 型的orf307、CMS-RT98型的orf113、CMS-RT102型的orf352和CMS-D1型的orf182[7-13]。
自20世紀70年代以來,CMS-WA型已在三系雜交水稻的生產中得到廣泛應用,但其不育的分子機理直到最近才逐漸明晰[8]。直到2002年,第1個水稻線粒體基因組測序完成提高了對水稻細胞質不育分子機制的認識。Luo等[8]發現了水稻CMSWA型的不育基因,并闡明了其產生的分子機制。通過對整個CMS-WA線粒體基因組的轉錄本進行檢測分析,發現了1個新的嵌合開放閱讀框,其編碼1個含有352個氨基酸的蛋白質,該蛋白質具有3個跨膜區域,命名為WA352;進一步通過線粒體轉運信號(MTS)與候選基因核轉化融合檢測其功能,表明WA352是導致CMS-WA型的不育基因[8]。該研究[8]還表明,COX11是不育蛋白WA352發揮作用的互作因子和細胞色素c氧化酶(Cyt c)的組裝因子,能清除活性氧(ROS)。而ROS通過影響線粒體的通透性來促進Cyt c向細胞質釋放,進而觸發動物或植物程序性細胞死亡(programmed cell death,PCD)。簡而言之,WA352能特異地在小孢子母細胞期的絨氈層積累并與COX11相互作用,從而抑制COX11清除活性氧的功能,導致ROS積累,Cyt c釋放,進而引起絨氈層PCD異常,最終導致CMS-WA型花粉敗育。
Yi等[14]利用CMS-HL粵泰A與粵泰B構建的線粒體基因組BAC文庫,在粵泰A線粒體基因組atp6基因下游200bp處發現了1個編碼79個氨基酸的開放性閱讀框(open reading frame,ORF),命名為 orfH79,其轉錄產物 ORFH79主要存在于CMS-HL水稻的線粒體中,而在可育系中缺失。進一步將不育基因 orfH79融合為線粒體轉運肽序列并轉化至野生型水稻,其表達誘導配子體雄性不育表型;其轉基因植株的花粉中 ROS積累過多,ATP/ADP值、線粒體膜電位和呼吸速率均降低,并且初生根和側根生長遲緩,根尖 ROS積累異常,造成配子體雄性不育,這表明orfH79可導致CMSHL水稻細胞配子體雄性不育[10]。
CMS-BT不育系來源于印度秈稻 Chinsurah BoroⅡ,其細胞質的線粒體基因組中含有N-atp6和B-atp6 2個 atp6基因的拷貝,組成型轉錄共編碼ATPase復合物的亞基。B-atp6下游存在1個編碼含有79個氨基酸的細胞毒性蛋白orf79基因,其C端對細胞毒性是必要的;同時該基因的功能互補結果也證實了orf79就是CMS-BT不育基因。orf79基因編碼的細胞毒肽對大腸桿菌具有毒性作用,在花藥小孢子中特異性積累,導致花粉敗育[9]。
CMS-D1是一種無花粉型的孢子體細胞質雄性不育類型,來自東鄉野生稻。通過線粒體基因組測序和比較分析,結果檢測到1個候選基因orf182,orf182由1個水稻線粒體基因組片段、1個與高粱線粒體序列同源的片段以及1個未知起源的片段組成,可編碼1個含有182個氨基酸的蛋白[7]。orf182的功能分析表明,其可與線粒體轉運肽融合誘導雄性不育,使花藥中缺乏花粉粒;其在大腸桿菌體內表達,還能抑制大腸桿菌生長,使其呼吸速率降低,ROS過量積累,ATP水平降低。綜上表明,基因orf182與水稻CMSD1的無花粉型孢子體雄性不育有關[7]。
CMS發生的分子機制多樣,目前有關植物CMS形成機理主要可歸納為如下4種假說:
1.1 細胞毒性機理假說
細胞毒性是指由細胞或化學物質引起的細胞損傷事件,不依賴于凋亡或壞死的細胞死亡機理。Dewey等[15]首次提出了線粒體異常基因編碼細胞毒性的假說,認為CMS基因的產物能造成花藥孢子體和配子體細胞線粒體功能受損,導致雄性不育。大多數CMS蛋白具有典型的細胞毒蛋白特征(10~35kDa的跨膜蛋白,含有一個疏水區域)。
1.2 異常細胞程序性死亡假說
PCD是生物體發育過程中普遍存在的,是生物體在生長發育過程中由自身基因決定的主動有序的死亡方式,是生物體新陳代謝過程中正常的生理反應。從小孢子發生到雄配子體發育成熟的不同階段,小孢子或雄配子體異常的 PCD都會造成植物細胞質雄性不育,其中一部分是由絨氈層細胞PCD異常造成的,還有一部分是由減數分裂過程中特定階段的PCD異常所引起[16]。
1.3 線粒體能量供給紊亂假說
細胞生命活動所需95%的能量來自線粒體,線粒體在植物的生長發育尤其是生殖生長過程中極為重要。花藥細胞發育所需要的能量比其他部位的細胞所需能量更多,因此花藥細胞可能會通過增加線粒體數目或代謝活性產生更多的能量[17]。在該假說中,線粒體CMS基因的產物會造成線粒體的能量代謝異常,不能產生足夠的能量,影響孢子體和配子體的正常發育,從而導致花粉敗育。
1.4 反向調控假說
該假說認為線粒體與細胞核之間發生逆向調控,線粒體的不育基因產生信號來調控細胞核基因的表達,進而控制CMS基因在線粒體中的表達[18]。目前,在水稻CMS中,只有中國野生稻細胞質不育系(CMS-CW)符合這一假說。CMS-CW恢復基因Rf17編碼線粒體蛋白(retrograde-regulated sterility,RMS),等位基因Rf17和rf17均不改變CW-orf307轉錄。而CMS-CW細胞質通過1個或多個未知的反向信號上調rf17的表達,但由于啟動子調控區域變異致使CMS細胞質未上調Rf17的表達。RMS上調表達抑制花粉萌發,導致配子體不育[11,19-20]。
總而言之,CMS的形成涉及復雜的信號調控和代謝過程,毒性蛋白、早期異常 PCD和能量不足可能是形成CMS機制的一部分。無論引發水稻CMS現象的分子機制如何,孢子體(主要是絨氈層)或配子體細胞都會因為線粒體氧化還原過程或能量產生異常而死亡,最終導致花粉敗育。
2 三系雜交稻恢復系恢復基因的來源
水稻CMS和Rf基因的發掘和利用使我國雜交水稻的研究水平大幅提升。三系雜交稻的商業化應用除了需培育出優良的不育系外,還要選育與之配套的優良恢復系。因此,在三系雜交水稻研究的過程中,恢復基因的研究倍受關注。
有關水稻恢復基因的研究最早可追溯到20世紀60年代,許多學者開始對恢復基因的來源進行探索性研究。1972年,Shinjyo[21-22]發現強恢復品種主要分布在僅種植粳稻和秈稻的熱帶地區,而來自日本及其他溫帶國家或地區的水稻品種絕大部分為非恢品種。1970年我國培育出野敗型CMSWA的不育細胞質,1973年以袁隆平為首的全國雜交水稻協作攻關小組從東南亞品種中篩選到強恢復系[23]。自此,相繼培育了許多恢復系,然而這些骨干恢復系大多來源于低緯度地區的秈稻品種。與之不謀而合的是,多項研究均表明,恢復基因頻率在熱帶比在亞熱帶或溫帶地區高。隨后對印度的冬稻(aman)、秋稻(aus)和夏稻(boro)3個生態型秈稻品種進行研究,結果表明,冬稻和夏稻品種篩選出恢復系的頻率比秋稻品種更高。而印尼的“布魯稻”(bulu)和“久來稻”(tjereh)2個生態型品種和爪哇島的“久來稻”品種具有強恢復力。在亞洲范圍內,強恢復系主要在南亞、東南亞和我國華南;在美國,僅種植粳稻的加利福尼亞州未發現強恢復系,而在主要種植秈稻的路易斯安那州和得克薩斯州篩選出3個強恢復系[24]。綜上,起源于低緯度地區的水稻品種恢復系頻率高于起源于高緯度地區的水稻品種,秈稻品種的恢復系頻率高于粳稻品種。
自我國三系雜交稻配套成功以來,先后在生產上涌現了IR24、IR26、IR661、IR30、明恢63、揚稻6號以及華占等一批骨干秈型恢復系,資源比較豐富[25-26],然而這些骨干恢復系遺傳背景單一[27],其系譜大部分可追溯到明恢63和IR系列品種等少數幾個優異恢復系[28],基本上含有東南亞地區農家品種Peta的遺傳成分,屬于南亞和東南亞中秈生態型[29],這大大限制了高產優質雜交組合的培育。可見,三系雜交稻育種中亟需豐富恢復系的遺傳多樣性,而拓寬恢復系的來源以加強雜種優勢的利用已成共識[30]。
我國雜交水稻生產中應用的雄性不育細胞質來源于地方品種和野生稻[31],而細胞質雄性不育總是與恢復基因相伴隨并協同進化的[32],由此野生稻中必然存在相應的恢復基因[33]。因此,發掘和利用新的恢復基因,特別是野生稻來源的恢復基因將是豐富我國恢復系的恢復源、擴大雜交稻雙親遺傳距離以及選配優良雜交組合的有效手段,可有效避免我國恢復系的恢復基因單一化所帶來的潛在危險。
3 水稻恢復基因經典遺傳學研究
20世紀70年代后期以來,大量的水稻育性恢復遺傳研究表明,胞質雄性不育性均可被相應的恢復基因所恢復。一般認為,CMS-WA及其恢保關系相類似的胞質不育類型的育性恢復主要受2對基因或單個主效基因控制[34-36]。CMS-BT和CMS-HL的育性恢復主要由1對基因控制[37-38]。此外,微效基因對細胞質雄性不育的育性恢復也具有一定的影響。恢復等位基因在一些基因位點上表現出特定的多態性,且完全恢復不同類型CMS的不育性所需的恢復基因數目不等[34-38]。由此可見,恢復基因對不育性的恢復作用具有專效性。這些經典遺傳學研究均采用一般經驗標準將群體劃分為不同的育性組別,然后根據經典遺傳理論和統計分析方法推斷控制性狀的基因對數、不同基因的相對效應及基因間互作存在與否。實際上,大多數群體的育性分離呈雙峰型連續分布,少數群體的育性分離呈典型的正態分布或多峰分布,育性群體無法明確劃分“育”和“不育”的界限。因此,胞質雄性不育的育性恢復受主效基因控制的同時,還可能受微效基因的修飾作用。可見水稻胞質不育性恢復遺傳機理十分復雜。
4 水稻恢復基因的定位與克隆
分子生物學技術的快速發展,極大地推動了水稻細胞質雄性不育及其育性恢復的分子機理研究。自20世紀70年代起,國內外研究者對野敗型(CMSWA)、紅蓮型(CMS-HL)、包臺型(CMS-BT)和矮敗型(CMS-DA)等不同類型CMS開展了育性恢復QTL分析,在水稻12條染色體上檢測到超過75個不同胞質類型育性恢復 QTL,其表型貢獻率介于2.9%~61.9%。然而,由于不同學者采用的研究材料及育性指標不同,其QTL定位結果也不盡相同。
4.1 野敗型胞質不育恢復基因定位
有關野敗型細胞質雄性不育育性恢復基因定位的報道較多,目前已定位到40個野敗型育性恢復QTL,廣泛分布在水稻的除9號染色體以外的11條染色體上[39-55](表1)。

表1 水稻CMS-WA育性恢復QTLTable 1 QTL for fertility restoration of CMS-WA in rice
在 1號染色體上共檢測到 13個育性恢復QTL[39-50],其中10個QTL成簇分布于染色體的短臂端,有 4個貢獻率大于 32%。在10號染色體上檢測到了13個育性恢復QTL[39-40,43-46,49-55],成簇分布于長臂端,其中莊杰云等[44]定位到的 QTLqRf1表型貢獻率最大,為43.0%;Ngangkham等[55]將育性恢復 QTLRf4精細定位至區間 RM6737~RM6100,其物理位置約104kb。2、3、4、5和8號染色體上各定位到1個育性恢復QTL,其中位于3和4號染色體上的Rfi-3和Rfi-4的貢獻率均大于35%,為主效QTL。而在6、7、11和12號染色體上共檢測到9個育性恢復QTL,其遺傳效應均為微效[39,44,47]。上述研究報道認為,野敗型恢復基因主要受2對主效基因控制,但各自的效應大小不同,表現出累加效應,且受微效基因的影響。
4.2 紅蓮型胞質不育恢復基因定位
CMS-HL不育胞質來源于海南紅芒野生稻,屬于典型的配子體不育類型,迄今共定位到8個育性恢復QTL,分布于1、8和10號染色體上[56-62](表2)。Shen等[62]在水稻1號染色體長臂端檢測到1個紅蓮型育性恢復QTL,介于區間RG374~RG394。在8號染色體上定位到2個育性恢復QTL[59-60],Huang等[60]將其精細定位至區間RM407~SNP32,物理位置約16.8kb。在10號染色體定位到5個育性恢復QTL[56-58,61],成簇分布在該染色體長臂端相似區域,其中Hu等[57]將育性恢復QTLRf5精細定位至區間RM6469~RM25659,物理位置約67kb;劉航等[54]檢測到 1個紅蓮型恢復基因的主效 QTLqRF-10-1,同時還受其他幾個微效QTL的影響。上述研究表明,CMS-HL育性恢復QTL主要位于8和10號染色體上。
4.3 包臺型胞質不育恢復基因定位
目前中國生產上應用面積最大的粳稻不育系為包臺型(CMS-BT)細胞質,大多經典遺傳研究表明,CMS-BT的育性恢復性受 1對顯性基因控制。迄今4個育性恢復QTL被定位到水稻10號染色體上[63-66](表 3),其中 Akagi等[63-64]首先在 10號染色體定位到1個QTL,之后在此基礎上將其精細定位至區間68923-6~68923-9之間,物理位置約為22.4kb。
4.4 其他類型胞質不育恢復基因定位
目前共定位到8個CMS-DA型胞質不育育性恢復QTL,分別位于1、5、9和10號染色體上[67-69](表4)。在1號染色體上定位到3個主效育性恢復QTL,其中,Hu等[69]檢測到的育性恢復QTL貢獻率最大,為30.2%。在5和9號染色體上分別檢測到1個微效和主效育性恢復QTL,其貢獻率分別為8.6%和16.0%[68-69]。在10號染色體上定位到3個育性恢復 QTL[67-68],其中 2個育性恢復 QTLqRf10-2和qRf10為主效 QTL,其貢獻率均大于35%。該研究[67-68]認為植株的育性恢復除受到主效基因的控制外,還受微效基因和環境的影響,恢復基因之間、恢復基因與遺傳背景之間、恢復基因與環境之間亦存在著復雜的相互作用。CMS-DA育性恢復QTL主要位于1和10號染色體上,貢獻率介于2.9%~43.2%。

表4 水稻其他類型胞質不育育性恢復QTLTable 4 QTL for fertility restoration of other CMS
共檢測到10個CMS-ID型胞質不育育性恢復QTL,分別分布于水稻1、3、5、7和10號染色體上[69-70](表4)。在1號染色體上定位到2個育性恢復QTL[69-70]。在3號染色體上檢測到1個主效育性恢復QTLqRf3,貢獻率為14.9%。在5號染色體上檢測到2個育性恢復QTL,其中qRf5.1的表型貢獻率為17.4%,為主效QTL。在7號染色體上檢測到1個育性恢復QTL,其遺傳效應較小,表型貢獻率為9.3%[69]。在10號染色體上檢測到4個育性恢復 QTL[69-70],其中育性恢復 QTLqRf10.1和qRf10.2[69]與Rf4[70]位于相同染色體區域。
在DT型不育胞質育性恢復基因定位方面,Tan等[71]在水稻10號染色體上定位到1個控制滇型細胞質不育育性恢復基因的主效基因;Fujii等[19,73]在水稻4號染色體上定位到1個新的CMS-CW型恢復基因Rf17,其增效等位基因來自普通野生稻。此外,Li等[74]將 CMS-FA型福建野生稻細胞質育性恢復基因Rf(fa)定位在10號染色體區間RM6100~MM2023,其物理位置約 121.1kb,而 CMS-FA是一種新型的秈型水稻孢子體雄性不育類型。
盡管迄今為止檢測到了大量的不同胞質不育類型的育性恢復基因,但絕大部分恢復基因來自栽培稻和地方品種,有關野生稻恢復基因的發掘和定位研究較為薄弱[19,69,73-74]。
4.5 水稻恢復基因的克隆及其育性恢復機制
目前,已經克隆了7個水稻育性相關的恢復基因,包括野敗型恢復基因Rf4、紅蓮型育性恢復基因Rf5和Rf6、包臺型恢復基因Rf1(Rf1a和Rf1b)、Ifr1、Lead-Rice型恢復基因Rf2以及CW型恢復基因Rf17(表5)[8-9,20,57,66,71,75-79]。
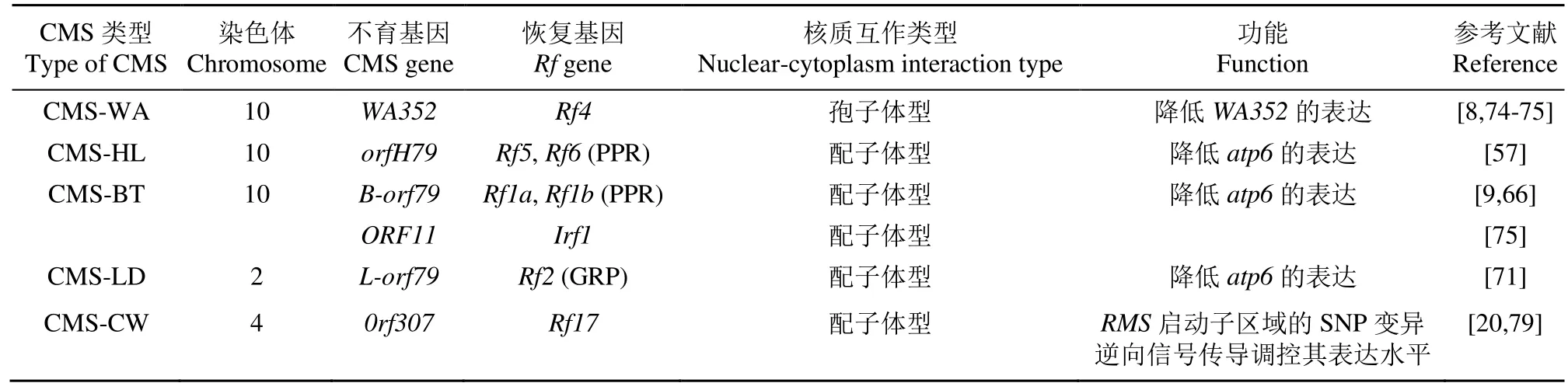
表5 已克隆的水稻細胞質不育育性恢復基因Table 5 The cloned fertility restorer genes for cytoplasmic male sterility in rice
CMS-WA育性恢復主要受 2對主效顯性基因Rf3和Rf4的控制,分別位于1和10號染色體上[48],且Rf4恢復基因遺傳效應強于Rf3,且Rf3具有協同效應[49]。Rf4編碼PPR蛋白,通過降低不育基因WA352的轉錄本水平恢復育性,Rf3對WA352轉錄水平無影響;相反,在Rf3恢復的植株中,在小孢子母細胞階段沒有檢測到WA352蛋白,這表明Rf3可能在翻譯后水平發揮作用[8,76-77]。
CMS-HL育性恢復受2個恢復基因Rf5和Rf6的控制[58],且Rf5和Rf6能正常恢復CMS-BT胞質不育[80]。其中,Rf5與CMS-BT的恢復基因Rf1a相似,編碼1個PPR蛋白,但Rf5蛋白對atp6-orfH79轉錄本的加工機制不同。在CMS-BT/Rf1系統中,Rf1a直接結合B-atp6/orf79mRNA,而在CMS-HL/RF5/RF6系統中,恢復基因Rf5和Rf6不能直接結合不育基因的mRNA。其育性恢復蛋白RF5和RF6需要分別通過招募其他的育性恢復復合體去結合并剪切不育基因mRNA,從而使育性恢復。這些復合體中與恢復基因互作的重要亞基成分包括GRP162、RFC3和OsHXK6。目前相關的互作因子都已被鑒定,并且2個恢復基因都有各自獨立的途徑來實現不育轉錄本的加工[57-61,81]。
CMS-BT細胞質中含有線粒體基因atp6,該基因能與一個異常的線粒體開放閱讀框orf79共轉錄編碼一個細胞毒素蛋白而導致雄性不育。其育性恢復受Rf1控制,包含2個緊密連鎖的恢復基因Rf1a和Rf1b,均編碼1個PPR蛋白的多基因簇成員,其中蛋白 Rf1A可直接與不育基因轉錄本 B-atp6/orf79的mRNA互作,進而剪接B-atp6/orf79mRNA恢復育性,而蛋白Rf1B則通過降解B-atp6/orf79的mRNA恢復育性[9]。
CMS-LD育性恢復受Rf2控制,其編碼的蛋白由152個氨基酸組成,具有1個富含甘氨酸的結構域。該結構域可能直接或間接地與引起CMS的蛋白質互作,使育性恢復。CMS-CW育性恢復受Rf17控制,包含2個功能基因PPR2和ORF11(RMS)。ORF11具有反向調控雄性不育的功能。ORF11表達增加抑制花粉萌發,從而導致配子體不育;而抑制ORF11的表達可恢復植株育性[20,71,78-79]。
全基因組關聯研究是分析水稻復雜性狀的有效方法之一。對CMS-WA和CMS-HL胞質類型育性恢復相關性狀進行全基因組關聯分析,分別檢測到13和6個顯著性位點,其中3個CMS-WA型和2個CMS-HL型育性恢復位點分別與Rf4和Rf6一致;進一步對恢復基因Rf4、Rf5和Rf6進行單倍型分析,表明Rf4、Rf5和Rf6分別有4、2和8個主要單倍型[77]。關聯分析與連鎖分析相結合可以更有效地挖掘水稻育性恢復相關基因。在克隆的7個水稻育性恢復基因中,水稻 CMS-WA、CMS-BT和CMS-HL的恢復機制研究已較為深入,大部分RF編碼PPR蛋白,對CMS的調控主要表現在轉錄或轉錄后水平。無論以何種機制實現育性恢復,水稻CMS育性恢復的分子機制都有待進一步研究。
5 水稻育性恢復基因的育種利用
水稻細胞質雄性不育及其育性恢復相關基因的發掘與利用極大地促進了我國雜交水稻的大面積推廣與應用,對世界水稻增產、糧食安全和社會穩定發揮了重要作用。自20世紀70年代的泰引1號、IR24、IR26和IR661等第1代秈型三系恢復系被測交篩選之后,采用測恢、雜交育種和輻射誘變育種等不同方法,迄今已育成的水稻恢復系不勝枚舉,相繼出現IR30及其衍生系等第2代三系恢復系,明恢63、桂33、測64-7等第3代三系恢復系,揚稻6號等第4代恢復系兩系、三系兼用的共恢恢復系和華占及其衍生系等第5代共恢恢復系[82-83]等不同階段。其中第3~4代恢復系的測64-7、桂33、明恢63和揚稻6號等代表性恢復系通過“恢復基因轉移”選育而成,其主要恢復基因可追溯至IR8、IR30和Peta等東南亞品種,它們是野敗型雜交稻前期的主要恢復系以及后續恢復系選育的重要核心種質;而第 5代恢復系華占則由馬來西亞品種SC02-S6經復測和系統選育而成,說明骨干恢復系在恢復系更替和雜交稻選育中具有重要作用。
在雜交水稻恢復系發展與演變進程中,明恢63對中國雜交水稻的更新換代具有里程碑意義,其具有恢復力強、恢復譜廣、綜合農藝性狀優良、抗病和配合力好等特點,同時早、晚雜交稻可以兼用,含有恢復基因Rf3和Rf4/Rf1B[46,82],是目前我國應用最廣的恢復系,其衍生培育超過617個恢復系。由明恢63與珍汕97A配制的水稻品種汕優63具有米質好、稻瘟病抗性強、產量高及抗逆性強等優良的農藝性狀,種植地域為 100°36′ E~121°56′ E、17°30′ N~37°49′ N,是種植面積最大的品種,1984-2009年累計推廣面積達6.288億hm2[82]。
揚稻6號是具有高產、優質、多抗和適應性廣等特點的中秈恢復系,其對野敗型及其類似不育系無恢復力而對紅蓮型和兩系不育系的恢復能力較強,含有恢復基因Rf5和Rf6[59,61]。揚稻6號配制的兩優培九是繼汕優63之后全國應用面積最大的兩系雜交稻,集優質、超高產和多抗性狀于一體,整合了理想株型與部分亞種間強大的雜種優勢[84],在我國雜交稻發展進程中具有重要意義。
華占是近年來在雜交稻育種應用中最廣泛的恢復系之一,以引自馬來西亞的SC02-S6為親本材料,通過與不同類型不育系測配選恢和系統選擇育成,2008-2017年以華占配組大面積推廣的優質組合13個,累計推廣373.3萬hm2[83]。根據國家水稻數據中心的公開信息(http://www.ricedata.cn/variety/,截止到2020年12月)顯示,以華占為父本的雜交組合已有147個通過審定,其中三系組合98個、兩系組合 49個,多數育成組合具有豐產優質和抗稻瘟病等特性。可見,華占是重要的三系和兩系不育系共恢恢復系。由上述分析可見,恢復系是雜交水稻的重要組成部分,雜交水稻組合的更新演替與恢復系的改良與發展密不可分;而恢復基因利用和恢復系的選育是提高雜交水稻抗性與雜種優勢的主要推動力。然而,目前我國大面積應用的三系雜交稻組合所使用的不育系主要還是野敗型、紅蓮型和包臺型,而生產中推廣的秈型不育系的恢復系基本上含有東南亞地區品種或品系的遺傳成分,其親源均可追溯到IR系統、明恢63和測64-7等少數幾個優良親本,導致恢保關系單一,難以實現更進一步的雜種優勢,只有發掘新的恢復源才能更進一步提高雜種優勢。
6 展望
我國雜交秈稻育種處于世界領先地位,主要得益于在不同類型不育細胞質源及其相應的育性恢復源的發掘利用和優質不育系、恢復系的選育等方面的迅速發展。而水稻育性恢復是由多基因控制的質量-數量性狀,其遺傳機制十分復雜,不同育性恢復基因之間、恢復基因與遺傳背景之間、恢復基因與環境之間存在著復雜的相互作用。得益于分子生物學技術和理論的迅速發展,水稻CMS及其Rf基因相繼被克隆和鑒定,豐富了不同胞質類型的不育形成機理和育性恢復機制的認識。此外,育種者可以通過分子標記輔助選擇利用已精細定位或克隆的恢復基因,使得恢復系選育過程中恢復位點的選擇更加便利[85]。然而,鑒于CMS/Rf系統在作物遺傳育種中的重要性,需要研究更多的不同類型水稻CMS/Rf系統并應用于水稻生產實踐,以避免遺傳脆弱性和同質化現象。因此,就CMS及其Rf的生物學研究和應用應加強如下幾點:
6.1 加強三系雜交稻優勢的理論基礎研究
目前,有關水稻CMS-BT、CMS-WA和CMSHL的不育基因及其恢復作用機理的研究較為全面深入,而對水稻CMS-LD、CMS-CW、CMS-FA和CMS-D1不育基因及其恢復作用機理等研究相對淺顯[7,20,71,74],這也限制了它們被廣泛應用[86-87]。因此,加強不育基因及其恢復基因的發掘及其機理研究可以指導雜交水稻的不育系和恢復系選育實踐,最終應用于水稻生產。
6.2 加快破解三系雜交稻局限性
我國三系雜交水稻的骨干不育系和恢復系分屬于南亞、東南亞中秈生態型和中國華南早秈生態型等兩大雜種優勢群,然而群內的遺傳多樣性較低,親本間同質化現象嚴重。大部分三系雜交水稻不育系屬CMS-WA[85],存在遺傳差異小和遺傳背景單一等風險,容易引發水稻生產安全危機。應大力發掘水稻種質資源特別是野生稻等栽培稻近緣種中新的CMS基因和恢復基因,不斷豐富三系雜交稻不育細胞質源和恢復源。最近報道的東鄉野生稻細胞質[7]是與現有恢保關系不同的新的細胞質資源,應加強開展東鄉野生稻胞質類型的三系雜交稻的育種應用和雜種優勢群研究。
6.3 加強水稻遠緣雜交研究,提高水稻的雜種優勢
遠緣雜交產生的水稻雜種優勢潛力巨大,以“粳不秈恢”雜交模式育成的秈粳亞種間三系雜交稻取得重要進展。繼續加強秈粳雜交的理論和應用研究,以期獲得更大突破。廣泛開展秈稻、粳稻和熱帶粳稻等不同類型水稻間的遠緣雜交研究,探索新的水稻雜種優勢群。
6.4 利用生物信息學技術,助力三系雜交稻育種
借助高通量測序和CRISPR/Cas9技術,綜合全基因組、轉錄組、蛋白組、代謝組和表觀基因組等不同組學研究,從不同水平對水稻CMS及其Rf基因的分子機制進行系統深入的研究,為全面了解CMS/Rf的分子機制提供豐富的信息,加速對水稻細胞質雄性不育及其育性恢復調控機理的研究進程。此外,通過KASP高通量基因分型等技術[85]鑒定挖掘水稻育性恢復的候選等位基因,利用分子標記和 CRISPR/Cas9編輯技術[88]等分子技術對不育系和恢復系的綜合性狀進行分子改良,助推高效CMS/Rf系統的育種利用。

