用于3種食源性致病菌核酸提取的微流控芯片制備
曹 寧, 申炳陽, 喻梓瑄, 占太杰, 周新麗
(上海理工大學 健康科學與工程學院,上海 200093)
由食源性致病菌引起的食源性疾病不僅嚴重危害人類健康,還會導致重大的經濟損失[1-2],如何快速、準確地識別食源性致病菌顯得尤為重要[3-4]。常用的食源性致病菌檢測技術是分子診斷技術[5],如聚合酶鏈反應(PCR)和酶聯(lián)免疫吸附測定(ELISA)。核酸提取是分子診斷的第一步,核酸的提取質量與效率直接影響實驗研究結果和診斷結果[6-7]。目前,基于磁珠法提取核酸的方法最為常見,采用特異性磁珠能夠捕獲樣品中的靶標核酸,通過外部磁體的移動執(zhí)行多步驟洗滌,但該方法提取核酸存在耗時長、操作煩瑣、試劑損耗多等缺點,極大降低了檢測效率。
微流控技術是在微觀尺寸下控制、操作和檢測復雜流體的技術,通道和反應腔尺寸為微米級,具有小型化和集成化的特點[8-9]。目前,微流控技術能夠把化學和生物等多領域中所涉及的樣品制備、分離、等分、檢測及細胞培養(yǎng)等操作集成在芯片上[10-11],且多單元靈活組成,構成芯片實驗室。將微流控技術用于磁珠法提取核酸[12-13],能夠減少擴散距離、縮短提取時間、簡化操作步驟,該方法已成功應用于RNA[14-15]和DNA[16]的純化,以及細胞分離[17]和免疫測定[18]。Shi等[19]提出了一種磁珠法與微流控技術相結合的方法用于核酸提取。該系統(tǒng)使用親水性斑點固定微流控液滴,通過磁體控制磁珠在液滴之間運動。這種方法可以在低濃度的培養(yǎng)基中提取總RNA,提取的樣品量滿足實時定量PCR的檢測,提取過程耗時5 min。此方法能同時提取多個樣品,還可以從復雜樣品中提取微量核酸,但不能測量核酸提取濃度、優(yōu)化反應條件。Shu等[20]提出了一種自動液滴陣列方法,首先將試劑以油包水形式進行預存儲,油相能夠通過交互作用滲入微孔和縫隙,而水相被表面張力排除在外;其次,通過自動液滴陣列控制磁珠的運動來完成樣品的裂解、洗滌、洗脫和檢測。此方法需要編程方式來自動化控制磁珠,可操作性較差。Suimpf等[21]提出了一種在離心微流控芯片上對甲型H3N2流感病毒進行全自動樣品檢測方法,該檢測系統(tǒng)通過離心微流控技術實現(xiàn)基于PCR的病原體檢測自動化,將所有必要過程集成在一張芯片上。此方法從樣品到檢測完成的全部分析時間不到3.5 h,但該芯片設計復雜,制造難度大,成本高,不易進行商業(yè)化生產。
針對上述問題,作者設計并制作了一種用磁珠法提取核酸的微流控芯片,該芯片具有制作簡便、操作簡單、試劑消耗量低、核酸提取環(huán)境封閉性好等優(yōu)勢,并可對3種常見食源性致病菌進行核酸提取。為了提高核酸提取效率,對芯片通道的親水處理時間,核酸提取孵育時間、磁珠混合次數(shù)及洗脫時間進行了優(yōu)化。
1 材料與方法
1.1 材料與試劑
1.1.1 材料聚甲基丙烯酸甲酯(Polymethylmethacrylate,PMMA;光學級):日本三菱科技有限公司產品;雙面膠(光學級):東莞富印膠粘科技有限公司產品;NA營養(yǎng)瓊脂培養(yǎng)基:青島海博生物技術有限公司產品;LB肉湯培養(yǎng)基:上海博微生物科技有限公司產品;DP705磁珠提取試劑盒:天根生化科技有限公司產品;B600001 Taq DNA聚合酶:上海生工生物工程有限公司產品。
1.1.2 菌株大腸桿菌(ATCC43895)、沙門氏菌(IQCC10518)、單增李斯特氏菌(ATCC19117):中國檢驗檢疫科學研究院動植物檢疫所贈送。
1.1.3 引物采用Primer premier 5.0分別以rfbe、sefA、hlyA基因為模板進行大腸桿菌、沙門氏菌和單增李斯特氏菌PCR引物設計。大腸桿菌上游引物rfbe-F:AAGATTGCGCTGAAGCCTTTG,下 游 引 物rfbe-R:CATTGGCATCGTCTGGACAG。沙門氏菌上游引物sefA-F:TTTACGGTCTATTTTGATTTG,下游引物sefA-R:ATATGCTCCACAAGGTTAATG。單增李斯特氏菌上游引物hlyA-F:CTGGCACGGACTTC CACTTAC,下游引物hlyA-R:TTTGAGCACCGATG ATGATTT。以上引物均由上海生工生物工程有限公司合成。
1.2 儀器與設備
VLS2.30二氧化碳激光雕刻機:美國UNIVERSAL公司產品;TBK508芯片貼合機:深圳深旺達科技有限公司產品;YQ-620C超聲波清洗機;上海易凈超聲波儀器有限公司產品;DW-86L828超低溫保存箱:青島海爾科技有限公司產品;HD850超凈臺:江蘇杰森博生物科技有限公司產品;GHP-9160恒溫培養(yǎng)箱:上海一恒科學儀器有限公司產品;NANO DROP 2000C超微量分光光度計、ST16低溫離心機:北京賽默飛科技有限公司產品;ZQZY-70BF搖床:上海知楚儀器有限公司產品。
1.3 芯片的設計與制作
采用磁珠法提取食源性致病菌中的核酸。磁珠法提取原理為[22]:用納米技術對超順磁性納米顆粒的表面進行改良和修飾后,制備成超順磁性氧化硅納米磁珠。100 nm~1 μm的磁珠可以有效吸附生物樣品中微量核酸,再通過外界磁場將磁珠吸附、轉移、洗滌、洗脫等,完成核酸的純化。根據(jù)此原理,微流控芯片主要包括1個核酸裂解腔、4個核酸清洗腔及1個核酸洗脫腔,分別用于磁珠與核酸的結合、核酸純化及核酸的洗脫。
采用三維設計軟件Solidworks設計出芯片的數(shù)字模型,使用聚甲基丙烯酸甲酯(PMMA)制作,芯片的尺寸為70 mm×60 mm×1.8 mm。如圖1所示,芯片由3層厚度分別為0.5、0.8、0.5 mm的PMMA組成,上層主要包括氣動閥(A1~A5)、抽氣孔(B1)及通氣孔(C1);中層主要包括裂解腔(L1)、清 洗腔(P1~P4)、洗脫腔(E1)、毛細管閥(M)等結構,各腔室的體積分別為156、180、100、180、60、15 μL。最終,使用底板進行密封鍵合,形成一個平行且互相可貫通的微流體網絡。采用抽氣孔(B1)負壓抽取的方式使流體按照通道結構進行流動。芯片使用激光雕刻機進行制作,采取光學級雙面膠黏合的方式進行封裝,使用芯片貼合機進行對準鍵合并除去氣泡,最終制作出核酸提取微流控芯片。
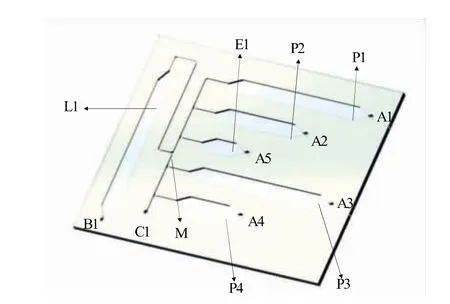
圖1 核酸提取芯片的結構示意圖Fig.1 Schematic diagram of nucleic acid extraction chip
1.4 芯片上核酸提取程序
首先,分別將磁珠、清洗液1、清洗液2、清洗液3、清洗液4及洗脫液預存儲于L1、P1~P4以及E1中,使用硅膠貼進行密封。其次,將食源性致病菌的裂解液加入裂解腔中進行孵育裂解,裂解液中含有溶菌酶及蛋白酶K,溶菌酶能夠水解細菌細胞壁,而蛋白酶K促進蛋白質水解,當DNA從食源性致病菌中釋放后,磁珠會將其吸附。在裂解過程中,使用釹鐵硼(NdFeB)磁鐵手動控制磁珠的運動,促進細菌裂解和DNA吸附過程。裂解完成后,吸附有DNA的磁珠被磁鐵牢牢固定在裂解腔內,此時注射泵以10 μL/s的流量進行液體負壓抽取去除裂解液。然后,按照A1~A4的先后順序依次打開氣動閥,使P1、P2、P3、P4中的清洗液分次清洗帶有核酸的磁珠,進而去除磁珠上非特異性結合的蛋白質、多糖等雜質,完成核酸的純化過程。在洗脫前,要確保清洗液中的乙醇完全揮發(fā),以10 μL/s的流量進行液體負壓抽取,干燥10 min,去除磁珠周圍及芯片上的殘留液體。最后,打開氣動閥(A5)將洗脫液釋放到裂解腔,在56℃的恒溫下進行磁珠上的核酸洗脫。將純化后的核酸移至離心管中,用于后續(xù)檢測或放入-20℃進行保存。
1.5 通道的親水處理時間對核酸提取的影響
PMMA為芯片制作材料,具有優(yōu)異的光學性能,但是其表面的疏水性能不利于微通道中流體的流動。為了減少流動時氣泡的產生、降低溶液的損耗、提高核酸的提取質量濃度,采用吐溫20對PMMA表面進行親水處理[23]。將芯片PMMA放入體積分數(shù)為1%的吐溫20溶液中,分別靜止放置5、10、15、20、25、30 min,再將PMMA取出,放入烘箱30 min烘干。滴加體積為5 μL的去離子水于處理后的PMMA表面,測定水珠在芯片上接觸角的大小,以此來判斷親水性的強弱。最后,使用吐溫20試劑處理前和處理后的芯片進行大腸桿菌核酸提取,分析親水處理對核酸提取質量濃度的影響。
1.6 芯片上核酸提取條件的優(yōu)化
為了提高芯片上核酸提取質量濃度及純度,采用上述芯片對大腸桿菌進行核酸提取,分析孵育時間、磁珠混合次數(shù)及洗脫時間對核酸提取效果的影響。
核酸孵育過程中,通過增加孵育時間,磁珠上的結合位點能夠與核酸充分結合。選取孵育時間分別為3、6、9、12、15 min,每3 min進行一次磁珠的三維旋轉,其他條件保持不變,最終在56℃的恒溫加熱板上加熱10 min提取核酸,測定不同孵育時間條件下提取核酸的質量濃度。
核酸孵育過程中,通過三維旋轉磁鐵來進行磁珠混合,增強磁珠捕獲效果,該過程核酸與捕獲探針結合來捕獲具有匹配序列的靶標,每隔3 min將磁鐵三維旋轉3、5、7、9、11次,其他條件保持不變,最終在56℃的恒溫加熱板上加熱10 min提取核酸,測定不同磁珠混合次數(shù)條件下提取核酸的質量濃度。
核酸洗脫過程中,通過洗脫液及高溫使磁珠與核酸連接間的共價鍵斷裂,核酸轉移至洗脫液。選取洗脫時間為5、10、15、20、25 min,并將芯片放在56℃的加熱板上,其他條件保持不變,測定不同洗脫時間條件下提取核酸的質量濃度。
1.7 核酸質量濃度測定
提取核酸的質量濃度通過超微量分光光度計進行測量。將洗脫液的測試結果作為空白對照,得到DNA質量濃度及DNA純度(A260/A280)。DNA質量濃度越高,表明相同菌株濃度下的DNA提取率最高;DNA純度(A260/A280)取值在1.8~2.0表明純度很好,取值小于1.8表明有蛋白質污染,取值大于2.0表明DNA有部分降解或有RNA污染[24]。
1.8 芯片提取核酸的擴增與驗證
用微流控核酸提取芯片對革蘭氏陰性菌(大腸桿菌、沙門氏菌)及革蘭氏陽性菌(單增李斯特氏菌)進行核酸提取,對芯片上提取的3種不同種類的DNA進行PCR擴增和PCR產物的瓊脂糖凝膠電泳實驗。添加1 μL模版DNA,5 μL 10×PCR Buffer緩沖液(100 mmol/L Tris-HCl(pH 8.8,25℃)),3 μL 25 mmol/L MgCl2,1 μL 10 mmol/L dNTP,2 μL上游和下游引物,1 μL 5 U/μL Taq聚合酶添加至離心管中,用去離子水定容至最終體積為50 μL進行PCR反應。熱循環(huán)方案:94℃初始變性5 min,94℃變性45 s,58℃進行30 s,72℃進行60 s,35次循環(huán);72℃延伸10 min。以ddH2O為模板作為陰性對照。添加20 μL擴增產物與2 μL SinoBio 2×Taq混合液混合,在120 V恒定電壓下,用1.5 g/dL的瓊脂糖凝膠電泳分離擴增產物,將凝膠置于凝膠成像儀上,在紫外線照射下觀察實驗結果。
2 結果與分析
2.1 微流控芯片上的流體控制
微流控芯片上的流體控制過程如圖2所示。在芯片上的L1、P1、P2、P3、P4及E1等區(qū)域分別定量加入156、180、100、180、60、15 μL的染料(見圖2(a)),再使用硅膠貼密封住氣動閥(A1~A5)及抽氣孔(見圖2(b))。調節(jié)注射泵以10 μL/s的流量進行液體負壓抽取,抽取裂解腔中液體(見圖2(c))。抽取完成后,將清洗腔P1的氣動閥A1的密封硅膠貼轉移至通氣孔,使清洗腔P1內氣壓與大氣平衡,注射泵將清洗腔P1的液體泵送至裂解腔進行清洗(見圖2(d)),20 s后抽取到注射泵內。將清洗腔P2的氣動閥A2的密封貼轉移至清洗腔P1的氣動閥A1處,清洗腔P2的液體由注射泵泵送至裂解腔進行清洗(見圖2(e)),10 s后抽取到注射泵內。同理,依次將清洗腔P3、清洗腔P4、洗脫腔的液體泵送至裂解腔(見圖2(f)~(h)),完成流體控制的全過程(見圖2(i))。
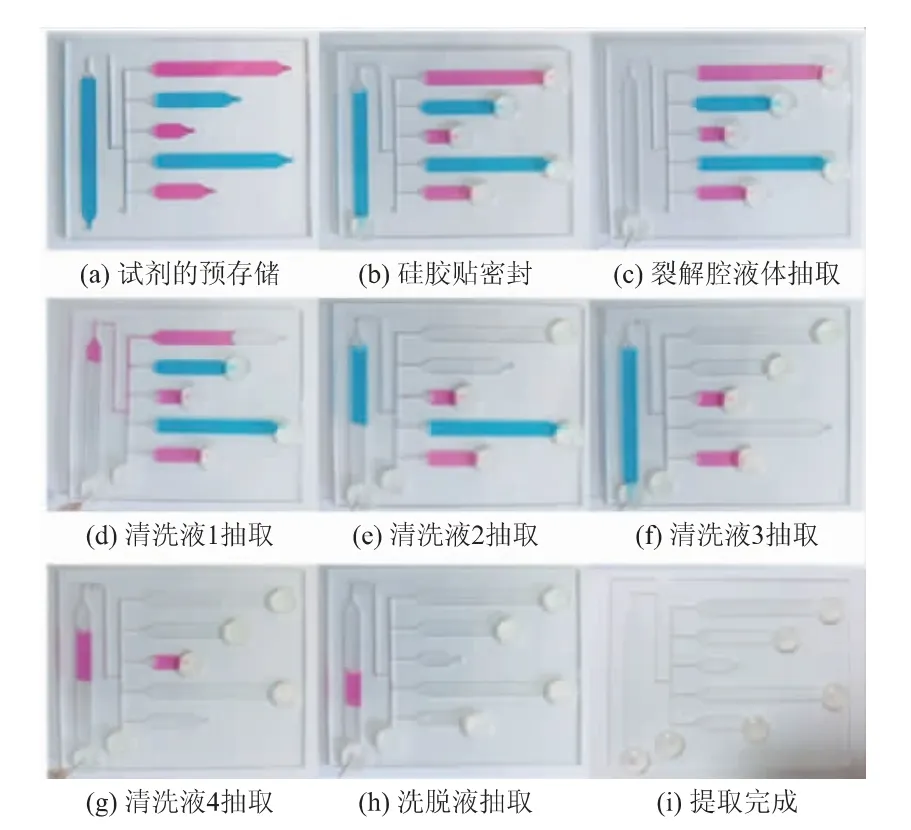
圖2 芯片上流體控制實物圖Fig.2 Images of fluid control on the chip
2.2 通道的親水處理對核酸提取的影響
2.2.1 吐溫20處理時間對通道親水程度的影響接觸角是固、液、氣三相的交界點和固-液界面與液-氣界面的切線形成的夾角,液體在固體表面的接觸角能夠反映液體在固體表面的親疏水性[25-26]。親水性增加,試劑在芯片中的殘留量下降,核酸提取率增加。圖3(a)從左到右依次為未做親水處理、芯片放入體積分數(shù)為1%的吐溫20中分別處理15 min和30 min后液滴在芯片表面的圖像。測量不同處理時間下液滴與芯片的接觸角如圖3(b)所示,沒有經過吐溫20處理的PMMA,其接觸角為65.92°,隨著吐溫20處理時間的不斷增加,接觸角逐漸變小,當處理時間大于25 min后,接觸角達到最小且基本保持不變,說明親水性能趨于穩(wěn)定,此時PMMA的親水性最好。
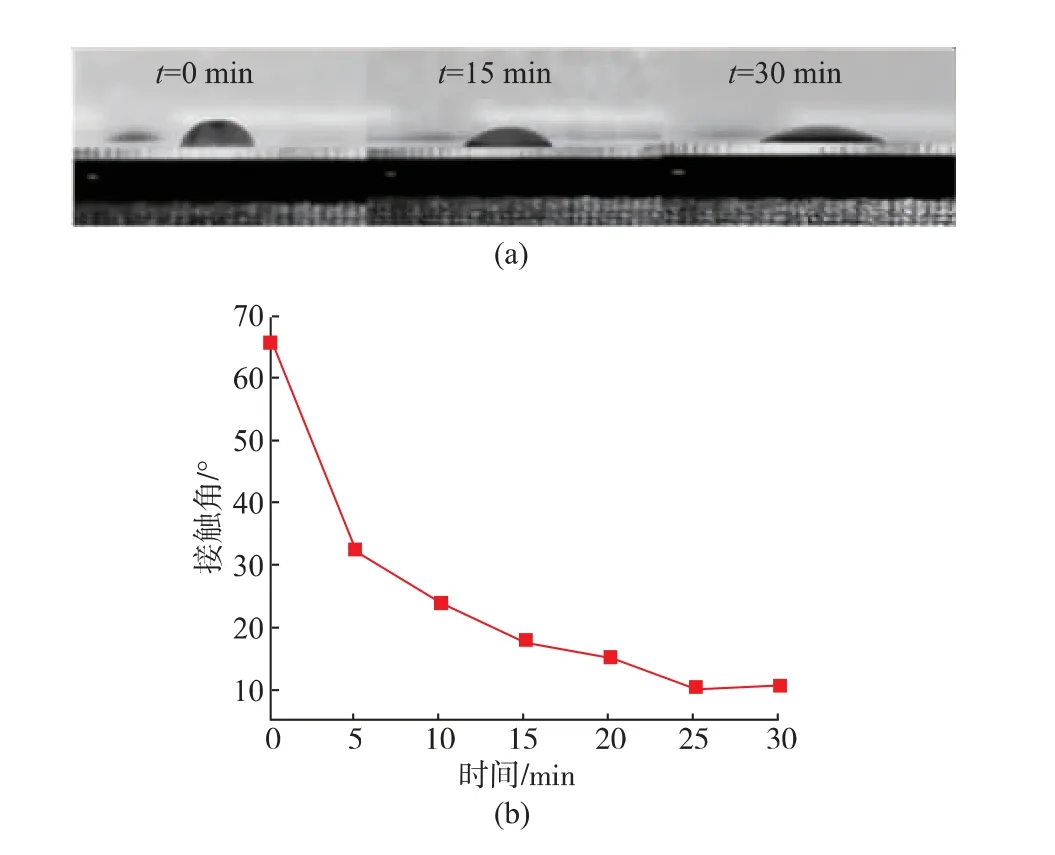
圖3 吐溫20處理時間與接觸角之間的關系Fig.3 Relationship between reagent processing time and contact angle
2.2.2 親水處理對芯片上核酸提取質量濃度的影響芯片親水處理前后,核酸提取質量濃度由表1所示,吐溫20處理前芯片上的核酸提取質量濃度為80.2 ng/μL,經過體積分數(shù)為1%的吐溫20處理30 min后,芯片上核酸提取質量濃度為99.40 ng/μL,表明親水處理能夠有效提高核酸提取質量濃度。可采用體積分數(shù)為1%的吐溫20對PMMA處理30 min,作為后續(xù)核酸提取最優(yōu)條件。

表1 芯片親水處理前后的核酸提取質量濃度及純度Table 1 Nucleic acid extraction concentration before and after the hydrophilic treatment of the chip
2.3 芯片上核酸提取條件的優(yōu)化
2.3.1 孵育時間優(yōu)化孵育時間對芯片上核酸提取質量濃度的影響如圖4所示。從圖中可以看出,隨著孵育時間的提高,DNA與磁珠吸附效果逐漸增強,在9 min時達到最高值,核酸提取質量濃度為72.65 ng/μL;孵育時間大于9 min后,核酸提取質量濃度開始下降,這是因為磁珠上的結合位點有限,其他非特異性雜質與核酸競爭結合磁珠上的位點,導致核酸提取質量濃度下降。從圖4中可以看出,孵育時間為6、9、12、15 min時,A260/A280均在1.8~2.0,表明孵育時間在6~15 min時,核酸純度良好。綜合考慮,選擇孵育時間9 min為最佳孵育時間。
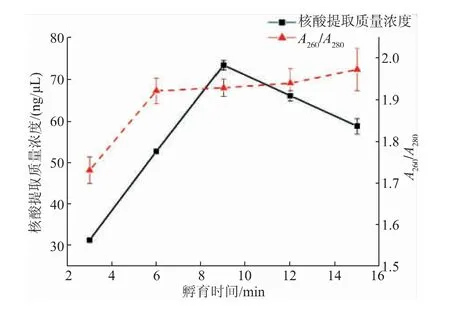
圖4 孵育時間對芯片上核酸提取質量濃度的影響Fig.4 Effect of incubation time on the nucleic acid extraction concentration on the chip
2.3.2 磁珠混合次數(shù)優(yōu)化磁珠混合次數(shù)對芯片上核酸提取質量濃度的影響如圖5所示。從圖中可以看出,隨著磁珠混合次數(shù)的增加,核酸提取質量濃度不斷增加,在磁珠混合次數(shù)為9次時達到最高值,隨后基本保持不變。在磁珠混合次數(shù)為9次時,核酸提取質量濃度為94.76 ng/μL。在使用磁珠提取核酸的過程中,磁鐵與磁珠吸附后,磁珠易發(fā)生團聚現(xiàn)象,不能充分吸附目標核酸,且團聚磁珠難以分散,隨著磁珠混合次數(shù)的提高,磁珠團聚現(xiàn)象減少。當磁珠混合次數(shù)在5、7、9次時,A260/A280的比值在1.8~2.0,表明核酸純度良好。綜合考慮,選擇磁珠混合次數(shù)9次為最佳磁珠混合次數(shù)。
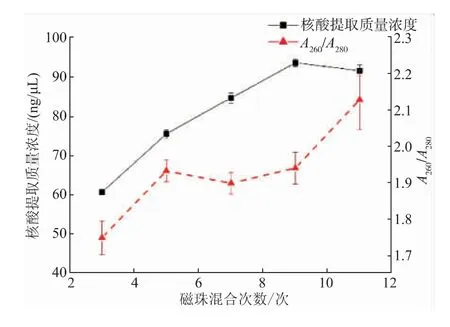
圖5 磁珠混合次數(shù)對芯片上核酸提取質量濃度的影響Fig.5 Effect of magnetic beads mixing times on the nucleic acid extraction concentration on the chip
2.3.3 洗脫時間優(yōu)化洗脫時間對芯片上核酸提取質量濃度的影響如圖6所示。從圖中可以看出,隨著洗脫時間的增加,核酸提取質量濃度不斷增加,在洗脫時間為20 min時達到最高值,隨后開始下降。在洗脫時間為20 min時,核酸提取質量濃度為149.80 ng/μL。隨著洗脫時間的不斷增加,洗脫液在內部可能造成蒸發(fā)的現(xiàn)象,核酸提取的質量濃度下降。從圖6中可以看出,洗脫時間為10、15、20、25 min時,A260/A280的比值在1.8~2.0,表明洗脫時間在10~20 min時,核酸純度良好。綜合考慮,選擇洗脫時間20 min為最佳洗脫時間。
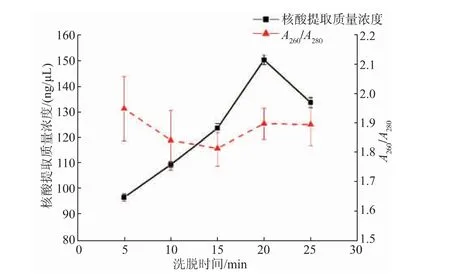
圖6 洗脫時間對芯片上核酸提取質量濃度的影響Fig.6 Effect of elution time on the nucleic acid extraction concentration on the chip
2.4 芯片上3種食源性致病菌的核酸提取質量濃度
在上述孵育時間為9 min、磁珠混合次數(shù)為9次、洗脫時間為20 min優(yōu)化條件下,用微流控芯片對革蘭氏陰性菌(大腸桿菌、沙門氏菌)及革蘭氏陽性菌(單增李斯特氏菌)進行核酸提取,表2為3種食源性致病菌的核酸提取質量濃度。結果表明,3種食源性致病菌的核酸提取質量濃度及純度良好。

表2 3種食源性致病菌的提取質量濃度Table 2 Extraction efficiency of three food-borne pathogens
從芯片上收集的DNA,通過PCR擴增并進行瓊脂糖凝膠電泳分析。圖7為注入2 μL的DNA提取液的凝膠電泳結果,泳道1、2、3、4分別為陰性對照實驗組、大腸桿菌的497 bp擴增子、單增李斯特氏菌116 bp擴增子及沙門氏菌443 bp的擴增子,證明了芯片上提取出的核酸滿足后續(xù)實驗要求。
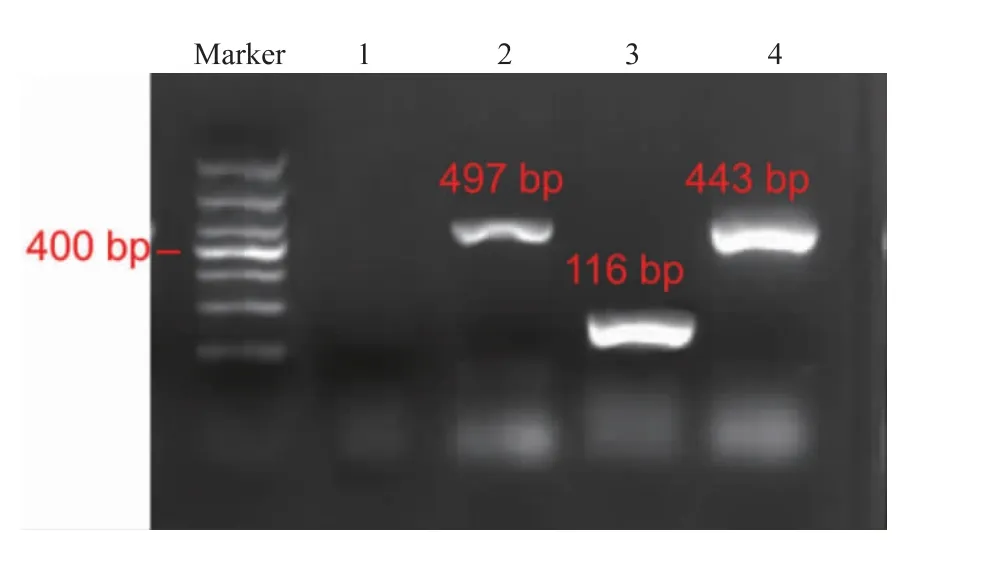
圖7 3種食源性致病菌DNA經PCR擴增的電泳圖Fig.7 PCR electrophoresis diagrams of three food-borne pathogens
2.5 芯片與其他核酸提取方法對比
將一些商品化的核酸提取方法與本文中提出的微流控芯片方法進行對比。苯酚氯仿抽提法使用了苯酚、氯仿等實驗室常見的試劑,核酸提取成本低,但此方法毒性較大,且核酸的回收率較低。由于需要實驗人員的操作,重復性較差,損失量較大,很難進行微量化操作。離心柱法比傳統(tǒng)的苯酚氯仿抽提法提取率高,且能進行微量操作,但此方法需要進行反復離心,不便用于高通量、自動化的操作及現(xiàn)場檢測。磁珠法能夠配合96孔板核酸自動提取儀使用,實現(xiàn)自動化、高通量操作,且操作簡單、安全無毒,但需要精密儀器,不利于現(xiàn)場檢測。當微流控法與磁珠法相結合能夠更加精準操控磁珠,通過在芯片上設計多個通道,實現(xiàn)各個反應單元相互隔離、互不干擾,實現(xiàn)高通量檢測且試劑消耗量低、樣品用量少。
3 結語
本文中設計了一種提取食源性致病菌核酸的微流控芯片,并通過對芯片進行親水處理、核酸提取孵育時間、磁珠混合次數(shù)及洗脫時間等條件的優(yōu)化,提高了核酸提取效率。此方法與手動磁珠提取法相比,核酸捕獲、洗滌、釋放均在芯片上進行,磁珠在裂解腔中固定,通過液體分批次釋放流動到裂解腔,避免了微通道閥門中磁珠的捕獲和丟失及阻塞微通道的問題,降低了試劑消耗量。通過調節(jié)磁珠與靶標序列的結合時間(核酸提取時間)及三維旋轉磁鐵的次數(shù)(磁珠混合次數(shù)),提高了目標序列的捕獲速率和濃度,減少了在雜交過程中出現(xiàn)成簇和沉淀的情況,增加靶標結合位點,提高DNA提取量。此外,基于文中核酸提取的微流控芯片,還能夠增加核酸擴增的模塊,為今后集成式核酸提取及擴增的一體化芯片制備做準備。然而,對食源性致病菌進行核酸提取的微流控芯片也存在需要改進之處,如流體控制由泵驅動及磁鐵旋轉控制由手動操控,自動化程度還不夠高,處理時間較傳統(tǒng)核酸提取方法沒有顯著提高。下一步期望研制出小型一體化商用檢測設備,將驅動、旋轉、擴增檢測等單元集成于一張芯片,使核酸檢測人員不需要專業(yè)儀器培訓即可在現(xiàn)場及資源不足的條件下進行精準病原體檢測。

