擠壓溫度對大豆分離蛋白與原花青素復合物結構和功能特性的影響
王振國,高育哲,時家峰,張俊杰,江睿生,霍金杰,蘇 爽,肖志剛
擠壓溫度對大豆分離蛋白與原花青素復合物結構和功能特性的影響
王振國,高育哲,時家峰,張俊杰,江睿生,霍金杰,蘇 爽,肖志剛※
(沈陽師范大學糧食學院,沈陽 110034)
為了探究不同擠壓溫度(40、60、80、100和120℃)對大豆分離蛋白(Soy Isolate Protein,SPI)與葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)復合物功能性質及結構特性的影響。該研究以溶解度、乳化性、乳化穩定性、-電位、粒度為指標,利用熒光光譜、紅外光譜分析該復合體系中大豆分離蛋白功能性質及結構的變化。結果表明:相較于擠壓SPI,經過擠壓處理的SPI-GSPE復合物的溶解度、乳化活性指數、乳化穩定性指數、-電位絕對值及持水性均顯著提高(<0.05),其表面疏水性、持油性顯著下降(<0.05)。隨著擠壓溫度的升高,SPI-GSPE復合物的溶解度、持油性及乳化活性均先增大后減小且在80℃達到最大值,而其表面疏水性先減小后增大且最小值在80℃,-電位絕對值、乳化穩定性及持水性均隨溫度的升高而降低。粒徑分析結果表明,擠壓處理后SPI與GSPE形成了更加致密的復合物;熒光光譜及紅外光譜結果表明,與GSPE的復合及擠壓處理使SPI氨基酸殘基所處微環境發生變化,蛋白結構發生變化。以上結果表明擠壓溫度為80℃時SPI-GSPE復合物功能性質提高幅度最大,為GSPE與SPI復合提高SPI的功能性質提供參考。
擠壓;結構特性;功能特性;原花青素;大豆分離蛋白
0 引 言
大豆分離蛋白是一種全價蛋白,經低溫脫脂豆粕加工而成。其主要組分為甘氨酸和-伴球蛋白。甘氨酸由一個酸性亞基和一個堿性亞基組成,由一個二硫鍵連接。-伴球蛋白由′3種亞基構成[1]。大豆分離蛋白(Soy Isolate Protein,SPI)具有一系列功能特性,如溶解度、乳化性、持水性等,目前已被廣泛地應用于食品加工[2]。原花青素是自然界中發現的一種多酚,是一類含有雙黃酮衍生物的天然多酚化合物的總稱[3]。葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)來源于葡萄籽由黃烷-3-醇通過C-C鍵或CO-C鍵聚合而形成,因其具有的生物活性而被廣泛研究。酚類化合物與蛋白質的相互作用可能導致蛋白質的結構及功能性質發生變化,如溶解度、熱穩定性和乳化性。
目前,蛋白質和多酚的復合作用日益受到重視。一些研究人員發現,蛋白質與多酚之間的復合作用會導致蛋白質結構性質的改變。Hasni[4]研究發現酚類化合物與蛋白通過親水和疏水相互作用結合。Relkin等[5]研究表明酚類化合物分散在中性水溶液中會與蛋白質結合,從而降低蛋白質的溶解度。在Rawel等[6]研究中發現酚類化合物與蛋白質的反應可引起蛋白質的交聯。蛋白質的二級和三級結構發生變化,分子的表面性質受到影響,使其具有親水性。Tsai等[7]觀察到超氧化物歧化酶(Superoxide Dismutase, SOD)與酚類化合物相互作用后熱穩定性增加,并且隨著加工溫度的提高兩者結合能力越強。
擠壓技術是一種物理改性技術,它集成了多個單元操作,如物料混合、均質化、蒸煮和成型[8]。它具有改善食品材料功能特性的能力。分子變化的激活和化學鍵的建立導致功能特性的改變。在擠壓過程中,蛋白質通過機械和熱能的協同作用,失去了其固有的、有組織的結構,導致蛋白質變性[9],其構象發生變化。盡管擠壓技術在工業上已經成熟使用,但是擠壓對蛋白質功能性的研究及應用尚未得到充分理解。目前食品營養成分相互作用引起了研究者的廣泛關注,但是對于多酚與蛋白相互作用的研究主要集中在濕熱條件下,且鮮見涉及在擠壓體系下多酚與蛋白的相互作用。同時考慮到蛋白質和酚類物質對人類健康、食品營養和質量等方面的重要作用。因此本試驗探究了在擠壓體系內擠壓溫度對大豆分離蛋白與葡萄籽原花青素復合物(Soy Isolate Protein -Grape Seed Proanthocyanidin Extract,SPI-GSPE)的溶解性、乳化活性、持水性等功能性質和結構的影響,以期了解兩者之間相互作用后功能性質及結構的變化,拓寬大豆蛋白食品的應用范圍(如植物基素肉),為生產功能型SPI-GSPE復合產品提供理論依據。
1 材料與方法
1.1 材料與試劑
原花青素,蘇州天恒生物;大豆分離蛋白,哈爾濱高科技術有限公司;氯化鈉、氫氧化鈉、Tris、甘氨酸冰乙酸、8-苯氨基-1-萘磺酸(8-Anilino-1-Naphthalenesulfonic Acid,ANS)、濃鹽酸,天津市永大化學試劑有限公司;十二烷基硫酸鈉(Sodium Dodecyl Sulphate,Ammonium Persulfate,SDS),麥克林化學試劑有限公司。其他化學試劑均為分析純。
1.2 儀器與設備
電子分析天平,上海舜宇恒平科學儀器有限公司;離心機,美國貝克曼庫爾特公司;小型超微粉碎機,廣州旭朗機械設備有限公司;ULTRA TURRAX?高速分散機及磁力攪拌器,德國IKA公司;UV1800-型紫外分光光度計,上海美普達儀器有限公司;Zetasizer Nano ZS90分子粒度和Zeta電位分析儀,英國Malvern公司;分光光度計,上海元析儀器有限公司。DS56-Ⅲ雙螺桿擠出機,濟南賽信膨化機械有限公司;BT-100SD電磁加水泵,中國上海嘉鵬科技有限公司;冷凍干燥機,松原華興科技發展有限公司;AVATAR 370FT-IR 紅外光譜儀,德國布魯克公司。
1.3 試驗方法
1.3.1 樣品制備
擠壓試驗在雙螺桿食品擠壓機中進行,如圖1所示。將SPI與 GSPE按質量比(w/w)為16:1(4%)制備基料,對該基料及天然SPI分別在5種不同的擠壓溫度下進行處理:40、60、80、100、120 ℃,雙螺桿擠出機的擠出參數設置為:進料速度8 kg/h,螺桿速度250 r/min。采用電磁加水泵以8.54 L/h的輸入速率向擠壓機中加水,并使各桶區含水率保持在55%。擠出機有10個獨立的加熱區。在本試驗中,第一區至第五區機筒溫度保持25 ℃不變,采用五區進料,將第六至第十區筒體擠壓溫度同時設置為40、60、80、100、120 ℃。擠壓后獲得5種擠壓溫度的試樣,在冷凍干燥機中凍干18 h,并研磨過80目篩(直徑=0.178 mm)進行下一步試驗(以上擠壓機參數及多酚添加量均根據前期預試驗所得)。
1.3.2 SPI、SPI-GSPE復合物指標的測定
1)溶解度的測定
配置0.01g/mL蛋白溶液10 mL并通過磁力攪拌1.5 h,然后在7 000 r/min離心20 min,通過雙縮脲法測得上清液中蛋白質質量。蛋白質的溶解度按下式計算:

1.發動機 2.變速箱 3.喂料口 4.注水口 5.螺桿 6.加熱區 7.模頭區
1.Motor 2.Gearbox 3.Feeding zone 4.Water filling nozzle 5.Screw 6.Heating zone 7.Die zone
圖1 擠壓機示意圖
Fig.1 Schematic diagram of extruder
2)乳化性及乳化穩定性的測定
根據文獻[10]的方法稍作修改,配置2 mg/mL SPI溶液30 mL,加入10 mL大豆油混勻。使用高速分散機在10 000r/min轉速下均質1min后,立即和10 min后取溶液底部的40L乳液,將其加入5 mL質量分數為0.1% SDS溶液中,混合均勻,使用分光光度計測定波長為500 nm處的吸光值,分別記為0和1。乳化活性指數(Emulsifying Activity Index,EAI)及乳化穩定性指數(Emulsion Stability Index,ESI)按下式計算:
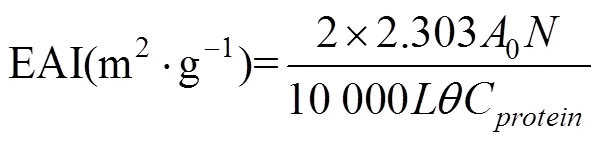
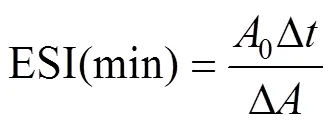
式中為稀釋倍數;為油脂占總數的比例;為光路長度,cm;C為蛋白質濃度,g/mL;0為初始吸光值;為間隔時間,min;為吸光度差值。
3)持水性的測定
采用文獻[11]的方法稍加修改,配置20 mg/mL SPI溶液10 mL,蛋白與離心管總質量記為1(g)。渦旋震蕩1 min后進行7 000 r/min離心10 min,用濾紙將離心管上層的水吸出,離心管及剩余沉淀總質量記為2(g)。持水性按下式計算:
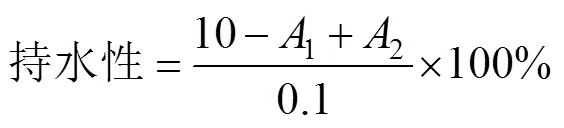
4)粒度及-電位
用去離子水配置10 mL質量分數為0.01%的蛋白溶液,磁力攪拌0.5 h,通過分子粒度儀及Zeta電位分析儀對蛋白粒度大小分布及-電位進行測定。
5)表面疏水性
依據Shi等[12]的方法并適當修改,8 mmol/L ANS貯備液和10 mg/mL蛋白溶液均用磷酸鹽緩沖液(0.1 mol/L,p H值7.0)制備。蛋白溶液在8 000 r/min離心10 min,蛋白濃度按梯度稀釋為0.005~0.500 g/L之間,將50L ANS與5 mL多酚蛋白混合物溶液混合均勻。設置熒光光譜的測定條件:激發波長及發射波長分別設為390 nm和470 nm,狹縫5 nm,掃描速率20 nm/s。表面疏水性指數是通過計算熒光指數相對于蛋白濃度的初始斜率而獲得的。
6)持油性的測定
采用文獻[13]的方法并加以修改,稱取0.1 g大豆分離蛋白裝入50 mL離心管中,離心管及蛋白總質量記為1(g)。向離心管中加入5 mL的色拉油,充分混合均勻后,在4 000 r/min離心15 min,將上層清液倒出,并將附著在離心管壁內外的所有油滴擦拭干凈后,記錄此時離心管及剩余沉淀的總質量為2(g)。持油性按以下公式計算:
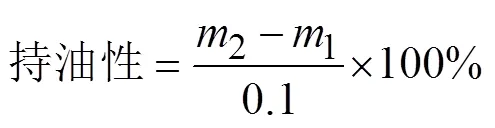
7)二級結構的測定
將完全干燥的樣品與溴化鉀粉末按照1:100的比例均勻混合后,經瑪瑙研缽研磨后進行壓片處理,光譜記錄在400~4 000 cm-1的范圍內,掃描次數32次。使用Peakfit Version 4.12 軟件進行分析,對酰胺Ⅰ帶(1 700~1 600 cm-1)處進行二階導數擬合,計算蛋白的二級結構。
8)熒光光譜的測定
使用熒光分光光度計對蛋白的熒光光譜進行測定。將蛋白進行適當稀釋。設置熒光光譜的測定條件:激發波長及掃描波長分別為290 nm,300~500 nm,狹縫寬為5 nm。
1.4 數據處理
采用IBM SPSS Statistics 25軟件進行數據處理,PeakFit v4.12軟件進行紅外擬合,Origin 2021軟件作圖。
2 結果與分析
2.1 溶解度
溶解度是蛋白質最重要的性質之一,它對其他功能特性有直接影響。表1為擠壓溫度(40、60、80、100和120 ℃)對SPI及SPI-GSPE復合物溶解度的影響。擠壓后SPI的溶解度顯著降低(<0.05)。這可能是由于蛋白質的疏水基團之間熱誘導形成不溶性聚集體[14]。當擠壓溫度從40 ℃升至80 ℃時,SPI及SPI-GSPE溶解度均增加。這可能是由于蛋白質在擠壓機作用下,蛋白質分子展開及二硫鍵的斷裂使蛋白質與水的相互作用增強。80 ℃后,SPI及SPI-GSPE溶解度均顯著降低(<0.05),這可能是由于SPI中的蛋白組分在高溫高壓高剪切的處理下,甘氨酸的堿性亞基與-伴球蛋白的-亞基之間形成了難以溶解的聚集體,這降低了蛋白的溶解度。Silva等[15-16]也有相關研究也得出類似結論。
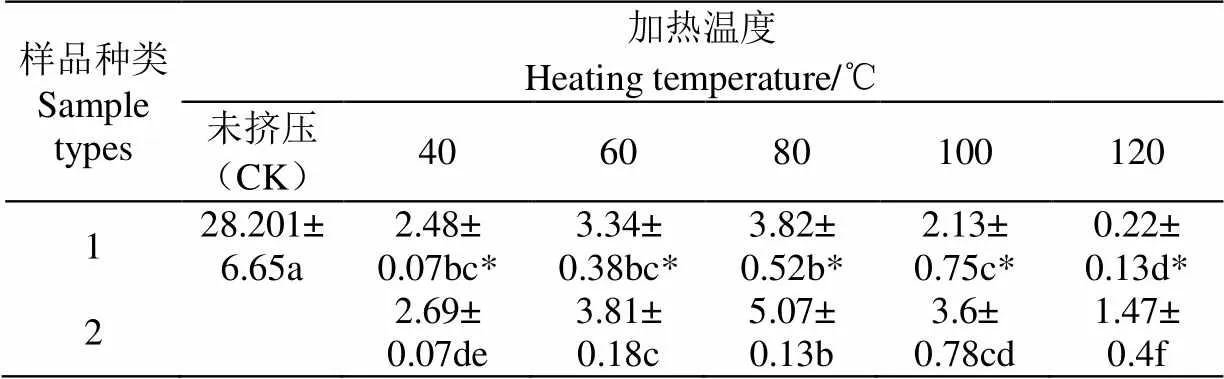
表1 不同擠壓溫度下SPI及SPI-GSPE復合物溶解度
注:樣品1為大豆分離蛋白(Soy Isolate Protein,SPI)。樣品2為大豆分離蛋白與葡萄籽原花青素復合物(Soy Isolate Protein -Grape Seed Proanthocyanidin Extract,SPI-GSPE)。字母a、b、c…為不同擠壓溫度下及未擠壓SPI或SPI-GSPE顯著性分析結果,*為擠壓后SPI及SPI-GSPE復合物組間有顯著差異(<0.05)(下同)
Note: Sample 1 was Soy Isolate Protein (SPI). Sample 2 was Soy Isolate Protein-Grape Seed Proanthocyanidin Extract (SPI-GSPE).The letters a, b, c... is the significant analysis results of SPI or SPI-GSPE at different extrusion temperatures and without extrusion, * is the difference between groups of SPI and SPI-GSPE complex after extrusion (<0.05) (the same below).
由表1可知,不同溫度下,較擠壓SPI,SPI-GSPE復合物蛋白溶解度顯著提高(<0.05)。這可能是由于GSPE與SPI疏水基團作用,且原花青素分子上的羥基一部分與水形成氫鍵,間接增強了大豆分離蛋白的水合作用,故而在一定程度上增大了溶解度。胡湘蜀[17]也報道了茶多酚可提高SPI的溶解性。
2.2 乳化性
乳化活性指數(Emulsifying Activity Index,EAI)和乳化穩定性指數(Emulsion Stability Index,ESI)分別代表了蛋白質在油水界面形成和穩定乳化液的能力,這對各種傳統食品和新型食品的開發至關重要。由圖2可知,擠壓后SPI及SPI-GSPE復合物的EAI高于未擠壓SPI。隨擠壓溫度的增加,SPI的EAI增加。SPI-GSPE復合物的EAI在擠壓溫度40~80 ℃隨著溫度的升高而增加。這可能是因為蛋白質雖經過擠壓后溶解度下降,但是乳液制備過程中均質施加的機械力破壞了分子間相互作用,并暴露了蛋白質表面下的疏水基團。蛋白質表面活性得到了提高,從而導致EAI的提升[18]。此后隨著溫度的升高(80~120 ℃),SPI-GSPE復合物EAI降低,這可能是由于GSPE在高溫下部分降解,從而導致其EAI下降。李明月[19]研究表明,過高的溫度可使原花青素氧化聚合從而導致其含量降低。
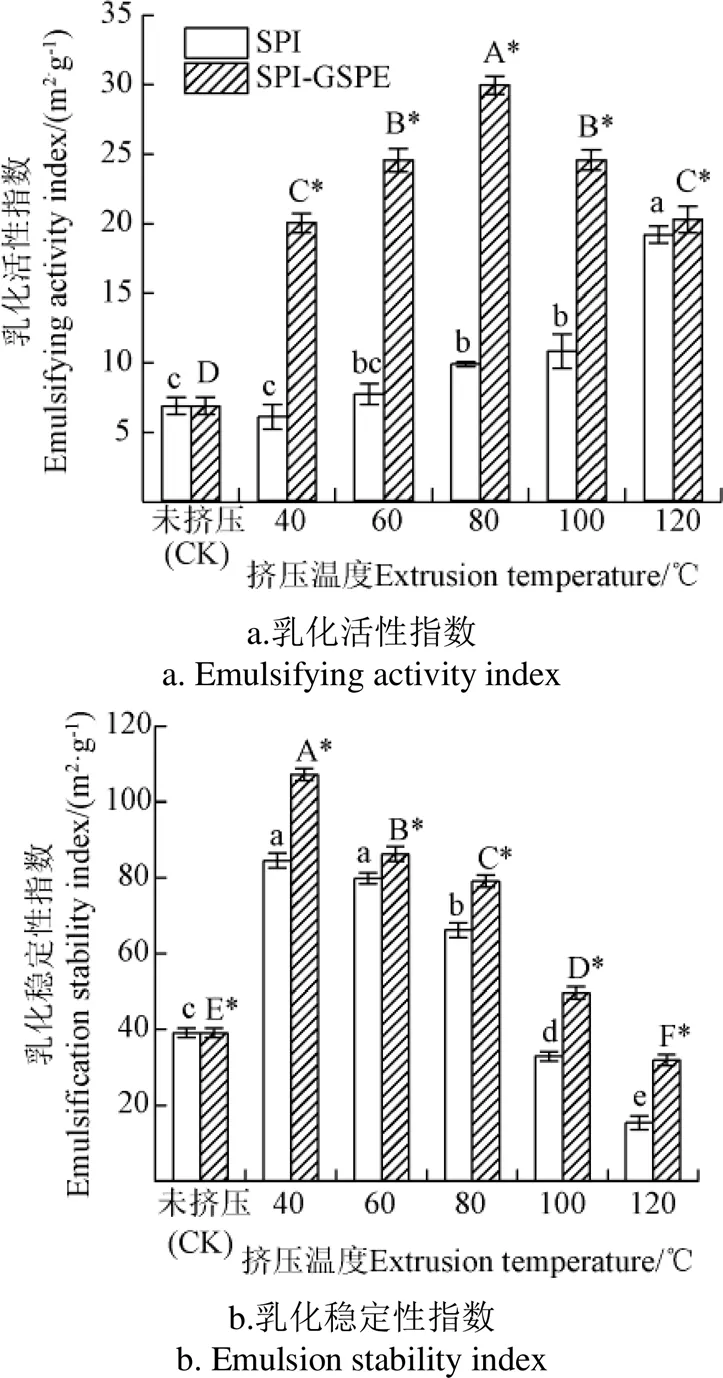
注:大寫字母A、B、C…為不同擠壓溫度下SPI-GSPE顯著性分析結果(下同)(P<0.05)。
由圖2可知,擠壓SPI的ESI高于未擠壓SPI,這可能是由于擠壓及均質對蛋白結構造成破壞而暴露出的疏水基與油性物質交聯可形成脂肪球,而親水基和水分子結合包裹在脂肪球表面可以提高乳液的穩定性。隨著溫度的提高,SPI及SPI-GSPE復合物ESI顯著降低(< 0.05)且擠壓SPI于100℃后低于未擠壓蛋白,這可能是因為熱能輸入和機械剪切破壞了蛋白質結構,導致蛋白質變性和展開,從而形成小分子肽和游離氨基酸[20]。已知較小的肽在穩定乳液方面的效率較低,因為由于電荷排斥和表面疏水性,肽可能不容易團聚產生脂肪球膜。擠壓過程中形成的較小肽被認為是ESI降低的主要原因。
由圖2所示,SPI的EAI和ESI均通過與GSPE結合而顯著增加(<0.05),這可能是由于SPI與GSPE結合后,蛋白的構象和界面行為發生了改變。Karefyllakis等[21]也發現,酚類化合物對蛋白質的界面和乳化特性有積極的影響。這可能是由于隨著GSPE的加入,界面膜的表面壓力和粘彈性被增強,導致界面膜更加穩定,從而增加了SPI-GSPE復合物的EAI及ESI。
2.3 表面疏水性
表面疏水性定義為非極性基團與極性溶液在蛋白質表面接觸的數量。未擠壓SPI的表面疏水性指數(0)(<0.05)顯著低于擠壓SPI(圖3)。這可能是由于擠壓過程中,SPI在高壓和高剪切力作用下暴露出一些疏水性氨基酸殘基,從而導致其表面疏水性增加[22]。隨著擠壓溫度的升高,0先降低后升高,這可能是由于擠壓時蛋白質通過疏水相互作用而聚集,從而使疏水點大部分被限制在聚集物內部。在80 ℃達到最低值,之后隨著溫度的升高而升高。這一趨勢反映了在較高溫度條件下,擠壓過程可能導致聚集物或蛋白質發生部分解離現象。如圖3所示,不同溫度下,SPI-GSPE復合物的0值相較于SPI顯著降低(<0.05)。這可能是由于GSPE與SPI的相互作用引起了蛋白的結構改變,蛋白內部的部分親水區域暴露,從而導致蛋白的疏水性降低。Nguela等[23]研究中也有相似結論。
2.4 擠壓熱處理對SPI-GSPE復合物ζ-電位的影響
-電位代表了蛋白質分散穩定性,其絕對值越高表明該體系越穩定。所有樣品的-電位(表面電荷)值如圖4所示,擠壓處理顯著降低了SPI表面電荷絕對值(<0.05),且隨著溫度的升高而降低;這表明SPI在擠壓過程中發生的變性導致了分子表面負電荷基團的減少,從而降低了-電位絕對值。除120 ℃外,隨著GSPE的加入,蛋白的-電位絕對值顯著提高(<0.05),表明SPI和GSPE形成了表面有更多的陰離子基團的復合物,SPI-GSPE具有較強的物理穩定性,因為SPI與GSPE之間較強的靜電斥力會抑制它們的聚集和沉降[24]。
2.5 粒徑
蛋白質粒徑的大小對蛋白功能性質至關重要。圖5表明,經過擠壓處理后SPI的曲線向右側移動,擠壓后蛋白粒徑提高且隨著溫度的提高而增大(40~80 ℃),這可能是由于蛋白質的疏水基團之間熱誘導形成聚集體,然后在80 ℃團聚。隨著溫度的繼續升高,由于蛋白質的分解和降解,顆粒尺寸減小[25]。可以觀察到,在不同溫度下加入GSPE后,SPI-GSPE復合物粒徑相較于擠壓后的SPI顯著降低(<0.05)。這可能是由于SPI與GSPE相互作用的增強。擠壓熱處理導致蛋白質結構的變性和重排,暴露了隱藏的疏水氨基酸殘基,并解開了多肽鏈,從而大大加強了SPI與GSPE的相互作用,形成了更加致密的復合物[26]。
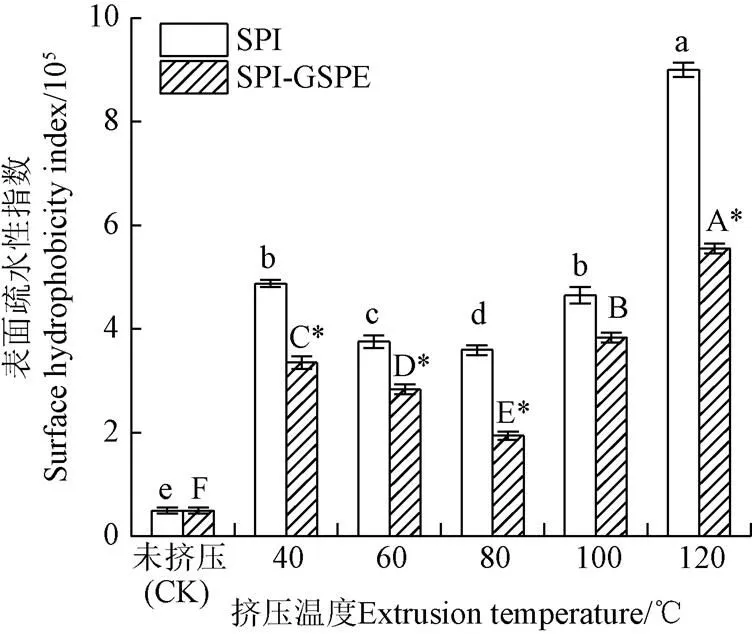
圖3 不同擠壓溫度下SPI及SPI-GSPE復合物疏水性
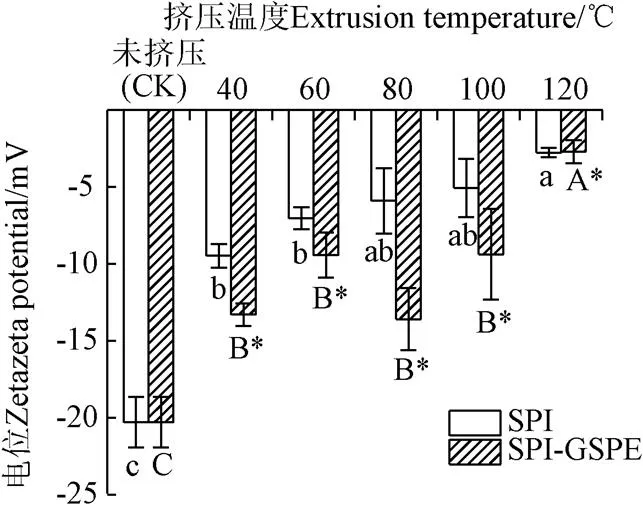
圖4 不同擠壓溫度下SPI及SPI-GSPEζ-電位
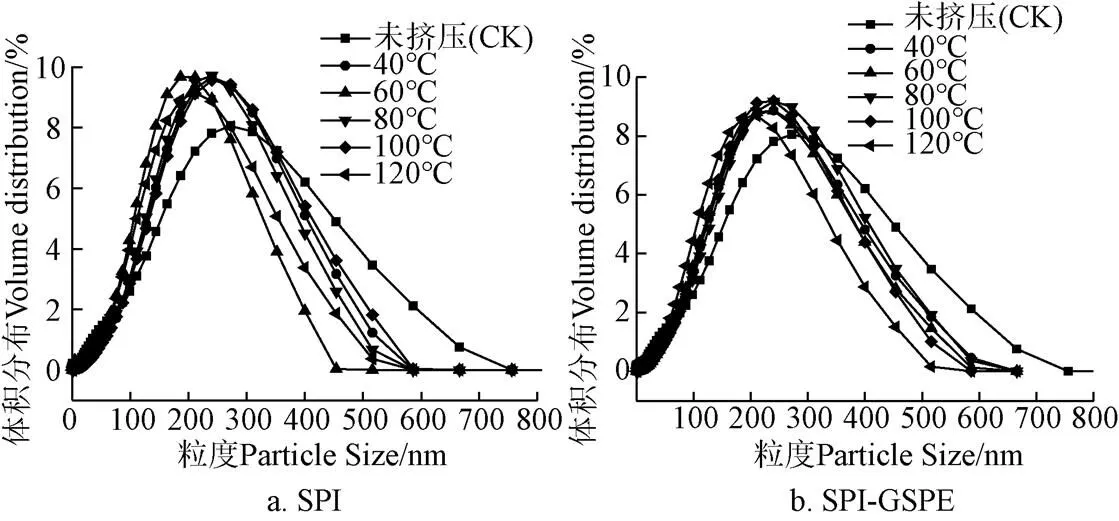
圖5 不同擠壓溫度下SPI及SPI-GSPE粒徑分布
2.6 持水性及持油性
圖6顯示了不同擠壓溫度(40、60、80、100和120 ℃)下SPI和SPI-GSPE的持水性。隨著擠壓溫度的升高,SPI及SPI-GSPE復合物的持水能力均降低。這可能是由于蛋白經過擠壓處理后,其疏水基團暴露導致水結合位點減少,持水性降低[27]。與SPI相比,隨著GSPE的加入,蛋白的持水性顯著提高(<0.05),這可能是由于GSPE的活性基團通過氫鍵和疏水鍵等非共價鍵與SPI連接,形成可溶性的聚集體,氫鍵和范德華力的相互作用力可以使水分子進入蛋白內部,從而SPI的持水性得到提高[28]。
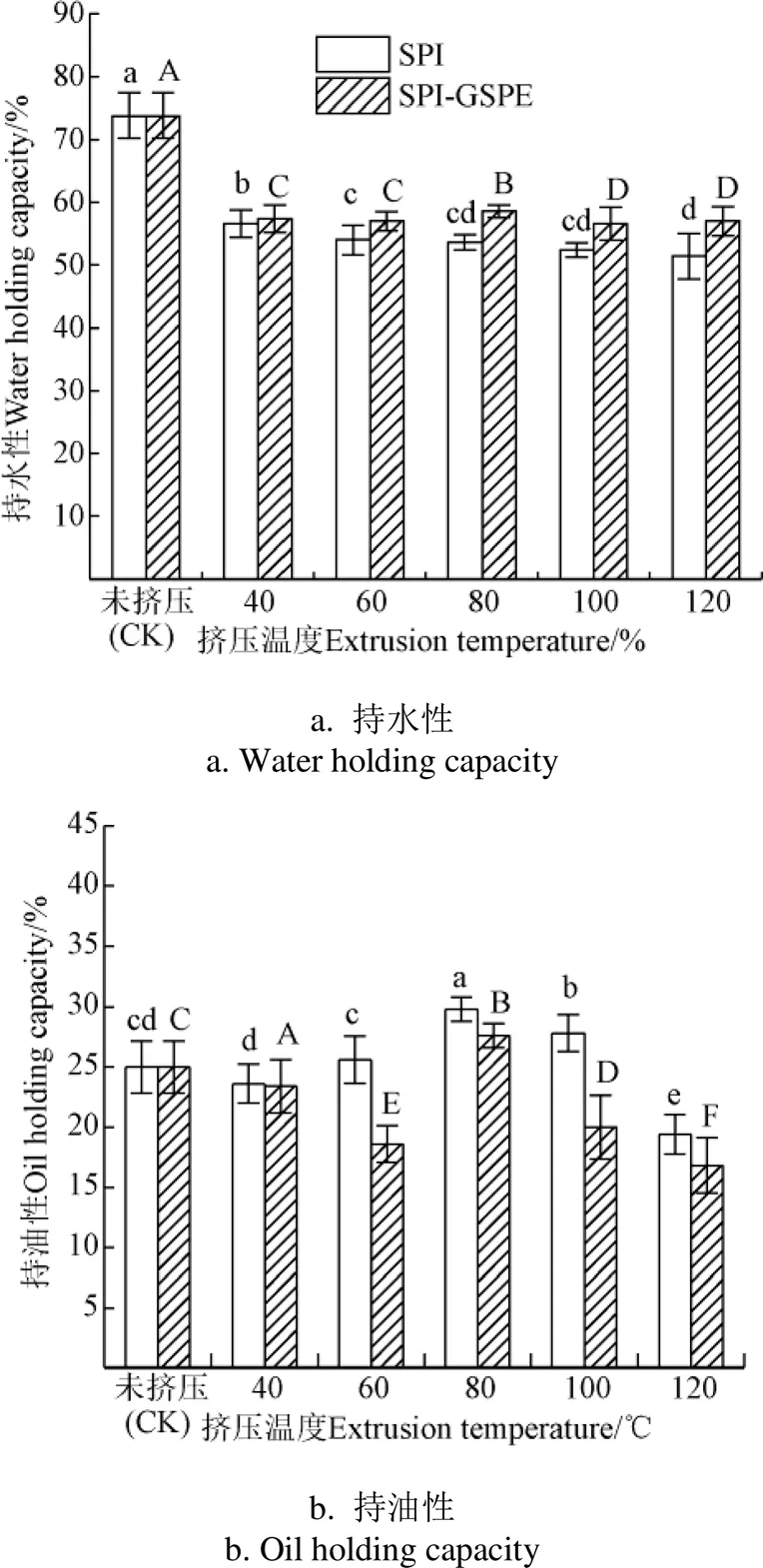
圖6 不同擠壓溫度下SPI及SPI-GSPE持水性及持油性
持油性在食品加工中的應用也是重要的指標。圖6顯示的是不同擠壓溫度對SPI的持油性的影響。SPI擠壓后持油性變化不大。隨著溫度的升高,擠壓SPI持油性先升高后降低,并在80 ℃時達到最大值。這可能與親脂性位點的增加有關。經過擠壓處理后,蛋白質的結構遭到破壞,導致溶劑接觸環境的極性表面所不能接觸到的部位暴露。露出的疏水基團能與更多脂肪相互作用,因此増加了蛋白質的持油性[29]。溫度在80 ℃后,持油性的降低可能歸因于新的分子間鍵、結構和不溶性蛋白質復合物的形成。加入GSPE后,除40 ℃和80 ℃外,其余溫度下蛋白持油性均顯著下降(<0.05),這可能是由于隨著SPI與GSPE的相互作用,兩者形成不可溶復合物,蛋白與脂質結合能力下降,蛋白持油性下降[30]。
2.7 熒光光譜
蛋白質其色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)殘基,被認為具有固定的發射熒光。激發波長為280 nm時,可以忽略苯丙氨酸。圖7為不同擠壓溫度下SPI的內源熒光光譜和最大吸收波長(max)。max與色氨酸殘基所處微環境有關,max大于330 nm表明色氨酸殘基暴露于蛋白質分子外部的極性環境中,max越大色氨酸殘基的微環境極性越強[31]。
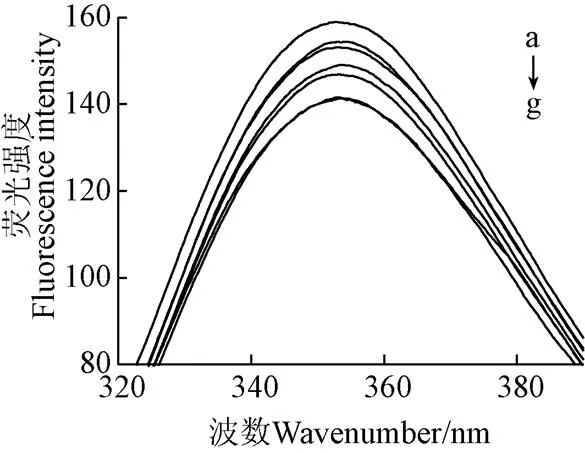
注:a為擠壓溫度為80 ℃的SPI-GSPE復合物,b→f分別為擠壓溫度為80、60、100、120、40 ℃的SPI,g為未擠壓SPI。
未經擠壓處理的SPI表現出最低水平的熒光強度。溫度處于40 ℃時,SPI熒光強度與未擠壓SPI無顯著性差異,隨著擠壓溫度的提高(40~80 ℃),熒光強度呈現升高的趨勢,并使得SPI的max從353.2 nm紅移至354.5 nm,這表明色氨酸殘基周圍環境趨于極性,同時使SPI三級結構變的松散。這可能是由于經過擠壓處理后,蛋白質結構被破壞。隨著溫度的升高(80~120 ℃),熒光強度呈現下降的趨勢,且max藍移1.4 nm至353.1 nm。這可能是由于在高溫高剪切的作用下,蛋白的空間結構更緊密,發色基團被掩埋。如圖7所示,在80 ℃時,隨著GSPE的加入,蛋白質最大發射峰max發生輕微藍移,使其從354.5 nm藍移至353.4 nm,這意味著蛋白中熒光團殘基的周圍環境在加入GSPE后變得普遍趨于非極性,即GSPE對蛋白構象產生了一定的影響。Li等[32]發現原花青素會導致牛血清蛋白熒光光譜藍移,與本試驗結果一致。
2.8 紅外光譜
利用FT-IR進一步表征不同擠壓溫度對SPI及SPI-GSPE復合物的二級結構影響(圖8)。酰胺I帶和酰胺II帶的光譜位移代表著蛋白質二級結構的改變,酰胺A(3 600~3 300 cm-1)位置的峰強度通常可以表示SPI分子內部及其分子間-H、O-H、C-H鍵伸縮振動的強度[33]。隨著溫度不斷升高(40~80 ℃),在2 932 cm-1位置的峰呈現震動,這說明擠壓熱處理對SPI分子內的C-H 鍵產生了一定的影響。當擠壓溫度達到80 ℃時,可以看到波數在3 000 cm-1左右發生明顯變化,該區主要為C-H伸縮振動區,表明當擠壓溫度達到80 ℃時,蛋白質開始發生變性。除此之外,酰胺A帶(3 300 cm~3 400 cm-1)伸縮振動也可用于佐證蛋白質與多酚結合后復合物二級結構的變化。酰胺Ⅰ帶(1 700~1 600 cm-1)可以體現蛋白二級結構的改變。研究表明[34],蛋白質二級結構與各吸收峰間波數的對應關聯為:-螺旋:1 646~1 664 cm-1;-折疊:1 615~1 637 cm-1和1 682~1 700 cm-1;-轉角:1 664~1 681 cm-1;無規卷曲:1 637~1 645 cm-1。如圖8所示,隨著GSPE的添加,SPI酰胺I帶(1 700~1 600 cm-1)的吸光度下降,并且其紅外吸收峰發生藍移,這表明SPI通過與GSPE的相互作用使蛋白的二級結構發生了改變。
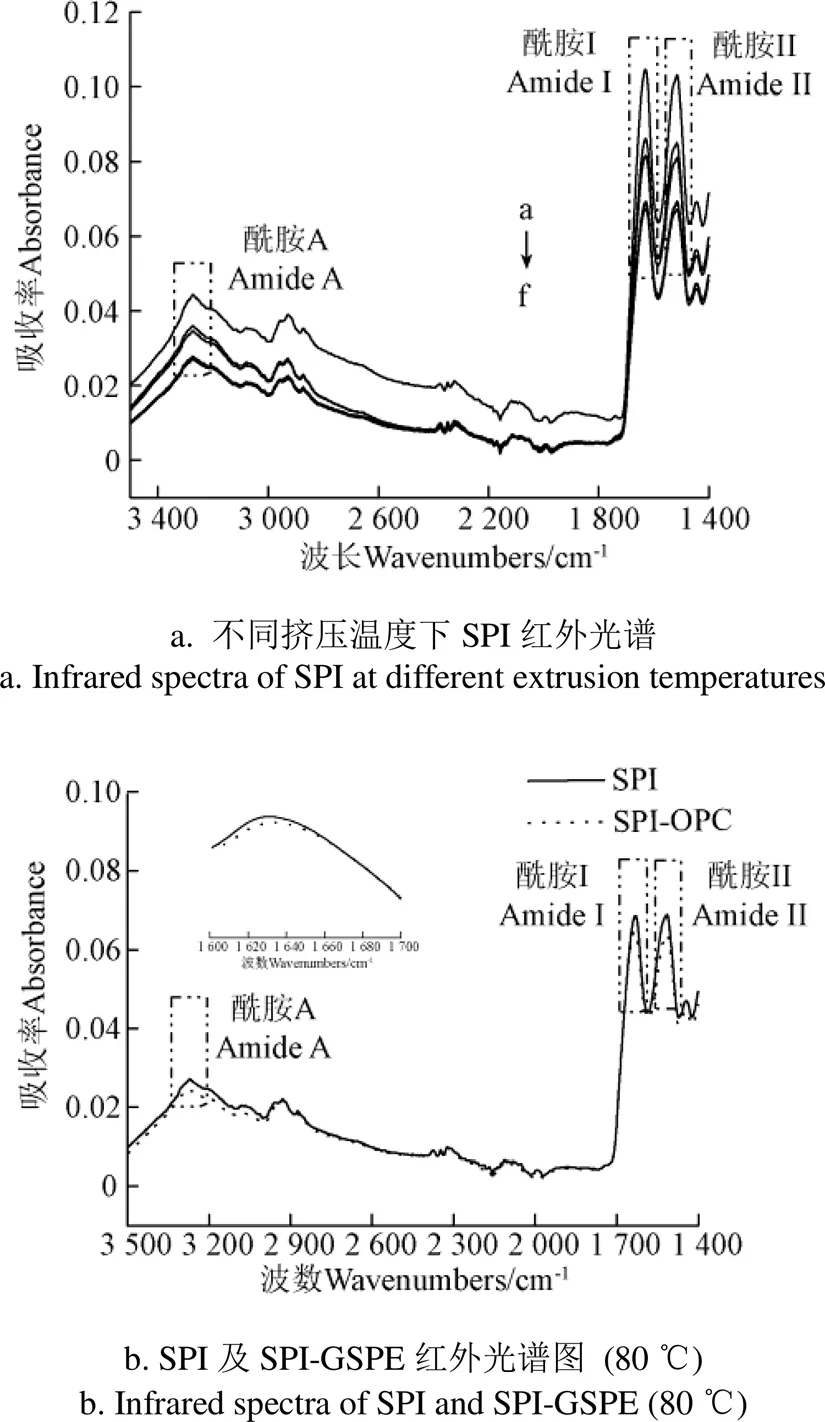
注:a為未擠壓SPI、b→f分別為擠壓溫度在120、100、80、40、60 ℃的SPI。
同時計算得出蛋白質二級結構不同種類的含量,結果見表2。
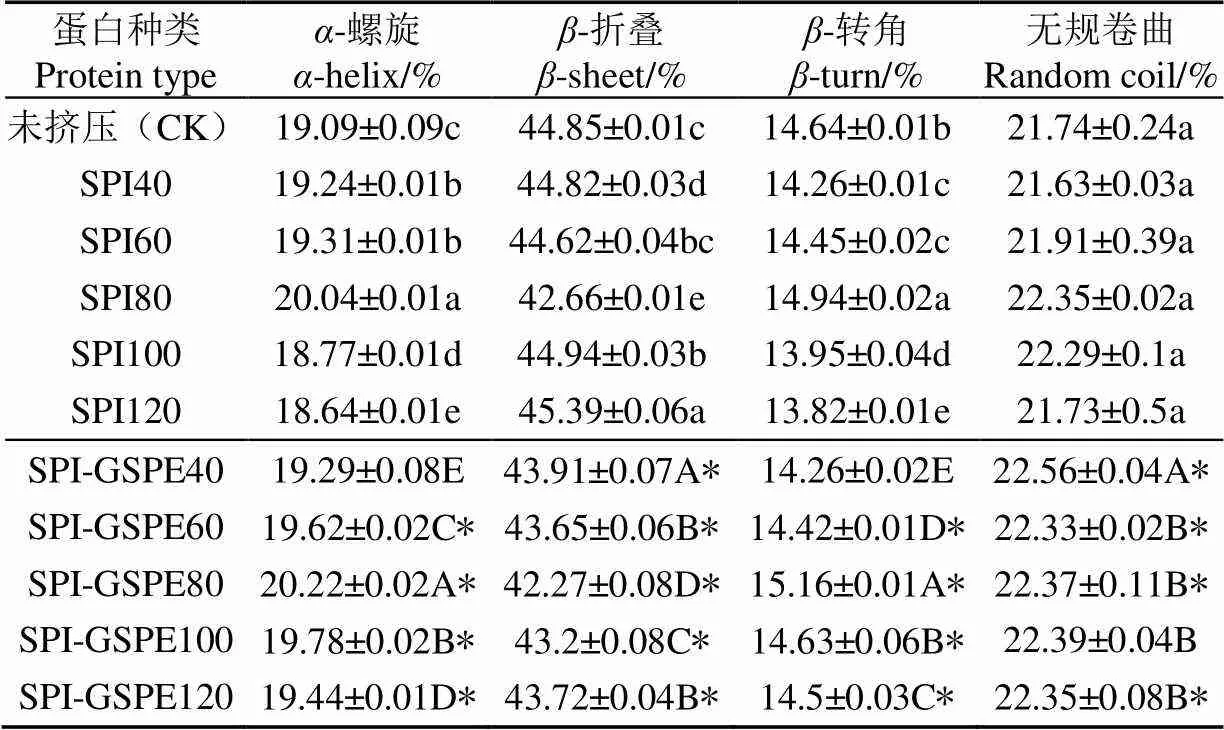
表2 SPI及SPI-GSPE復合物的二級結構含量
注:SPI40為擠壓溫度40 ℃下的SPI;*為擠壓后SPI及SPI-GSPE復合物組間有差異性。
Note: SPI40 is SPI at extrusion temperature of 40 ℃; * is SPI after extrusion and SPI-GSPE complex has differences among groups.
數據表明,SPI的二級結構主要是以-折疊為主,這與Plietz等[35]研究結果一致。蛋白二級結構經過不同擠壓溫度處理后,各成分含量有明顯變化。在第一階段(40~80 ℃)螺旋、-轉角及均呈現增加的趨勢,且于80 ℃達到最大值,-折疊呈現遞減的趨勢,無規卷曲變化不大。表明-折疊結構轉化為-螺旋及-轉角結構。李楊等[36]研究80 ℃以上處理SPI也得出相似結論。隨著溫度的提高(80~120 ℃),-螺旋及-轉角結構呈現降低的趨勢,而-折疊呈上升趨勢,這可能是由于SPI全部變性,其他二級結構轉變為-折疊結構,而-折疊結構含量反映了蛋白疏水位點的暴露程度[37]。
如表2所示,與擠壓SPI相比,所有添加GSPE樣品的SPI的二級結構含量都發生了改變,其中-螺旋、無規則卷曲及-轉角含量顯著升高(<0.05),可能是由于GSPE與SPI間的氫鍵作用引起的。
3 結 論
本試驗探究了擠壓熱處理SPI與SPI-GSPE復合物對蛋白結構與功能性質的影響。結果表明:
1)相較于未擠壓大豆分離蛋白(Soy Isolate Protein,SPI),擠壓SPI的乳化活性指數(EmulsifyingActivity Index,EAI)、表面疏水性及粒徑均顯著提高(<0.05),其溶解度、-電位絕對值、持水性顯著下降(<0.05),SPI乳化穩定性指數(Emulsion Stability Index,ESI)經過擠壓處理后顯著提升,但當溫度超過80 ℃時,SPI的ESI低于未擠壓SPI。
2)不同溫度下,葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)的加入使得擠壓熱處理SPI的-電位絕對值增大,復合物粒徑變小,EAI、ESI、持水性及溶解度增強,但表面疏水性、持油性有所下降。
3)隨著溫度升高(40~80 ℃),SPI-GSPE復合物的溶解度、EAI、粒徑顯著增大(<0.05),其ESI、表面疏水性、及-電位絕對值顯著減小(<0.05),當溫度進一步升高(80~120 ℃),SPI-GSPE復合物表面疏水性顯著增大(<0.05),其EAI、ESI、溶解度、-電位絕對值、粒徑、及持油性均顯著降低(<0.05)。
4)熒光光譜結果表明與GSPE的復合使得蛋白質內部結構中的發色基團所處的微環境極性提高,蛋白結構發生變化。
5)紅外光譜結果顯示隨著GSPE的加入,蛋白-螺旋、-轉角及無規卷曲含量均提高,SPI與GSPE在擠壓過程中通過疏水相互作用結合。隨著擠壓溫度的升高,螺旋、-轉角至80 ℃達到最大值。-折疊結構轉化為-螺旋及-轉角結構。以上結果表明擠壓溫度達到80 ℃時,結構和功能性質較好。本研究結果闡明了不同擠壓溫度對SPI-GSPE復合物功能性質及結構影響,為進一步改善SPI的功能性質,使其更好地應用于食品工業生產提供了一定的理論基礎。
[1] Rani P, Yu X, Liu H, et al. Material, antibacterial and anticancer properties of natural polyphenols incorporated soy protein isolate: A review[J]. European Polymer Journal, 2021, 152:110494.
[2] 江連洲,楊宗瑞,任雙鶴,等. 空化射流對大豆分離蛋白結構及乳化特性的影響[J]. 農業工程學報,2021,37(3):302-311.
Jiang Lianzhou, Yang Zongrui, Ren Shuanghe, et al. Effect of cavitation jet on structure and emulsification properties of soybean protein isolate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(3): 302-311. (in Chinese with English abstract)
[3] Qi Q, Chu M, Yu X. Anthocyanins and proanthocyanidins: Chemical structures, food sources, bioactivities, and product development[J/OL]. Food Reviews International, [2022-09-10], https://doi.org/10.1080/87559129.2022.2029479
[4] Hasni I, Bourassa P, Hamdani S, et al. Interaction of milk-and-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2): 630-639.
[5] Relkin P, Shukat R. Food protein aggregates as vitamin-matrix carriers: Impact of processing conditions[J]. Food Chemistry, 2012, 134(4): 2141-2148.
[6] Rawel H M, Czajka D, Rohn S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(34): 137-150.
[7] Tsai P J, She C H. Significance of phenol- protein interactions in modifying the antioxidant capacity of peas[J]. Journal of Agricultural and Food Chemistry, 2006, 54(22): 8491-8494.
[8] Yu X, Zhang J, Wang L, et al. Changes in physicochemical properties and structural characteristics of rice starch during extrusion processing: The role of glutelin and different extrusion zones[J]. Innovative Food Science & Emerging Technologies, 2022, 82: 103163.
[9] Toro-Uribe S, Lo?pez-Giraldo L J, Decker E A. Relationship between the physiochemical properties of cocoa procyanidins and their ability to inhibit lipid oxidation in liposomes[J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4490-4502.
[10] Aat A, Aus B. The replacement of cereals by legumes in extruded snack foods: Science, technology and challenges[J]. Trends in Food Science & Technology, 2021, 116: 701-711.
[11] 肖志剛,王依凡,王可心,等. 高壓均質-冷凍干燥技術制備大豆分離蛋白微粒及其功能特性[J]. 農業工程學報,2021,37(13):306-313.
Xiao Zhigang, Wang Yifan, Wang Kexin, et al. Preparation and functional properties of soybean protein isolated particles by high pressure homogenization-freeze drying[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(13): 306-313. (in Chinese with English abstract)
[12] Shi R, Li T, Li M, et al. Consequences of dynamic high-pressure homogenization pretreatment on the physicochemical and functional characteristics of citric acid-treated whey protein isolate[J]. LWT- Food Science and Technology, 2021, 136: 110303.
[13] Huang Y L, Ma Y S. The effect of extrusion processing on the physiochemical properties of extruded orange pomace[J]. Food Chemistry, 2016, 192: 363-369.
[14] 許艷華,趙光遠,敬思群,等. 高壓微射流對大豆分離蛋白化學性質及結構的影響[J]. 食品工業,2018(3):44-48.
Xu Yanhua, Zhao Guangyuan, Jing Siqun, et al. Effects of high pressure microjet on chemical properties and structure of soybean protein isolate[J]. Food Industry, 2018(3): 44-48. (in Chinese with English abstract)
[15] Silva A, Areas E, Silva M A, Effects of extrusion on the emulsifying properties of rumen and soy protein[J]. Food Biophysics, 2010, 5(2): 94-102.
[16] Wagner J R, Sorgentini D A, A?ón M C. Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepared soy protein isolates[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3159-3165.
[17] 胡湘蜀. 茶多酚組分解析及其與大豆分離蛋白相互作用的研究[D]. 無錫:江南大學,2015.
Hu Xiangshu. Analysis of Tea Polyphenols and Their Interaction With Soybean Protein Isolate[D]. Wuxi: Jiangnan University, 2015. (in Chinese with English abstract)
[18] Mozafarpour R, Koocheki A, Milani E, et al. Extruded soy protein as a novel emulsifier: Structure, interfacial activity and emulsifying property[J]. Food Hydrocolloids, 2019, 93: 361-373.
[19] 李明月. 山葡萄籽原花青素的高壓脈沖電場提取及其穩定性與抗氧化活性[D]. 長春:吉林大學,2017.
Li Mingyue. Extraction of Proanthocyanidins From Grape Seeds Under High Pressure Pulsed Electric Field and its Stability and Antioxidant Activity[D]. Changchun: Jilin University, 2017. (in Chinese with English abstract)
[20] Ma W, Qi B, Rokayya S, et al. Conformational and functional properties of soybean proteins produced by extrusion-hydrolysis approach[J]. International Journal of Analytical Chemistry, 2018, 2018:1-11.
[21] Karefyllakis D, Altunkaya S, Berton-Carabin Claire C, et al. Physical bonding between sunflower proteins and phenols: Impact on interfacial properties[J]. Food Hydrocolloids, 2017, 73: 326-334.
[22] Condés M C, Afión M C, Mauri A N. Amaranth protein films prepared with high-pressure treated proteins[J]. Journal of Food Engineering, 2015, 166: 38-44.
[23] Nguela J M, Vernhet A, Sieczkowski N, et al. Interactions of condensed tannins with saccharomyces cerevisiae yeast cells and cell walls: Tannin location by microscopy[J]. Journal of Agricultural & Food Chemistry, 2015, 63(34): 7539-7545.
[24] Chen F L, Wei Y M, Zhang B, et al. System parameters and product properties response of soybean protein extruded at wide moisture range[J]. Journal of Food Engineering, 2010, 96(2): 208-213.
[25] Chen Y, Zhang R, Xie B, et al. Lotus seedpod proanthocyanidin-whey protein complexes: Impact on physical and chemical stability of-carotene- nanoemulsions[J]. Food Research International, 2019, 127(4): 108738.
[26] Ren C, Xiong W, D Peng, et al. Effects of thermal sterilization on soy protein isolate/polyphenol complexes: Aspects of structure, in vitro digestibility and antioxidant activity[J]. Food Research International, 2018, 112: 284-290.
[27] Tehrani M M, Ehtiati A, Azghandi S S. Application of genetic algorithm to optimize extrusion condition for soybased meat analogue texturization[J]. Journal of Food Science & Technology, 2017, 54(5): 1119-1125.
[28] Xu J, Guo S, Li X, et al. Gel properties of transglutaminase- induced soy protein isolate-polyphenol complex: Influence of epigallocatechin-3-gallate[J]. Journal of the Science of Food and Agriculture, 2021 Jul; 101(9): 3870-3879.
[29] 段慶松,段玉敏,肖志剛,等. 擠壓穩定化處理對米糠各組分蛋白結構及功能性質的影響[J]. 農業工程學報,2020,36(19):283-290.
Duan Qingsong, Duan Yumin, Xiao Zhigang, et al. Effects of extrusion stabilization on protein structure and functional properties of rice bran components[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(19): 283-290. (in Chinese with English abstract)
[30] 岳鑫. 紅松種鱗多酚穩定性及其與乳清蛋白相互作用的研究[D]. 哈爾濱:東北林業大學,2019.
Yue Xin. Study on Stability of Polyphenols and Their Interaction with Whey Protein of Korean Pine Seed Scale[D]. Harbin: Northeast Forestry University, 2019. (in Chinese with English abstract)
[31] Ulrih N P. Analytical techniques for the study of polyphenol-protein interactions[J]. Critical Reviews in Food Science & Nutrition, 2017, 57(10): 2144-2161.
[32] Li X, Wang G, Chen D, et al. Interaction of procyanidin B3 with bovine serum albumin[J]. Rsc Advances, 2014, 4(14): 7301-7312.
[33] Chen Z Q, Wang C, Gao X D, et al. Interaction characterization of preheated soy protein isolate with cyanidin-3-O-glucoside and their effects on the stability of black soybean seed coat anthocyanins extracts[J]. Food Chemistry,2019, 271: 266-273.
[34] Jia J J, Gao X, Hao M H, et al. Comparison of binding interaction between beta-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J]. Food Chemistry, 2017, 228: 143-151.
[35] Plietz P, Damaschun G. The structure of the 11S seed globulins from various plant species: Comparative investigations by physical methods[J]. Studia Biophysica, 1986, 116(3): 153-173.
[36] 李楊,王中江,王瑞,等. 不同熱處理條件下大豆分離蛋白的紅外光譜分析[J]. 食品工業科技,2016,37(8):104-109.
Li Yang, Wang Zhongjiang, Wang Rui, et al. Infrared spectrum analysis of soybean protein isolate under different heat treatment conditions [J]. Science and Technology of Food Industry, 2016, 37(8): 104-109. (in Chinese with English abstract)
[37] Guo Z, Teng F, Huang Z, et al. Effects of material characteristics on the structural characteristics and flavor substances retention of meat analogs[J].Food Hydrocolloids, 2020, 105(5/6): 105752.
Effects of extrusion temperature on the functional and structural properties of soybean protein isolate and proanthocyanidin complex
Wang Zhenguo, Gao Yuzhe, Shi Jiafeng, Zhang Junjie, Jiang Ruisheng, Huo Jinjie, Su Shuang, Xiao Zhigang※
(,110034,)
The interaction between macromolecules and small molecules has gradually attracted widespread interest in recent years, especially for the interaction between proteins and polyphenols in food components. Phenolic compounds are the parts of the secondary metabolites, mainly found in plant species with great structural diversity. They can exist as glycosides or aglycones, mainly composed of polymeric or monomer structures. Protein is widely found in animals and plants. In the course of food processing, the protein and polyphenols can inevitably coexist in the same system and then interact with each other, which often changes the structure of protein levels. There are some effects of the interaction between polyphenols and proteins on the functional properties of proteins, mainly including the hydration properties (water retention, viscosity, and solubility) and surface properties (foaming and emulsification). The beneficial interactions can improve the nutritional and functional properties of foods. However, the interaction between proteins and polyphenols is susceptible to a variety of factors, including internal factors (self factors, such as the structural characteristics and relative concentrations of proteins and polyphenols), and external factors (environmental factors, mainly including the solvent composition and solution parameters, such as temperature, ionic strength, and pH). The extrusion technique is a physical modification to integrate multiple unit operations, such as material mixing, homogenization, cooking, and molding. In this study, an attempt was made to clarify the effect of proanthocyanidins on the physicochemical properties of soy protein as a representative plant protein, considering the important role of proteins and phenols in health, nutrition, and food quality. Specifically, an investigation was implemented on the effects of different extrusion temperatures (40, 60, 80, 100, and 120℃) on the functional and structural properties of Soybean Protein Isolation (SPI) and Grape Seed Procyanidins Extractive (GSPE) complex. The indicators were selected as emulsifying activity index, emulsion stability index, zeta potential, and particle size. Fluorescence and infrared spectroscopy were used to analyze the functional properties and structure of SPI in the composite system. The results show that there were significantly improved solubility, emulsifying activity, emulsifying stability, absolute value of Zeta potential, and water holding capacity of SPI-GSPE composite after extrusion treatment, compared with the extruded SPI. But, there was an observable decrease in the surface hydrophobicity and oil-holding capacity of the SPI-GSPE composite. Specifically, the solubility, oil retention, and emulsification activity of SPI-GSPE composite first increased, then decreased, and finally reached the maximum at 80℃, with the increase of extrusion temperature. By contrast, the surface hydrophobicity of the SPI-GSPE composite first decreased, then increased, and finally reached the minimum at 80℃. The absolute value of Zeta potential, emulsification stability, and water retention all decreased with the increase in temperature. The particle-size analysis showed that the SPI and GSPE formed a more compact complex after extrusion. The fluorescence spectrum showed that the composite and extrusion with the GSPE were used to extend the skeleton of SPI polypeptide chain for the protein structure, indicating a significant quenching effect on the SPI fluorescence. Ir spectra showed that the non-covalent cross-linking of GSPE to SPI varied greatly in the secondary structure of proteins. The composition and extrusion with the GSPE increased the-helix, irregular crimp, and-corner contents of the SPI, but decreased the-fold contents. This finding can provide important theoretical guidance for the utilization of SPI and GSPE resources.
extrusion; structural properties; functional properties;procyanidins; soy isolate protein
10.11975/j.issn.1002-6819.2022.21.032
TS213.3
A
1002-6819(2022)-21-0279-08
王振國,高育哲,時家峰,等. 擠壓溫度對大豆分離蛋白與原花青素復合物結構和功能特性的影響[J]. 農業工程學報,2022,38(21):279-286.doi:10.11975/j.issn.1002-6819.2022.21.032 http://www.tcsae.org
Wang Zhenguo, Li Hang, Zhang Junjie, et al. Effects of extrusion temperature on the functional and structural properties of soybean protein isolate and proanthocyanidin complex[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(21): 279-286. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.21.032 http://www.tcsae.org
2022-03-29
2022-07-30
遼寧省“揭榜掛帥”科技攻關專項計劃(2021JH/104000340201)、國家自然科學基金(32072139)
王振國,研究方向為糧食油脂及植物蛋白工程。Email:wangzhenguo12216@163.com
肖志剛,博士,教授,研究方向為糧食油脂及植物蛋白工程。Email:zhigang_xiao@126.com

