非酒精性脂肪肝的繼發因素及診斷
王曉琳 謝青
近年來,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成為全世界慢性肝病的首要病因,在成年人群中全球流行率高達25%。肥胖、糖尿病、代謝綜合征等是造成NAFLD最常見的因素。2015年美國的數據顯示NAFLD導致的全因死亡率、肝臟相關的死亡率和糖尿病相關的死亡率分別為8%、36%和38%。目前歐洲和美國二大國際肝病協會診斷NAFLD之前都需要排除引起肝內脂肪沉積的繼發因素或可能的原因包括過多的酒精攝入。2020年,國際專家小組提出將NAFLD更名為代謝相關脂肪性肝病(metabolic associated fatty liver disease,MAFLD),強調了NAFLD的代謝紊亂基礎[1]。然而在臨床工作中,很多NAFLD的患者并無肥胖、糖尿病、代謝綜合征等危險因素。例如,在亞洲,非肥胖NAFLD的患病率高達19%[2]。一方面,相對于MAFLD,繼發性脂肪肝在臨床并不常見,易于忽略。對這些無明顯代謝紊亂因素的NAFLD患者病因的分析是臨床工作的一大挑戰。另一方面,由于部分繼發性脂肪肝可通過針對性的治療而得以改善,因此對繼發性脂肪肝的識別和診斷極為重要。本文綜述了繼發性NAFLD的常見因素,包括一系列病理生理因素和疾病狀態,例如丙型肝炎病毒感染(hepatitis C,HCV)相關的脂肪肝、腸道功能紊亂相關的脂肪肝等,為臨床上NAFLD患者的病因評估提供診療思路。
一、導致脂肪肝的繼發因素
(一)遺傳性疾病 一系列遺傳性疾病與脂肪肝的發生相關,包括脂代謝異常遺傳病(先天性脂肪營養不良 ,無β脂蛋白血癥(abetalipoproteinaemia, ABL), 家族性低β脂蛋白血癥 (familial hypobetalipoproteinaemia, FHBL),家族性混合型高脂血癥(familial combined hyperlipidemia, FCHL)等。
ABL是一種罕見的常染色體隱形遺傳疾病。由于MTTP基因變異,造成乳糜微粒以及VLDL組裝和分泌障礙,使得甘油三酯聚集在肝細胞內造成脂肪肝。與ABL類似,FHBL是以低密度脂蛋白(low density lipoprotein, LDL)和載脂蛋白水平減低為特征的常染色體隱性遺傳病。由于APOB100基因的突變造成肝臟無法合成VLDL,從而導致甘油三酯在肝臟的聚集以及肝細胞脂肪變性。FCHL是常染色體顯性遺傳病。由于apoB的生成過多導致肝臟合成過多的VLDL,造成肝臟脂肪以及血清脂肪水平的升高。大約50%-75%的FCHL患者具有脂肪肝。
糖原累積癥 (Glycogen storage disease, GSD)是由于先天性酶缺陷所致糖原合成和分解紊亂,從而引起肝臟腫大、低血糖、生長發育遲緩、高乳酸血癥等臨床表現。GSD的患者由于肝臟脂肪酸合成增加而易于發生肝臟脂肪沉積。
脂質營養不良以機體脂肪分布異常或缺少為特征。臨床表現包括嚴重的脂肪組織減少、胰島素抵抗、糖尿病、高胰島素血癥、高脂血癥以及NAFLD[3]。在HIV治療中如使用高效抗反轉錄病毒療法可引起獲得性脂質營養不良[4]。臨床研究發現,脂肪組織的分布異常和脂肪組織減少可促進脂肪肝的發生發展,這可能是部分非肥胖NAFLD患者潛在的發病機制。
Wilson’s病是由于銅轉運ATP酶ATP7B基因突變,造成銅無法通過膽道排泄而沉積在肝臟、神經系統等多種組織中。在肝臟,過多的銅引起線粒體氧化損傷及功能障礙,造成脂肪酸氧化減少,從而促進脂肪肝發生[5]。
此外,近年來研究發現一系列的基因變異與脂肪肝易感性以及脂肪性肝炎、脂肪肝相關肝纖維化、肝硬化以及肝細胞癌密切相關,包括PNPLA3 (patatin like phospholipase domain containing 3), TM6SF2 (transmembrane 6 superfamily member 2), MBOAT7(membrane-bound O-acyltransferase domain-containing-7), GCKR (glucokinase regulatory protein), HSD17B13 (hydroxysteroid 17-beta dehydrogenase-13) 以及MARC1 (mitochondrial amidoxime reducing component-1)等[6]。
PNPLA3與脂肪肝的發生和發展的關系已經在多項研究中被證實。PNPLA3 I148M突變與NAFLD NAS評分、肝臟炎癥以及肝臟纖維化正相關,并且是NAFLD患者發生HCC的危險因素[7]。近期的動物實驗發現,反義寡核苷酸(ASOs)或小發夾RNA介導的PNPLA3基因沉默可減少肝臟脂質沉積,減輕肝臟炎癥和纖維化[8]。針對PNPLA3進行藥物靶點研發可能會成為部分NAFLD患者的有效治療手段。
TM6SF2是另一個與NAFLD易感性相關的重要基因位點。研究發現,TM6SF2 rs58542926 C/T基因變異,由于抑制了甘油三脂的分泌,促進了肝臟的脂質沉積,從而促進NAFLD的發生[9]。此外,TM6SF2與NAFLD的組織學嚴重程度及脂肪肝相關纖維化的進展密切相關[10]。
(二)藥物相關脂肪肝 部分藥物在代謝過程中可產生類似于NAFLD的病理生理過程,促進脂肪肝的發生[11]。藥物誘導的NAFLD流行率各不相同,據估計,大約有2%的NAFLD病例是由于藥物毒性所致。引起脂肪變性和脂肪性肝炎的常見藥物包括他莫昔芬、甲氨蝶呤、糖皮質激素、胺碘酮、伊立替康、丙戊酸、四環素、阿司匹林和不同的抗逆轉錄病毒藥物等[6]。這些藥物可以引起脂肪性肝炎或加重已存在的原發性NAFLD。他莫昔芬是雌激素受體抑制劑,常應用于乳腺癌的術后治療,近40%的患者使用他莫昔芬后兩年內發生脂肪肝。據報道,應用他莫昔芬的患者脂肪肝的患病風險是健康人群的2~3倍[12]。與沒有新輔助化療相比,在肝結直腸轉移切除前使用化療藥物伊立替康治療增加了脂肪性肝炎的風險。甲氨蝶呤是免疫抑制藥物,常用于治療類風濕性關節炎和其他風濕免疫性疾病。研究證實,甲氨蝶呤促進肝細胞脂肪沉積、肝細胞氣球樣變、促進炎癥以及纖維化[13]。高效抗逆轉錄病毒療法(highly active antiretroviral therapy,HAART)被用于治療HIV感染,大約有40%~50%的應用HAART治療的患者出現脂質營養不良,導致脂肪肝的發生[4]。糖皮質激素通過以抑制脂肪酸氧化以及促進脂肪酸合成,可促進脂肪肝的發生。同時,糖皮質激素導致的胰島素抵抗、高胰島素血癥、糖脂代謝紊亂,脂肪組織分解增加等因素促進了脂肪肝的發生、發展。
一系列環境毒物及化學物質亦可引起肝臟脂肪沉積,研究發現,土壤中的重金屬,日常所用殺蟲劑、殺菌劑及干洗劑等。其作用機制包括破壞機體內分泌調節系統、干擾內分泌激素的功能、改變肝細胞因子的分泌、干擾核受體的代謝調控功能等[14]。
(三)腸道相關脂肪肝 營養不良、腸道通透性增加、小腸細菌過度生長、腸道菌群失調以及腸外營養等腸道疾病促進脂肪肝的發生。例如,乳糜瀉 (Celiac disease, CD)的患者在診斷CD一年內發生脂肪肝的風險為健康人群的13倍[15]。慢性營養吸收不良、腸道屏障破壞、低血清膽堿水平以及腸道細菌多樣性的降低,均促進了脂肪肝的發生、發展。神經性厭食及嚴重的營養不良亦可導致脂肪肝。兒童嚴重的營養不良可造成低蛋白血癥以及脂肪肝的發生,其可能與肝臟過氧化物酶體以及線粒體功能紊亂相關。
減肥手術如胃束帶術、袖狀胃切除術、Roux-en-Y胃旁路術等可有效減輕體重并改善大多數肥胖患者的脂肪肝[16]。但少數病例報道發現減肥術后出現肝功能異常以及脂肪肝加重。其原因可能是由于在肥胖患者,快速的脂肪動員增加肝細胞的氧化應激水平從而引起及加重脂肪肝及肝臟炎癥。
大約37%的胰腺切除術后患者可發生脂肪肝,術后營養吸收異常以及營養不良狀態可能是這些患者發生脂肪肝的主要原因,適當的胰酶補充治療可改善此類患者的脂肪肝[17]。此外,短腸綜合征,放射性腸炎等因營養吸收障礙而需要靜脈營養補充,亦可導致脂肪肝的發生。
(四)內分泌紊亂(除外代謝綜合征/糖尿病) 內分泌紊亂例如垂體機能減退、生長激素缺乏以及性激素代謝紊亂等都可促進脂肪肝的發生。有研究報道,下丘腦/垂體機能減退的患者,存在中心性肥胖、胰島素抵抗以及NAFLD等類似于代謝綜合征的臨床表現。生長激素缺乏患者通常伴隨有脂肪肝、肝功能異常以及高脂血癥,而生長激素替代治療可顯著降低血清ALT、AST以及GGT水平以及改善肝臟脂肪沉積、炎癥和纖維化。
女性雌激素缺乏以及雄激素過多均可引起代謝紊亂,促進脂肪肝的發生。女性絕經期后NAFLD的患病率顯著高于絕經期前,其機制可能是缺乏雌激素的保護作用有關。多囊卵巢綜合征(PCOS)與胰島素抵抗及代謝綜合征密切相關,研究發現,PCOS患者發生NAFLD的風險為健康人群的2.5倍左右,高雄激素血癥以及肥胖是促進PCOS相關NAFLD發生的主要危險因素。
多數研究認為,甲狀腺機能減退通常伴隨著肥胖、高脂血癥、胰島素抵抗以及NAFLD 的發生,但這一觀點仍有爭論[18]。臨床試驗提示,甲狀腺受體激動劑可能成為脂肪肝的新的有效手段。例如,最近的研究發現,應用肝臟選擇性的甲狀腺激素受體β 激動劑resmetirom可減少60% NAFLD患者的肝臟脂肪含量,且56% NAFLD患者的NAS評分降低了2分以上[19]。甲狀腺激素受體激動劑的應用為NAFLD的治療提供了新的思路。
(五)丙型肝炎病毒(hepatitis C,HCV)相關脂肪肝 HCV,特別是基因3型HCV病毒感染與脂肪肝密切相關。脂質對HCV病毒復制、組裝以及血液循環至關重要。 HCV感染可通過多種途徑干擾脂代謝,包括抑制VLDL分泌,促進脂質合成以及抑制脂質氧化。據報道,慢性丙型病毒性肝炎中脂肪肝的患病率約為40%~80%。在基因3型慢性丙型病毒性肝炎患者,脂肪肝的嚴重程度與病毒載量呈正相關并且抗病毒治療后脂肪肝可明顯改善[20]。
二、 繼發性脂肪肝的診斷
在臨床工作中,大多數NAFLD伴隨著糖脂代謝紊亂以及代謝綜合征。對NAFLD的診斷,所有人應排除繼發性脂肪肝的常見因素。特別是當患者無明顯代謝綜合征表現時,應考慮其他導致的繼發性NAFLD(圖1)[6]。通過詳細的病史詢問及體格檢查,可排查是否存在營養或腸道相關以及藥物或環境毒物相關的繼發性脂肪肝。女性需檢查有無PCOS的癥狀及體征。常規篩查抗HCV抗體、血清銅、血清TSH水平等指標易于鑒別NAFLD繼發因素的鑒別。由腫瘤、腦弓形體病或其他感染引起的垂體功能減退也是導致繼發性NAFLD的罕見原因。對無明確病因的患者可進行基因檢測,明確有無NAFLD易感性基因突變以及先天性遺傳性疾病。肥胖兒童中NAFLD的流行率已上升至28%,除了超重和肥胖兒童,瘦兒童也應排除NAFLD的繼發原因。18%的NAFLD肥胖兒童中有繼發原因,因此,NAFLD患者體質量減輕后肝酶仍未正常的兒童,仍須排除繼發因素。非常瘦的兒童應檢查脂營養不良。腹部超聲檢查以排除解剖學異常,并及時發現門脈高壓。也可以考慮肝臟活檢以助于診斷。
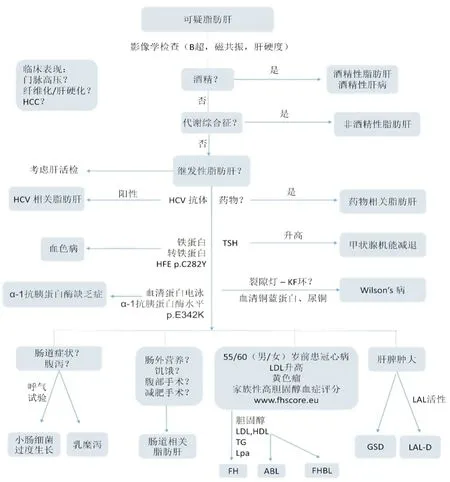
ABL:無β脂蛋白血癥; FH:家族性高脂蛋白血癥;FHBL:家族性低β脂蛋白血癥;GSD:糖原累積癥; HCC:肝細胞肝癌;HDL:高密度脂蛋白; LAL:溶酶體酸性脂肪酶; LAL-D:溶酶體酸性脂肪酶缺乏癥; LDL:低密度脂蛋白;Lpa:脂蛋白a;TG:甘油三酯; TSH:促甲狀腺激素。
三、 治療
目前國際上尚無藥物批準用于NAFLD的治療,而部分繼發性NAFLD在正確甄別病因后可給予針對性的治療(表1)[6],阻止疾病進展并改善NAFLD/NASH。因此,在臨床工作中,正確識別繼發性NAFLD的病因對NAFLD的治療具有重大意義。

表1 繼發性NAFLD治療策略
四、總結及展望
大多數NAFLD是由營養過剩引起的代謝綜合征的一個組成部分。如果在臨床評估中沒有代謝綜合征的癥狀和跡象,應考慮是否存在NAFLD的繼發因素,包括藥物治療和環境暴露到內分泌激素失調以及先天性代謝缺陷,特別是在瘦患者和兒童患者中。盡早識別NAFLD的病因有助于早期干預改善預后。如果沒有針對性治療措施,通過分析已知遺傳風險因子(PNPLA3、TM6SF2、GCKR、MBOAT7、HFE、A1AT;保護性:HSD17B13、MARC1)從而調整隨訪監測頻率。未來將會開發更多針對性的治療繼發性NAFLD的治療藥物用于臨床。

