氧化苦參堿通過TGF-β1/Smads信號通路對膿毒性休克大鼠心肌損傷的保護作用
蔣志虎 馬競 王小東 閆雪 張燕 許金鵬 王瀟偉
膿毒性休克影響重癥監護患者,是導致患者死亡的主要原因之一[1]。心肌功能障礙是常見并發癥,會顯著增加膿毒癥休克患者的死亡率[2]。先前關于感染性休克的研究集中在炎性介質(包括腫瘤壞死因子-α和白細胞介素-1β)的產生以及對肝、肺和腎組織的損害上[3]。心肌抑制是膿毒癥器官功能障礙的公認表現。然而,感染性心功能不全的各種機制仍不清楚,目前沒有一種專門針對心肌功能障礙設計的治療策略已被證明對感染性休克患者有效[4]。TGF-β1/Smads信號通路是研究最多的信號轉導級聯之一,對于參與免疫和炎性反應的細胞因子受體信號傳導至關重要。TGF-β1/Smads信號分子結合細胞因子和炎性細胞因子(包括 TNF-α、IL-1β 和 IL-6)基因啟動子區域中的特定核苷酸序列,誘導基因表達[5,6]。研究表明,在膿毒癥大鼠肺組織中,TGF-β1/Smads信號通路被激活,TNF-α和IL-6的表達增加[7]。抑制TGF-β1/Smads通路可減輕敗血癥大鼠的多器官功能障礙[8]。因此,阻止TGF-β1/Smads信號通路的激活以減少炎癥可能對感染性休克患者具有臨床益處。氧化苦參堿(oxymatrine, OMT)是中藥苦參的主要活性成分,已得到充分研究,其抗炎活性已在實驗動物模型和臨床研究中得到證實[9]。OMT 具有多種生物活性,包括清熱解毒、抗炎、抑制肝纖維化、升高白細胞、抗柯薩奇病毒和調節免疫以及藥理作用的其他方面[10]。已確定OMT可抑制內毒素血癥小鼠的肺組織損傷,該機制與LPS識別受體表達的調節和下游炎性因子表達的下調有關[11]。這些結果表明OMT在抗炎反應中起著至關重要的作用,并且與本研究的假設一致,即OMT可以通過抑制TGF-β1/Smads信號通路的激活來預防感染性休克引起的心肌損傷。本研究對大鼠模型進行了盲腸結扎和穿刺(CLP),以檢查OMT對膿毒性休克心肌損傷中TGF-β1/Smads信號通路抑制的影響。
1 材料與方法
1.1 實驗試劑 OMT購自寧夏啟元藥業有限公司(中國銀川)。地塞米松購自湖北天藥制藥有限公司(中國湖北)。考馬斯亮藍蛋白定量試劑盒購自南京建成生物工程公司(中國南京)。125I腫瘤壞死因子-α和125I白細胞介素-1β放射免疫測定試劑盒購自北京Chemclin生物工程有限公司(中國北京)。TRIzol從Invitrogen Life Technologies(Carlsbad, CA.USA)獲得。PrimeScript RT試劑盒來自Takara Bio(中國大連)。RT-PCR 試劑盒來自Promega(Promega Corporation, Madison, WI, USA)。針對TGF-β1和Smads的大鼠單克隆抗體來自 Santa Cruz Biotechnology, Inc.(Santa Cruz,CA,USA),IP 細胞裂解物和 BCA 蛋白濃度測定試劑盒來自江蘇格林生物技術公司(中國江蘇)。
1.2 實驗動物 動物研究得到醫院動物護理委員會的批準。雄性Sprague-Dawley大鼠,無特定病原體,體重200~250 g,購自北京大學醫學部實驗動物科學部[合格證號:SCXK(京)2021-0013]。大鼠隨機分為7組(n=8):假手術(CON)組、OMT組、CLP模型(CLP組)、陽性對照組[CLP+地塞米松(DEX)組,10 mg/kg]和CLP+OMT-M組(CLP+OMT 52 mg/kg)、CLP+OMT-H組(CLP+OMT 26 mg/kg)、CLP+DEX-L組(CLP+OMT 13 mg/kg)。感染性休克模型由CLP誘導。大鼠接受尾靜脈注射藥物(5 ml/kg)。CON組和OMT組大鼠靜脈注射0.9%氯化鈉溶液和OMT(26 ml/kg),CLP組僅注射0.9%氯化鈉溶液(26 ml/kg)。處理后,盲腸在無菌條件下暴露。術后監測大鼠尾動脈壓,降至基礎血壓的2/3,脈壓<20 mm Hg判斷膿毒癥模型成功。
1.3 觀察指標 (1)心臟功能:由右側頸總動脈測定大鼠心率(HR)、平均動脈壓(MAP)、左心室內壓變化率(LVdp/dtmax)、左心室收縮末期壓(LVESP)和通過插入心導管術測量左心室舒張末壓(LVEDP)。(2)組織學分析:收集頂端組織塊 2 mm3并固定在10%甲醛中,然后包埋在石蠟中。蘇木精-伊紅染色后,光鏡下觀察心肌組織病理變化。將約2 mm3的額外心肌組織置于2%戊二醛中并切片作為電子顯微鏡標本以確定超微結構變化。
1.4 RT-PCR分析 使用TRIzol制備總RNA,并使用PrimeScript RT試劑盒逆轉錄為cDNA。RT-PCR 使用市售試劑盒進行如下:94℃變性60 s、58℃退火60 s和72℃延伸50 s,35個循環。β-肌動蛋白用作內部對照以評估TNF-α和IL-1β的相對表達。見表1。

表1 引物序列
1.5 蛋白質印跡分析 本研究采用BCA試劑盒測量總蛋白質濃度。以10%SDS-PAGE電泳分離等量的蛋白質(40 μg),然后將凝膠轉移到0.45 μm PVDF膜上。將印跡浸泡在封閉緩沖液(5%脫脂牛奶)中,然后與一抗在4℃環境下孵育過夜。用TBST緩沖液徹底清洗后,應用辣根過氧化物酶偶聯的二抗(1∶10 000),然后使用增強型化學發光檢測系統觀察免疫復合物。
1.6 放射免疫測定 通過放射免疫測定法測定心肌組織中TNF-α和IL-1β的水平。心肌組織(100 mg)與3倍體積的PBS混合并勻漿,然后在4℃條件下以13 000 g 離心20 min。使用放射免疫分析試劑盒定量上清液中TNF-α和IL-1β的蛋白質水平。
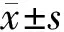
2 結果
2.1 心臟功能測定 心肌舒張功能的變化是感染性休克的一個重要特征[12]。與CON組比較,OMT組的心功能參數,包括HR、MAP、LVSP、LVEDP和±LVdp/dtmax未受影響(P>0.05)。CLP組與CON組比較,指標均有顯著變化(P<0.01)。不同劑量OMT治療后,CLP+OMT-H組HR降低(P<0.05),MAP和LVSP升高(P<0.01);與CLP組相比,LVEDP 降低(P<0.01),±LVdp/dtmax 增加(P<0.01)。CLP+OMT-M組HR降低(P<0.05),MAP和LVSP增加(P<0.05),LVEDP減少(P<0.05),±LVdp/dtmax增加(P<0.01),LVdp/dtmax升高在CLP+低劑量OMT組中增加了13%(P<0.05)和-LVdp/dtmax 增加了9%(P<0.05)。CLP+DEX組與CON組、CLP+OMT-H和CLP+OMT-M組比較各項指標未見顯著差異(P>0.05),但與CLP組和CLP+OMT-L組比較,各項指標均存在顯著差異(P<0.05)。見表2。

表2 OMT對感染性休克大鼠心功能的影響
2.2 心肌組織學測定 CON組和OMT組未發現心肌組織的差異,心內膜完整,無水腫及纖維結締組織增生,心肌條紋清晰,細胞核居中,未見血管舒張和炎性細胞浸潤,心外膜在基質中完整,沒有炎性滲出物。與CON組比較,CLP組明顯的心內膜下心肌結構紊亂,大量炎性細胞浸潤,有相當數量的單核細胞和少量淋巴細胞和中性粒細胞,并有毛細血管擴張和出血。CLP組還表現出不同程度的間質水腫、成纖維細胞增殖和細胞壞死和纖維化。在不同劑量的OMT治療后,與CLP組比較,CLP+OMT-L組心肌組織損傷減少,但低水平的心肌結構紊亂,伴有炎癥細胞浸潤、毛細血管擴張和出血,細胞壞死和纖維化。然而,CLP+OMT-M組和CLP+OMT-H組的心肌組織損傷明顯減輕,并觀察到正常的基本心臟結構,水腫、變性和壞死明顯減輕,但仍伴有少量炎性細胞浸潤和滲出性改變。與CLP組比較,CLP+DEX組心肌損傷明顯減輕,心肌細胞排列成行,伴有少量炎性細胞浸潤,未發現細胞腫脹、變性和壞死的顯著變化。見圖1。

圖1 感染性休克大鼠的心肌組織學分析(蘇木精-伊紅染色×100);A CON組;B OMT組;C CLP組;D CLP+OMT-L組;E CLP+OMT-M組;F CLP+OMT-H組;G CLP+DEX組
2.3 心肌超微組織學改變 與CON組比較,OMT組心肌組織(肌絲、肌節、毛細血管、線粒體、肌漿網和核仁)未見明顯變化,均有正常的形狀和清晰的結構,肌絲和肌節排列正常,血流量正常;線粒體結構正常清晰,膜完整,脊致密,基質清晰,插入的圓盤有序且連續,肌漿網光滑連續,核仁清晰,光核固縮,染色質均勻。CLP組超微組織心肌組織受到顯著損傷,線粒體明顯腫脹,膜損傷和嵴紊亂;肌絲溶解,肌節紊亂,導致空泡;細胞核顯著減小,并觀察到染色質邊緣;嵌入盤的溶解表現出不連續性和不均勻分布。與CLP組比較,CLP+OMT組心肌組織損傷明顯減輕,心肌纖維排列正常,大部分線粒體結構完整,雖然脊的一部分不明確,但排列仍然規則,線粒體腫脹減少,特定的損傷沒有完全恢復。CLP+OMT-L組表現出最高水平的損傷。CLP+DEX 組的超微組織心肌組織幾乎正常,很少受傷,心肌纖維排列整齊,大部分線粒體結構完整,脊線致密,纖維排列有序,特定的損傷未完全恢復,插入的椎間盤顯示明顯連續。肌漿網光滑連續,核仁清晰,核固縮較輕,染色質均勻。見圖2。

圖2 心肌超微組織學分析(×12 000);A CON組;B OMT組;C CLP組;D CLP+OMT-L組;E CLP+OMT-M組;F CLP+OMT-H組;G CLP+DEX組
2.4 OMT對TGF-β1和Smad2蛋白表達的影響 蛋白質印跡分析顯示OMT對照心肌組織中TGF-β1和Smad2蛋白水平與 CON組相似,但在CLP組中更高(P<0.05)。然而,與CLP比較,CLP+OMT和陽性對照組的TGF-β1和Smad2蛋白水平顯著降低(P<0.05)。見圖3,表3。
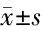
表3 OMT對膿毒性休克大鼠心肌TGF-β1和Smad2蛋白表達的影響

圖3 OMT對膿毒性休克大鼠心肌TGF-β1和Smad2蛋白表達的影響;泳道 1~7 分別顯示 CON、OMT 對照、CLP、CLP + OMT-L、CLP + OMT-M、CLP + OMT-H 和 CLP + DEX 組
2.5 OMT對TNF-α和IL-1β蛋白表達的影響 與CON組和OMT組比較,CLP組TNF-α和IL-1β蛋白水平顯著升高(P<0.05)。與CLP 組比較,CLP+OMT組和CLP+DEX組中TNF-α 和IL-1β蛋白水平顯著降低(P<0.05)。見圖4,表4。
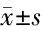
表4 OMT對膿毒性休克大鼠心肌TNF-α和IL-1β蛋白表達的影響

圖4 OMT對膿毒性休克大鼠心肌組織TNF-α和IL-1βmRNA表達的影響;泳道 1~7 分別顯示 CON、OMT 對照、CLP、CLP + OMT-L、CLP + OMT-M、CLP + OMT-H 和 CLP + DEX 組
2.6 OMT對TNF-α和IL-1β mRNA表達的影響OMT組、CON組心肌組織TNF-α和IL-1β mRNA水平正常,CLP組顯著增加(P<0.05)。與 CLP組比較,CLP+OMT和CLP組+DEX組中TNF-α和IL-1β mRNA水平顯著降低(P<0.05)。見表5。
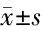
表5 OMT對膿毒性休克大鼠心肌TNF-α和IL-1β mRNA的影響
3 討論
感染性休克中細胞的廣泛活化導致許多炎性介質釋放,如細胞因子、趨化因子、前列腺素、脂質介質和活性氧。膿毒癥中炎性介質的過量產生與許多信號通路有關,如MAPK和NF-κB,特別是TGF-β1/Smads[13]。TGF-β1和Smads促進細胞因子的釋放,包括TNF-α和IL-1β,且與不受控制的炎性反應、感染性休克和急性器官損傷顯著相關[14]。Xu等[15]報道,IL-2和IFN-γ與TGF-β1/Smads通路的激活直接相關,抑制該通路可減少大鼠膿毒性休克中重要器官的功能障礙。
OMT是一種從苦參中提取的生物堿,其生物活性已得到廣泛研究[16-18]。已發現OMT通過靶向肝星狀細胞和減少肝纖維化來減輕肝纖維化。通過抑制誘導型一氧化氮合酶表達和TGF-β/Smads信號通路,緩解博萊霉素誘導小鼠肺纖維化。此外,發現 OMT 在腦缺血/再灌注中表現出神經保護作用。
之前的研究表明,OMT 顯著抑制膿毒癥大鼠肺組織中TGF-β1和Smad2的活性,降低TNF-α和IL-6水平、W/D比和肺系數,減少肺組織充血、水腫、中性粒細胞浸潤、透明膜形成和其他病變[19,20],在本研究中,開發膿毒性休克大鼠模型,通過檢測TGF-β1和Smad2的表達以及TNF-α和IL-6的釋放來檢查OMT對心臟組織損傷和TGF-β1/Smads信號通路的影響。組織學分析表明,OMT干預顯著減少了由HR和LVSP增加引起的大鼠感染性休克。降低的±LVdp/dtmax 增加了心肌順應性,降低了心肌僵硬,改善了心臟功能,增強了心肌收縮力,糾正了心室舒張末期壓力增加并降低了前負荷。這些心臟保護作用與TGF-β1/Smads信號通路的激活有關。蛋白質印跡分析和RT-PCR顯示OMT抑制 TGF-β1和Smad2的激活,導致促炎細胞因子、TNF-α和IL-6的表達降低。
總之,心臟損傷與TGF-β1/Smads信號通路相關,并且OMT具有抑制該信號通路激活的能力。TGF-β1和Smad2的激活導致TNF-α和IL-6的上調。TNF-α和IL-6的釋放對心臟組織有顯著影響。目前觀察表明,OMT保護心肌損傷,并且至少部分地與膿毒性休克大鼠中TGF-β1/Smads信號傳導的顯著抑制相關,并且可能是治療膿毒性休克的潛在治療藥物。

