捻轉(zhuǎn)血矛線蟲Hc-dhs-28蛋白結(jié)構(gòu)和B細(xì)胞抗原表位預(yù)測
焦萬明 ,馬 園 ,尹衍峰 ,付 偉 ,賈曉晴 ,馬俊杰 ,丁玉林 ,杜 山 ,王 瑞 *
(1.內(nèi)蒙古阿拉善盟額濟(jì)納旗動物疫病預(yù)防控制中心,內(nèi)蒙古 阿拉善 735400;2.內(nèi)蒙古農(nóng)業(yè)大學(xué)獸醫(yī)學(xué)院,內(nèi)蒙古 呼和浩特 010010;3.濟(jì)南市長清區(qū)畜牧獸醫(yī)事業(yè)發(fā)展中心,山東 濟(jì)南 250399)
捻轉(zhuǎn)血矛線蟲病(Haemonchosis)是一種由圓線目(Strongylata),毛圓科 (Trachostrongylidae),血矛屬(Haemonchus)的捻轉(zhuǎn)血矛線蟲(Haemonchxs contortus)引起的寄生蟲病[1]。捻轉(zhuǎn)血矛線蟲是一種小反芻動物的寄生線蟲,分布于世界各地,以寄主血液為食,可導(dǎo)致動物嚴(yán)重貧血甚至死亡[2]。目前,使用胃腸驅(qū)蟲藥仍是針對該病的首選治療手段,但是由于耐藥情況日益嚴(yán)重,迫使我們急需開發(fā)新的藥物或者更好地改進(jìn)防控策略,如研制寄生蟲疫苗、加強(qiáng)飼養(yǎng)管理等[3]。
近年來,針對寄生蟲病基因工程疫苗的研究已成為熱點(diǎn),其中選擇合適且能夠刺激機(jī)體產(chǎn)生免疫反應(yīng)的抗原蛋白是關(guān)鍵因素之一。目前,針對捻轉(zhuǎn)血矛線蟲病研制的重組抗原疫苗所進(jìn)行的免疫試驗均未取得理想效果[4]。新發(fā)現(xiàn)的Hc-dhs-28蛋白是Ce-dhs-28蛋白的同系物,Ce-dhs-28蛋白是氧化循環(huán)中的關(guān)鍵酶,該蛋白質(zhì)含有短鏈脫氫酶結(jié)構(gòu)域和過氧化物酶體靶向信號。研究發(fā)現(xiàn)Hc-dhs-28蛋白最有可能作為第3種3-羥酰基輔酶A脫氫酶參與過氧化物酶體脂肪酸B的氧化,從而調(diào)節(jié)與滯育相關(guān)的信息素的產(chǎn)生,進(jìn)而影響捻轉(zhuǎn)血矛線蟲的滯育形成[5-6]。
本研究利用生物信息學(xué)工具及在線分析軟件對Hc-dhs-28蛋白的理化性質(zhì)、結(jié)構(gòu)和功能等進(jìn)行分析,進(jìn)而確定Hc-dhs-28抗原的B細(xì)胞表位,為捻轉(zhuǎn)血矛線蟲病的進(jìn)一步免疫診斷和疫苗研制提供參考信息。
1 材料與方法
1.1 目的基因信息
在GenBank上獲取捻轉(zhuǎn)血矛線蟲Hc-dhs-28基因序列,編碼438個氨基酸(序列號:AVP73885.1)。
1.2 試驗方法
蛋白質(zhì)理化性質(zhì)分析:通過Expasy軟件中Protparam在線工具分析蛋白質(zhì)基本理化性質(zhì)[7]。跨膜結(jié)構(gòu)域、親疏水性和信號肽預(yù)測:采用TMHMM Server v.2.0、Signa1P4.1Server和 ProScale在線工具對蛋白跨膜結(jié)構(gòu)域、親疏水性和信號肽進(jìn)行預(yù)測[8-9]。磷酸化和亞細(xì)胞定位預(yù)測:通過NetPhos和PSORT Ⅱ在線工具對蛋白質(zhì)的磷酸化位點(diǎn)和亞細(xì)胞定位進(jìn)行預(yù)測[10]。二級和三級結(jié)構(gòu)預(yù)測:使用SOPMA和Phyre2在線分析軟件對蛋白質(zhì)二級結(jié)構(gòu)、三級結(jié)構(gòu)分析并建模[11]。B細(xì)胞表位預(yù)測:使用IEDB Analysis Resource在線工具預(yù)測B細(xì)胞表位[12]。具體網(wǎng)址如表1所示。

表1 在線工具及網(wǎng)址
2 結(jié)果與分析
2.1 理化性質(zhì)
Hc-dhs-28蛋白的氨基酸組成見表2。Hc-dhs-28蛋白由438個氨基酸組成,其中占比最高的氨基酸為丙氨酸 (Ala,10%)。 蛋白分子式為 C2088H3339N569O640S17,相對分子質(zhì)量為47198.93,理論等電點(diǎn)為8.77,帶負(fù)電荷殘基總數(shù)(Asp+Glu)為46個,帶正電荷殘基總數(shù)(Arg+Lys)為51個。預(yù)測的半衰期為30h(哺乳動物體內(nèi)),脂溶指數(shù)為86.57,親水性總平均值為-0.169,脂肪指數(shù)為85.53,不穩(wěn)定性指數(shù)為32.32,判定該蛋白為穩(wěn)定蛋白。
表2 Hc-dhs-28蛋白的氨基酸組成表
2.2 跨膜結(jié)構(gòu)域、親疏水性和信號肽預(yù)測結(jié)果
Hc-dhs-28蛋白跨膜區(qū)分析結(jié)果如圖1所示。如果蛋白質(zhì)包含跨膜區(qū),則它可作為膜受體發(fā)揮作用,或是位于膜上的錨定蛋白和離子通道蛋白[13]。由TMHMM軟件分析可知,Hc-dhs-28蛋白預(yù)測結(jié)果均位于膜外,不存在跨膜結(jié)構(gòu)域。

圖1 Hc-dhs-28蛋白跨膜區(qū)分析結(jié)果
Hc-dhs-28蛋白親疏水性分析結(jié)果如圖2所示。多肽鏈的親疏水性在維持蛋白質(zhì)三級結(jié)構(gòu)的形成和穩(wěn)定中具有十分重要的作用。由ProScale軟件分析可知,Hc-dhs-28蛋白的平均親水性系數(shù)(GRAVY)為-0.169,該蛋白存在的親水性氨基酸數(shù)量>疏水性氨基酸數(shù)量,最大值為2.256,位于第139位(Lys),具有較強(qiáng)的疏水性。親水性最小值為-2.544,位于第348位(Ile),具有較好的親水性,分析該蛋白為親水蛋白。
圖2 Hc-dhs-28蛋白親疏水性分析結(jié)果
Hc-dhs-28蛋白信號肽分析結(jié)果如圖3所示。采用Signa1P軟件分析Hc-dhs-28蛋白是否存在信號肽,根據(jù)預(yù)測結(jié)果發(fā)現(xiàn),該蛋白無信號肽存在,表明其為非分泌型蛋白。
圖3 Hc-dhs-28蛋白信號肽分析結(jié)果
2.3 磷酸化和亞細(xì)胞定位預(yù)測結(jié)果
Hc-dhs-28蛋白磷酸化分析結(jié)果如圖4所示。蛋白質(zhì)磷酸化是一種翻譯后修飾,磷酸化主要集中在Tyr、Thr和Ser殘基上,這些殘基具有游離羥基且不帶電荷。經(jīng)過磷酸化后的蛋白質(zhì)帶電荷,使得其結(jié)構(gòu)發(fā)生改變,并由此導(dǎo)致蛋白質(zhì)活性的改變[14]。通過NetPhos3.1在線工具分析得知,Hc-dhs-28氨基酸序列含有43個磷酸化位點(diǎn),分別為24個絲氨酸、14個蘇氨酸和5個酪氨酸位點(diǎn)。采用PSORT Ⅱ在線工具對蛋白質(zhì)亞細(xì)胞定位,結(jié)果顯示該蛋白可能主要在線粒體上發(fā)揮生物學(xué)作用。
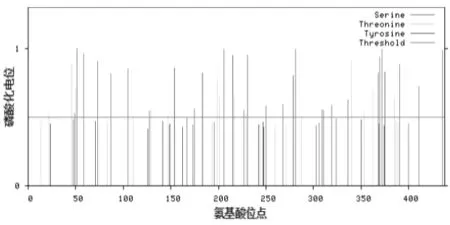
圖4 Hc-dhs-28蛋白磷酸化分析結(jié)果
2.4 蛋白質(zhì)二級結(jié)構(gòu)預(yù)測
Hc-dhs-28蛋白二級結(jié)構(gòu)結(jié)果如圖5所示。使用SOPMA軟件預(yù)測Hc-dhs-28蛋白的二級結(jié)構(gòu),α-螺旋占比最高為39.95%,β-轉(zhuǎn)角占比最少為7.31%,無規(guī)則卷曲占比34.47%,β-折疊占比18.26%。α-螺旋和β-折疊被認(rèn)為是蛋白的骨架區(qū)域,由于2種結(jié)構(gòu)的特殊性,這2個區(qū)域不利于形成位點(diǎn)。根據(jù)Hcdhs-28蛋白的二級結(jié)構(gòu)預(yù)測結(jié)果,雖然α-折疊占比較高,但是結(jié)合其親疏水性,預(yù)測Hc-dhs-28蛋白上存在多個抗原位點(diǎn)。

圖5 Hc-dhs-28蛋白二級結(jié)構(gòu)結(jié)果
2.5 蛋白質(zhì)三級結(jié)構(gòu)預(yù)測
Phyre2是一套可在網(wǎng)絡(luò)上使用的生物信息學(xué)工具,用于預(yù)測和分析蛋白質(zhì)結(jié)構(gòu)、功能和突變[11]。蛋白質(zhì)結(jié)構(gòu)預(yù)測的準(zhǔn)確性關(guān)鍵取決于查詢序列和模板序列之間的相似性,如果待檢測的模板與查詢的序列同一性大于30%,那么通常大部分或全部比對將是準(zhǔn)確的,并且由此產(chǎn)生的結(jié)構(gòu)元素在模型中的相對位置將是可靠的。低于這個序列同一性水平,Phyre通常會進(jìn)行自行匹配。如果置信度匹配度高于90%,模型的整體折疊可以肯定是正確的,并且模型的結(jié)構(gòu)元素在模型中的相對位置將是趨于準(zhǔn)確的[15]。
Hc-dhs-28蛋白三級結(jié)構(gòu)模型如圖6所示。使用Phyre2軟件預(yù)測Hc-dhs-28蛋白三級結(jié)構(gòu)可知,Hc-dhs-28蛋白模型基于模板c1zbqB_,297個殘基(序列的68%)通過單個最高評分模板以100.0% 的置信度建模。Hc-dhs-28蛋白二級結(jié)構(gòu)以α-螺旋為主,其次是β-折疊,與SOPMA預(yù)測二級結(jié)構(gòu)結(jié)果一致。
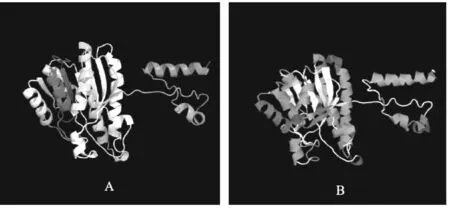
圖6 Hc-dhs-28蛋白三級結(jié)構(gòu)模型
2.6 B細(xì)胞表面抗原表位預(yù)測
IEDB在線軟件通過6個方面 (線性表位、β-折疊、表面可及性、靈活性、抗原指數(shù)和親水性)的預(yù)測確定蛋白的抗原表位。Hc-dhs-28蛋白的預(yù)測結(jié)果如圖7所示,綜合二級結(jié)構(gòu)預(yù)測結(jié)果,去除α-螺旋、β-折疊和疏水區(qū)等不易形成表位的區(qū)域,分析確定了5個B細(xì)胞表位,結(jié)果見表3。
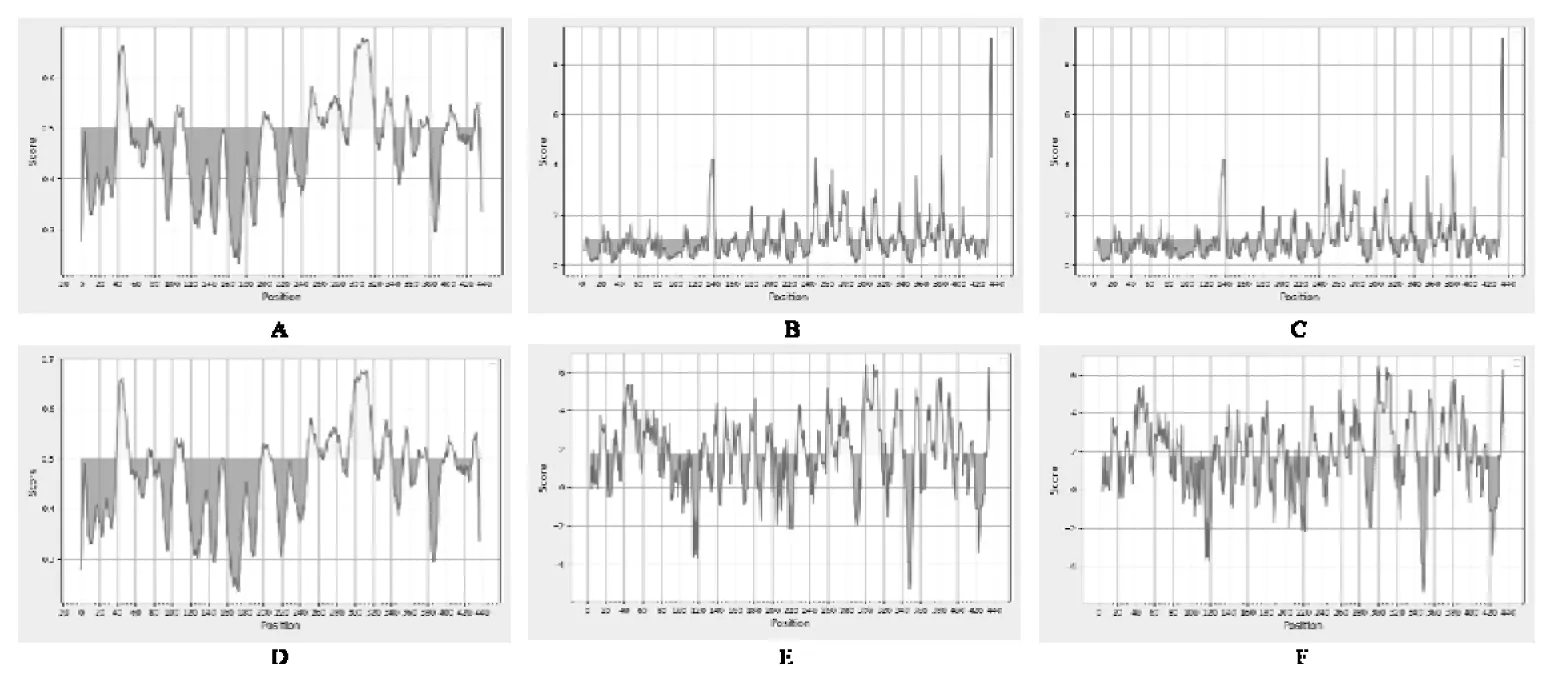
圖7 Hc-dhs-28蛋白B細(xì)胞表位抗原結(jié)果

表3 B細(xì)胞抗原表位預(yù)測結(jié)果
3 討論
開發(fā)針對寄生線蟲的商業(yè)疫苗,一個主要障礙是難以獲得能夠誘導(dǎo)保護(hù)性免疫重組形式的保護(hù)性抗原。目前,疫苗接種研究受到從寄生蟲提取物中純化的天然蛋白質(zhì)含量低、對寄生蟲材料的需求量大以及這種方法的成本、安全性和倫理考慮的限制,迫切需要發(fā)現(xiàn)特定亞單位疫苗的替代方法[16]。
在世界范圍內(nèi),家畜寄生線蟲依然是嚴(yán)重危害全球畜牧業(yè)生產(chǎn)的一類疫病。由于寄生蟲病控制目前仍依賴于使用驅(qū)蟲藥,但是寄生蟲抗藥性問題越來越普遍,意味著這種方法可能已不可持續(xù)[17]。雖也有資料報道,氨基乙腈衍生物的出現(xiàn)提供了一種替代方法,但其在使用不到2年的時間里,已有報告稱感染羊的線蟲對這種新型藥物便產(chǎn)生了耐藥性[18]。有研究表明,使用天然蛋白提取物接種疫苗后,對家畜線蟲感染具有顯著的保護(hù)作用,證明接種疫苗是可行的[19]。但是目前針對寄生線蟲的基因工程疫苗較少,許多研究都還在試驗階段,因此選擇合適的抗原來制備疫苗變得尤為關(guān)鍵。捻轉(zhuǎn)血矛線蟲的許多抗原被普遍用于防治試驗,但隨著研究的深入,由于蛋白表達(dá)量低、蛋白空間結(jié)構(gòu)折疊出現(xiàn)錯誤以及不能誘導(dǎo)動物機(jī)體產(chǎn)生針對蟲體的保護(hù)性免疫等原因,需選擇合適的抗原進(jìn)行表達(dá)[20]。有研究顯示,Hc-dhs-28重組蛋白具有較好的免疫原性,對宿主具有較好的免疫保護(hù)效力,是一種潛在的疫苗候選因子,Hc-dhs-28主要在幼蟲自由生活期轉(zhuǎn)錄,在滯育期達(dá)到高峰。在寄生蟲自由生活的早期階段,為進(jìn)入滯育階段做好準(zhǔn)備而激活滯育形成。這些結(jié)果表明,Hc-dhs-28蛋白可能參與滯育的形成[21-22]。
本文分析了Hc-dhs-28蛋白理化特性、結(jié)構(gòu)和抗原表位,顯示Hc-dhs-28蛋白不存在跨膜結(jié)構(gòu)域,為親水性、非分泌型的穩(wěn)定蛋白,存在磷酸化位點(diǎn),主要在線粒體發(fā)揮其生物學(xué)作用。進(jìn)一步通過生物信息學(xué)工具預(yù)測結(jié)合其二級結(jié)構(gòu),確定了5個B細(xì)胞優(yōu)勢表位。這些結(jié)果表明,Hc-dhs-28蛋白有很好的應(yīng)用價值,具有作為抗原的潛質(zhì),表明后期可選擇其合適的短肽進(jìn)行表達(dá),深入分析該蛋白的功能,為捻轉(zhuǎn)血矛線蟲的高效安全防控提供理論依據(jù)。

