菌株Citrobacter sp. ZY630鐵(Ⅱ)氧化硝酸鹽還原生物學和化學途徑
王 娟,張 玉,趙 睿 智,蘇 志 強,高 嘉 欣,趙 紫 荊,周 集 體
(大連理工大學 環境學院 工業生態與環境工程教育部重點實驗室, 遼寧 大連 116024 )
0 引 言
鐵在地殼中占比約為4.75%,是地殼中含量第四豐富的元素,其在環境中主要以離子態和Fe(Ⅱ)或Fe(Ⅲ)的礦物形式存在[1],探究 Fe(Ⅱ)和Fe(Ⅲ)之間轉換對生物地球化學循環具有重要作用[2].鐵在生物地球化學循環過程中能耦合C、N、S、O等元素的循環[3-4],特別是在微生物充當媒介下.1996年,Straub等在溪流、城市溝渠等水體沉積物中觀察到以硝酸鹽為電子受體的鐵氧化現象,首次報道了硝酸鹽依賴型厭氧亞鐵氧化(nitrate-dependent anaerobic ferrous oxidation,NAFO)菌的分離和純化[5].在此后20多年,NAFO微生物被研究者廣泛關注.這類微生物被發現在自然界許多生境中,如淡水底泥[6]、稻田土[7]、海洋沉積物[8]及地下水沉積物[9]等缺氧環境,其是環境中Fe-N元素循環的重要紐帶[1].

實驗室分離純化了一株具有反硝化功能的兼性厭氧菌株,分子生物學鑒定為檸檬酸桿菌屬,命名為Citrobactersp. ZY630.在自養條件下,探究菌株ZY630硝酸鹽還原和Fe(Ⅱ)氧化動力學特性,從生物轉化和化學反應的角度,對硝酸鹽還原與Fe(Ⅱ)/Fe(Ⅲ)轉化進行研究.同時分析亞硝酸鹽與Fe(Ⅱ)的化學反應對Fe(Ⅱ)-硝酸鹽-微生物體系反硝化過程的影響,以闡明Fe(Ⅱ)氧化與硝酸鹽還原在微生物介導下的作用機制.
1 實驗材料與方法
1.1 菌株來源
菌株來自于實驗室周圍的環境中.
1.2 實驗培養基
(1)無機鹽培養基
除特殊標明外,實驗所用藥品均為分析純,且并未進一步純化處理.實驗所用的無機鹽培養基是對脫氮硫桿菌ATCC25259專用培養基(T2)進行部分修改而來,具體配制方法如下:
溶液A:5 g Na2S2O3·5H2O,1 g NH4Cl,2 g KNO3(優級純),450 mL超純水.
溶液B:2 g K2HPO4,250 mL超純水.
溶液C:1 mL FeSO4·7H2O溶液(0.02 g FeSO4·7H2O溶于20%鹽酸),0.8 g MgSO4·7H2O,1 mL微量元素溶液,250 mL超純水.
溶液D:2 g NaHCO3,50 mL超純水.
微量元素溶液(g/L):EDTA 50、ZnSO422、CaCl25.54、MnCl25.06、(NH4)2MoO41.1、CuSO41.57、CoCl21.61.微量元素溶液pH為6.0.
配好的溶液用純度大于99%的氮氣曝氣20 min,密封后進行滅菌.其中溶液A、B、C在121 ℃高壓滅菌20 min,溶液D采用0.22 μm的濾膜進行過濾除菌.溶液經過滅菌后立即轉移到厭氧箱中,防止氧干擾.在厭氧箱中將溶液進行混合,并控制pH在7.0±0.2.
固體培養基是該無機鹽培養基加入2%的瓊脂粉配制而成.
(2)LB固體培養基
LB固體培養基成分為酵母浸粉5 g/L、NaCl 10 g/L、蛋白胨10 g/L,用8%的NaOH將pH調節至7.0,加入2%的瓊脂粉.
(3)鐵自養反硝化培養基
鐵自養反硝化培養基:K2HPO40.1 g/L、NaHCO31 g/L、MgCl2·6H2O 0.1 g/L、CaCl20.1 g/L、NaNO31 mmol/L、微量元素溶液1 mL/L,Fe2+以FeCl2·4H2O的形式提供,根據實驗要求進行配制.其中NaHCO3和FeCl2·4H2O在接種前通過過濾除菌的方式加入(現用現配).最終pH控制在7.0±0.2.各組分均曝氦氣20 min.
1.3 菌株的分離純化與菌種鑒定
利用無機鹽培養基從本實驗室保藏的受污染的菌液樣品中分離純化出一株菌,并用30%的甘油進行保存.將純化后的微生物分別在LB和無機鹽固體培養基上進行培養,發現其在相同的培養基上菌落大小、形態一致,初步判定為純菌.
之后將純化菌種委托生工生物工程(上海)股份有限公司進行菌株16S rDNA的PCR擴增和序列測定.基因組DNA的提取按Ezup柱式細菌基因組DNA抽提試劑盒SK8255(生工)操作說明進行實驗.PCR擴增使用的引物序列為27F 1492R(5′-AGAGTTTGATCCTGGCTCAG,GGTTACCTTGTTACGACTT-3′).
1.4 菌株的序列分析
將測序結果輸入NCBI進行Blast檢索,得出與該序列最相近的100個菌屬序列.從這些序列中選取幾株同源性較高菌屬的16S rDNA基因序列做內群,并通過查閱文獻找到與該菌屬最相近的其他菌屬做外群,利用Mega7進行分子系統發育分析[17-18].
1.5 菌株的培養和脫氮功能探究
1.5.1 菌株形貌分析
(1)菌落特征
將菌液稀釋并涂布于LB固體培養基上,放置在30 ℃的恒溫培養箱靜置培養,觀察其菌落形態.
(2)菌的微觀形貌
在無菌環境中將蓋玻片放置于培養皿中,在蓋玻片上滴2滴經過重新懸浮的細胞樣液,待其自然風干后加入2.5%戊二醛,在4 ℃冰箱中放置12 h,用30%、50%、70%、85%、95%、100%乙醇依次脫水25 min,自然風干,之后用碳膠帶將樣品固定在樣品臺,噴金,SEM掃描測樣,觀察菌的微觀形貌[19].
重新懸浮的細胞樣液:取10 mL菌液,在10 000 r/min條件下離心5 min,傾掉上清液后,加入1 mL的無菌生理鹽水進行重懸.
1.5.2 菌株的生長動力學特性 在厭氧環境下,取0.5 mL菌液接種于100 mL無機鹽培養基中.密封后在30 ℃、150 r/min的搖床中進行培養.定期取樣測定菌體濃度.
1.5.3 菌株的亞鐵氧化硝酸鹽還原能力探究
(1)實驗方法
取在無機鹽培養基中生長在對數期(OD660=0.550±0.050)的菌懸液,在10 000 r/min下離心5 min,并用無菌生理鹽水清洗2次.最后在厭氧箱中用經過曝氣的無菌生理鹽水進行重懸.然后將重懸液以2%的體積比加入血清瓶中.
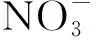
在整個實驗過程,所有樣品瓶均放置在厭氧箱中進行靜置培養,保持溫度在(30±2) ℃.
(2)沉淀產物表征
培養5 d后,收集加菌加6 mmol/L Fe2+體系的沉淀產物,對其進行XRD和SEM-EDX分析.SEM-EDX的樣品制備與菌的微觀形貌觀察時一致.XRD的樣品制備:將產物經10 000 r/min離心5 min,之后用曝氣后的超純水清洗3次,并先后使用75%乙醇、100%乙醇、丙酮各洗滌1次[20],最后在-60 ℃真空干燥[21],干燥后的產物立即分析.用X射線衍射儀(SmartLab 9 kW)表征,檢測條件40 kV、100 mA,掃描角度10°~80°,掃描速度8°/min[20].數據處理軟件HighScore Plus.

1.6 實驗分析方法
菌體濃度使用OD660來表示,以純水做參比液,取菌液測定其在波長為660 nm下的吸光度[22].
2 結果與討論
2.1 純化后菌的形態和種類
純化后的菌株菌落呈圓形、乳白色,表面光滑、濕潤、邊緣整齊(圖1(a)),不易挑起.該菌屬革蘭氏陰性菌,呈桿狀(圖1(b)、(c)),尺寸為0.5 μm×(1.5~3) μm.
用一對細菌16S rDNA的通用引物PCR擴增獲得該菌株16S rDNA基因片段,對此片段進行回收、測序,得到1 477 bp的序列.將測序所得序列輸入NCBI進行Blast檢索,發現純化菌株與檸檬酸桿菌屬細菌的核苷酸序列自然聚類.在最相近的100個序列中,檸檬酸桿菌屬細菌占96%,純化菌株與其的同源性為98.50%~99.86%,因此確定其為檸檬酸桿菌,命名為Citrobactersp. ZY630(簡稱菌株ZY630).從中選擇同源性較高的檸檬酸桿菌屬的16S rDNA基因序列,并以大腸埃希氏菌(Escherichiacoli)和腸炎沙門氏菌(Salmonellaenteritidis)為外群[28]進行系統發育分析.結果如圖2所示.

(a) 菌落照片

(b) 高分辨率SEM圖

(c) 低分辨率SEM圖
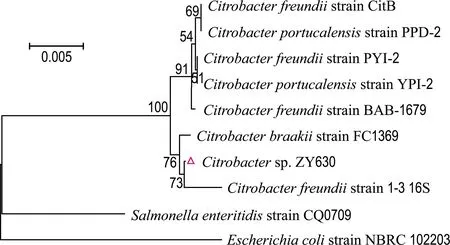
圖2 菌株ZY630的系統發育樹Fig.2 Phylogenetic tree of strain ZY630
2.2 菌株ZY630的生長動力學特性
圖3反映了接入0.5 mL菌液后菌株在無機鹽培養基中的生長曲線.從圖中可以看出,初始菌液加入培養體系后,會出現約6 h的適應期,在這個時期菌株生長緩慢.在6 h之后,菌株快速生長,進入對數期,由圖可以看出6~24 h為菌株的對數生長期.菌株在24 h附近進入穩定期,此時OD660為0.711.

圖3 菌株ZY630的生長曲線Fig.3 Growth curve of strain ZY630
2.3 菌株的亞鐵氧化硝酸鹽還原功能探究

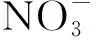

圖6 Fe2+濃度隨時間的變化Fig.6 Changes of Fe2+ concentration with time
對反應前后體系的pH和ORP進行測定,發現相比于化學對照組,加菌加Fe2+體系發生pH的降低和ORP的升高(圖7).ORP意為體系中的氧化還原電位,代表反應過程中的氧化還原產物的變化,其值的升高表明體系中生成氧化產物,符合Fe2+-Fe3+的轉化.對于體系中pH的降低,目前已有很多報道[33-35],其主要原因是生成的Fe3+以氫氧化物形式存在,消耗了體系中的OH-.
2.3.2 菌株ZY630亞鐵氧化硝酸鹽還原的產物表征 用掃描電鏡分別對6 mmol/L Fe2++菌組48 h和120 h的沉淀產物進行分析.如圖8所示,其中圈內標出的是菌,在菌表面和周圍沉積偏白色小顆粒和絮狀物代表含鐵礦物.由圖8可以看出,隨著菌在含Fe2+體系中停留時間的延長,其表面沉積的含鐵礦物增加,到120 h后,菌表面幾乎被鐵礦物覆蓋.王茹等[36]提出胞外堆積的鐵氧化物或氫氧化鐵可阻礙細胞與外界的物質交流和細胞之間的信息交流,對微生物的生長繁殖產生不利影響.當Fe(Ⅲ)在細胞周質或表面結晶時會損壞細胞膜、蛋白和其他細胞結構,破壞細胞吸收營養物質的滲透壓,阻礙微生物生長繁殖;當Fe(Ⅱ)進入細胞質,會占用蛋白質上其他金屬的位點,進行具有破壞性的氧化還原反應[37-38].

(a) ORP

(b) pH
對6 mmol/L Fe2++菌組反應120 h后的沉淀產物進行表征.XRD數據顯示,分離出的沉淀產物中有兩種不同的晶體結構(圖9).在2θ為21.223°、33.242°、36.650°、47.306°、53.283°、63.976°處,分別代表晶體在(1,1,0)、(1,3,0)、(1,1,1)、(0,4,1)、(2,2,1)、(0,6,1)晶面的衍射峰,這些衍射峰均表明這一晶體的化學式為FeO(OH),PDF卡片為ICOD File No. 00-029-0713.而在2θ=26.677°處的衍射峰則代表Fe3(PO4)2(H2O)8(ICOD File No. 01-079-1928)的(1,2,1)晶面.體系中FeO(OH)的生成證實了菌株ZY630能夠以Fe2+為電子供體,發生亞鐵氧化硝酸鹽還原反應.結合體系中pH變化情況,推測反應方程式為式(1)~(3).產物中檢出八水合磷酸亞鐵,表明在120 h時6 mmol/L Fe2++菌組中的Fe2+未全部轉化為Fe3+,其沉淀以磷酸水合物的形式存在,符合圖6所示.

(a) 48 h

(b) 120 h

圖9 菌株ZY630亞鐵氧化硝酸鹽還原產物的 XRD分析Fig.9 XRD analysis of nitrate reduction products from ferrous oxidation of strain ZY630

4H+
(1)
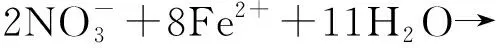
14H+
(2)

18H+
(3)


圖10 亞硝酸鹽體系濃度隨時間的變化Fig.10 Variation of concentration in nitrite system with time


10H+
(4)

6H+
(5)

圖11 亞硝酸鹽體系Fe2+濃度隨時間的變化Fig.11 Variation of Fe2+ concentration in nitrite system with time
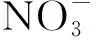
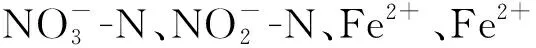
表1 加菌加Fe2+的硝酸鹽還原體系各時間段氧化總量與還原總量的摩爾比及變化情況
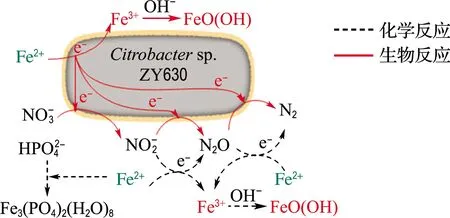
圖12 主要反應機理圖Fig.12 Main reaction mechanism diagram
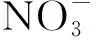

3 結論與展望
(1)從實驗室中分離、純化出一株反硝化細菌,從形態和16S rDNA分析,確定其為檸檬酸桿菌,命名為Citrobactersp. ZY630.對該菌株進行功能探究,發現其具有亞鐵氧化硝酸鹽還原的功能.



