醋酸桿菌A.pasteurianus SP001冷凍干燥工藝研究
孫一帆,陳思,梁新紅,高瑩瑩
(河南科技學院 食品學院,河南 新鄉 453003)
隨著人們生活水平的不斷提高和對食醋的營養價值和保鍵功能的充分認識,以及科學研究對果醋功效特性的提示,市場上對果醋的需求量越來越大[1-3]。醋酸桿菌是醋酸發酵工業的主要用菌[4-5],因醋酸菌具有自滅性、易變異,不易保藏等特點[6],所以對醋酸桿菌的保藏方法和效果的研究具有重要的現實意義。為了在釀造生產過程中選育到優秀的醋酸菌菌株,選擇適宜的保藏方法尤為重要。醋酸桿菌的常規保藏方法為斜面保藏和液體保藏,都需要定期傳代[7]。但是醋酸桿菌與其他菌種不同,很容易變異[8]。而定期傳代又增加了其退化和變異的概率,這樣會使寶貴的醋酸菌菌株得而復失,讓今后的研究不能正常進行,甚至可能會給工業生產帶來很大的損失和危害[9]。因此,為了保持醋酸菌的優良性狀和活力,選擇適宜的保藏方法尤為重要[10]。在眾多醋酸桿菌的保藏方法中,真空冷凍干燥保藏的方法提供的低溫、真空以及干燥的條件,可以使所保藏的菌株活性保存10年以上,且當菌種被應用時,只需要添加水分進行復水活化,具有使用方便、易保藏等特點[11-12]。
真空冷凍干燥方法的基本工藝是先將目標菌株進行高密度培養,在菌株活力和濃度較高時收集菌體,然后將收集到的菌體懸浮在適宜的冷凍保護劑中進行預凍,真空冷凍干燥過程中影響微生物活性的因素很多,其中預凍溫度和保護劑種類的影響尤為突出[13-15]。本試驗主要研究了保護劑的種類和預凍溫度對醋酸桿菌活菌數及產酸量的影響,以期為果醋工業生產提供高活性醋酸菌凍干粉。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
醋酸桿菌:A.pasteurianusSP001, 河南科技學院食品學院分離、鑒定、純化。
1.1.2 試劑
酵母膏、MgSO4·7H2O、KH2PO4、葡萄糖、無水乙醇、瓊脂、K2HPO4、氫氧化鈉、海藻糖、磷酸鉀緩沖液(分別配制濃度為0.05 mol/L的KH2PO4和0.05 mol/L的K2HPO4溶液,然后將配制好的兩種溶液混合,調節pH值范圍為5.5~6.0即可)、甘露醇、結晶紫、碘液、95%酒精、沙黃、香柏油、二甲苯。
1.1.3 主要儀器
SW-CJ-ID單人單面垂直送風(經濟型)凈化工作臺 蘇州智凈凈化設備有限公司;WFJ7200分光光度計 尤尼柯儀器有限公司;FA124電子天平 上海舜宇恒平科學儀器有限公司;SHP恒溫生化培養箱 北京中興偉業儀器有限公司;XSP-BM-2CA生物顯微鏡 上海彼愛姆光學儀器制造有限公司;LDZX-50KBS立式壓力蒸汽滅菌鍋 上海申安醫療器械廠;H1850R離心機 湖南湘儀實驗室儀器開發有限公司;1-4LSC冷凍干燥機、搖床 上海通特電訊設備廠;PHS-3C pH計 上海盛磁儀器有限公司。
1.2 試驗方法
1.2.1 冷凍干燥前菌種生長曲線的測定
1.2.1.1 液體培養基的配制
酵母膏1%、MgSO4·7H2O 0.2%、KH2PO40.3%、葡萄糖2%、pH值自然,于121 ℃滅菌20 min,備用,使用時加入3%的無水乙醇。
1.2.1.2 培養
分別編號1,2,3,4,5,6,7。每個錐形瓶中含液量100 mL,按照無菌操作法向7個錐形瓶中分別加入3%的無水乙醇和10%的果醋。接種后的錐形瓶置于搖床上,在30 ℃、100 r/min的條件下振蕩培養,其中1號置于冰箱中作為對照。
1.2.1.3 測定
每隔3 h于波長610 nm處用分光光度計測定上述細菌菌懸液的吸光值。
1.2.1.4 繪制曲線
以細菌菌懸液的吸光值為縱坐標、培養時間為橫坐標,繪制其生長曲線。
1.2.2 菌懸液的制備
取3瓶裝有液體培養基的錐形瓶,每個錐形瓶中含液量100 mL,按照無菌操作法向3個錐形瓶中分別加入3%的無水乙醇和10%的葡萄醋。接種后的錐形瓶置于搖床上,在30 ℃、100 r/min的條件下振蕩培養,培養至菌密度最大,于4 ℃保存,用于冷凍干燥。
1.2.3 冷凍干燥
將菌密度達到最大時的菌懸液在9600 r/min、4 ℃的條件下離心10 min,倒去上清液,沉淀物用磷酸鉀緩沖液溶解后在上述條件下再次離心,除去上清液后沉淀物用保護劑溶解,然后倒入培養皿中,每個培養皿中的液體厚度不能超過2 mm。將上述分裝好的培養皿口用保鮮膜封好,置于不同的溫度條件下預凍12 h,然后用冷凍干燥機進行真空冷凍干燥。
1.3 分析方法
1.3.1 活菌計數
液體培養基的配制:酵母膏1%、MgSO4·7H2O 0.2%、KH2PO40.3%、葡萄糖2%、瓊脂2%、pH值自然,于121 ℃滅菌20 min,備用,使用時加入3%的無水乙醇。在無菌工作臺上,將凍干后的菌種用無菌水溶解,用移液槍吸取0.3 mL的稀釋液于平板上,然后置于30 ℃的恒溫箱中培養3~4 d后進行活菌計數。
1.3.2 醋酸含量的測定
以標定后的氫氧化鈉溶液(濃度接近0.1 mol/L)滴定發酵液,指示劑為酚酞試劑,結果以醋酸(g/dL)計。為了保證測定結果的準確性,每次測定進行統一操作,步驟:1 mL發酵液→加入9 mL蒸餾水→加2滴酚酞→滴定記錄。
1.3.3 產酸曲線的測定
將干燥后的菌種用無菌水溶解,接種于產酸培養基中,測定其產酸量,以時間為橫坐標、產酸量(g/dL)為縱坐標繪制曲線,并與冷凍干燥前菌株的產酸量進行對比。
1.3.4 凍干前后酒精轉化率的計算
將凍干前后的菌株接入液體培養基中,測定其最大產酸量,進而計算其酒精轉化率。
轉化率(%)=產酸量(g/L)/發酵液酒精含量(g/L)/1.304。
產酸量(g/L)=最大產酸量(g/L)-培養基含酸量(g/L)-接入菌種的含酸量(g/L)。
1.3.5 冷凍干燥前后菌株在葡萄酒中的發酵效果的比較
分別將冷凍干燥前后的菌株接入液體培養基中,在30 ℃、100 r/min 的搖床中培養3~4 d,使菌株活化,然后按照10%的接種量分別將冷凍干燥前后的菌種接入葡萄酒中,測定其產酸量,從而對真空冷凍干燥前后的菌株在葡萄酒中的發酵效果及發酵周期進行比較。
1.4 統計分析方法
采用DPS 7.55數據處理軟件對試驗數據的方差顯著性進行分析。
2 結果與分析
2.1 冷凍干燥前醋酸桿菌SP001生長曲線的測定
按照1.2.1所述生長曲線的測定方法,分別將編號1,2,3,4,5,6,7的每個錐形瓶中裝入液體培養基100 mL,按照無菌操作法向7個錐形瓶中分別加入3%的無水乙醇和10%的米醋。接種后的錐形瓶置于搖床上,在30 ℃、100 r/min的條件下振蕩培養,其中1號置于冰箱中作為對照。然后每隔3 h于波長610 nm處用分光光度計測定細菌菌懸液的吸光值。以時間為橫坐標、吸光值為縱坐標繪制曲線,結果見圖1。

圖1 冷凍干燥前A. pasteurianus SP001的生長曲線Fig.1 The growth curve of A. pasteurianus SP001 before freeze drying
由圖1可知,0~10 h為A.pasteurianusSP001的延滯期,12~36 h為A.pasteurianusSP001的對數生長期,36~66 h為穩定期,66 h后,菌體生長速率小于其死亡速率,進入衰亡期。因此,用于真空冷凍干燥的菌體應為培養到36 h的菌體,以使冷凍干燥后獲得較多的菌體。
2.2 預凍溫度對冷凍干燥后菌種活性的影響
依據1.2.3和1.3.1的方法,對預凍后的菌體進行活菌計數,結果見圖2。

圖2 預凍溫度對冷凍干燥后菌株活性的影響Fig.2 Effect of pre-freezing temperature on the activity of bacteria after freeze drying
由圖2可知,預凍溫度為-30 ℃時,當保護劑為10%的葡萄糖+2%的海藻糖時,其活菌數為(450±21) CFU/mL,當保護劑為10%的甘露醇時,其活菌數為(260±12) CFU/mL。而當預凍溫度為-60 ℃時,兩種保護劑的活菌數分別為(680±23) CFU/mL和(500±19) CFU/mL。當預凍溫度為-90 ℃時,兩種保護劑的活菌數分別為(520±16) CFU/mL和(310±12) CFU/mL。-60 ℃預凍的效果比-30 ℃預凍的效果較好,這可能是因為菌懸液在-30 ℃預凍時,其溫度已降至冰點以下,但結冰不夠堅實,真空干燥時易使菌懸液沸騰,菌體細胞受損失較多。而在-60 ℃預凍時,結冰速度快且堅實,細胞損傷較少。因此,-60 ℃的預凍溫度最好。
2.3 保護劑種類對冷凍干燥后菌株活性的影響
2.3.1 不同保護劑對冷凍干燥后狀態的影響
按照1.2.3所述的方法進行真空冷凍干燥,經過冷凍干燥后,菌體與保護劑的混合物失去水分而成干燥狀態,結果見圖3和圖4。

圖3 10%的葡萄糖+2%的海藻糖
圖4 10%的甘露醇
由圖3和圖4可知,保護劑為10%的葡萄糖+2%的海藻糖時,冷凍干燥后培養皿中的糖分殘余物較少,而當保護劑為10%的甘露醇時,培養皿中的固體殘余物較多,冷凍干燥后除去水分,使甘露醇過飽和而析出,與溶解前的狀態無太大差異,因此從這方面來看,以10%的葡萄糖+2%的海藻糖為保護劑的冷凍干燥效果比較好。
2.3.2 不同保護劑對冷凍干燥后菌種活性的影響
按照1.2.3和1.3.1的方法,對不同保護劑對冷卻干燥后菌株活性進行研究,結果見圖5。

圖5 不同保護劑對冷凍干燥后菌株活性的影響Fig.5 Effects of different protective agents on the activity of bacteria after freeze drying
由圖5可知,在-60 ℃的預凍溫度下,以10%的葡萄糖+2%的海藻糖為保護劑時,活菌數為(680±23) CFU/mL,而當以10%的甘露醇為保護劑時,活菌數為(500±19) CFU/mL。兩者相差180 CFU/mL,因此,由上述結果可知以10%葡萄糖+2%的海藻糖為保護劑的細胞存活數較高,而以10%的甘露醇為保護劑的細胞存活數較低。因此,選擇10%的葡萄糖+2%的海藻糖作為A.pasteurianusSP001的凍干保護劑。
2.4 冷凍干燥干燥前后菌種產酸曲線的比較
按照1.2.1和1.3.2的方法,將干燥前后的菌種分別接種在液體培養基中,測定其產酸量(g/dL),結果見圖6。
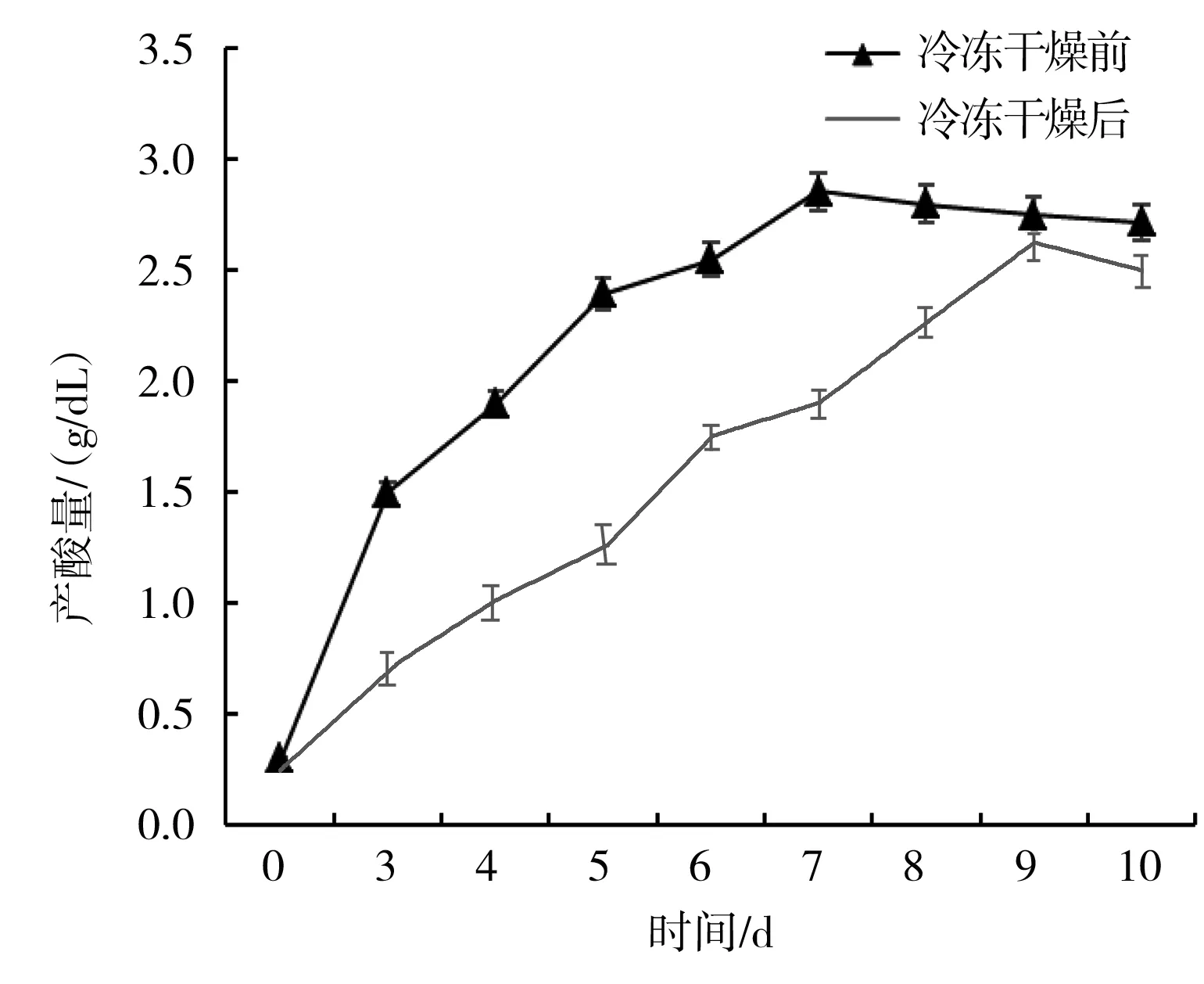
圖6 冷凍干燥前后菌種的產酸量比較Fig.6 Comparison of acid production of bacteria before and after freeze drying
由圖6可知,隨著發酵時間的進行,冷凍干燥前后的菌種在發酵過程中產酸量都有所增加,真空冷凍干燥前的A.pasteurianusSP001在第7天時產酸量達到了最大值,即(2.86±0.08) g/dL,而冷凍干燥后的菌種在第9天的達到最大產酸量(2.63±0.07) g/dL,兩者的最大值相差0.23 g/dL,相差量為8.1%,但是,在醋酸發酵的第3天到第5天,冷凍干燥前后產酸量明顯不同,冷凍干燥后菌種延滯期延長,因此,要獲得較高產酸量,冷凍干燥后A.pasteurianusSP001發酵時間最佳為9 d。
2.5 凍干前后乙醇轉化率的比較
依照1.3.3的方法,將凍干前后的菌種接入培養基中,測定其最大產酸量,計算其酒精轉化率,結果見表1。

表1 冷凍干燥前后菌種的酒精轉化率Table 1 The ethanol conversion rate before and after freeze drying
由表1可知,真空冷凍干燥前菌種的酒精轉化率為73.00%,冷凍干燥后菌種的酒精轉化率為67.67%,表明冷凍干燥對菌株與未凍干菌株的活性有差異顯著性,其差值為5.33%。
2.6 冷凍干燥前后菌種在葡萄酒中發酵效果
按照1.3.5的方法,分別將冷凍干燥前后的菌種接入葡萄酒中,將葡萄酒發酵轉化為葡萄醋,在發酵過程中,測定其產酸量(g/dL),分析冷凍干燥前后菌種的活性以及發酵周期的差別,結果見圖7。
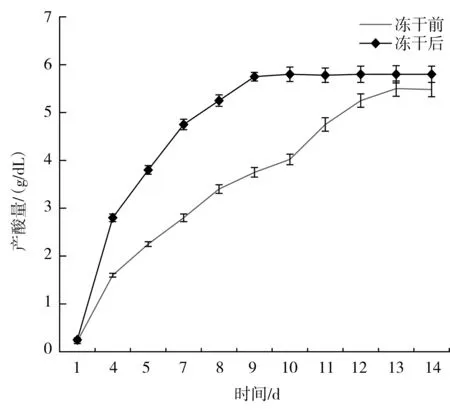
圖7 冷凍干燥對A. pasteurianus SP001在葡萄酒中發酵的影響Fig.7 Effect of freeze drying on the fermentation of A. pasteurianus SP001 in wine
由圖7可知,真空冷凍干燥前,菌種在葡萄酒中發酵,在第10天就達到最大產酸量(6.06±0.14) g/dL,而冷凍干燥后的菌種在第13天時達到最大產酸量(5.85±0.15) g/dL,并趨于穩定。冷凍干燥前后最大產酸量相差0.21 g/dL,其相差量為3.5%,但是冷凍干燥后的發酵周期卻延長1 d。
3 結論
以A.pasteurianusSP001為研究對象,通過對真空冷凍干燥過程中預凍溫度和保護劑種類的研究,采用10%葡萄糖+2%海藻糖制成的醋酸菌保護劑,經-60 ℃的預凍所制成的凍干菌的保藏效果良好。A.pasteurianusSP001培養36 h后進行冷凍干燥,凍干粉在乙醇含量為3%(V/V)培養基中培養9 d時醋酸產量最大,產值為(2.63±0.07) g/dL,在乙醇含量為6%(V/V)葡萄酒中發酵第13天醋酸產量最大,產值為(5.85±0.15) g/dL。真空冷凍干燥后菌種活性較好,能夠進行果醋釀造的工業應用。A.pasteurianusSP001凍干粉發酵時間相對新鮮菌種較長,其原因及機理還需進一步研究。隨著果醋釀造技術的發展以及真空冷凍干燥微生物技術的日益完善,真空冷凍干燥醋酸菌粉必將為果醋行業提供巨大的發展空間,也將為我國食品行業的發展做出很大的貢獻,相信在未來會有更完善的技術和設備在這方面加以應用。

