我院藥物臨床試驗65 例嚴重不良事件報告分析
2022-01-05 09:33:28劉夢曉任祥清周永寧
中國藥業
2021年24期
關鍵詞:報告
任 曼,劉夢曉,李 丹,任祥清,周永寧
(1.蘭州大學第一醫院,甘肅 蘭州 730000;2.蘭州大學第一臨床醫學院,甘肅 蘭州 730000)
藥物臨床試驗是新藥上市前后驗證其有效性和安全性的重要環節,是評價一種新的治療或干預方法的安全性和有效性的“金標準”[1]。嚴重不良事件(SAE)是指臨床試驗過程中發生的,需住院治療、延長住院時間、導致傷殘、影響工作能力、危及生命及死亡、導致先天畸形等的事件[2]。當發生SAE 時,研究者必須在24 h 內報告,并確保相關受試者均能得到及時、合理、有效的救治[3]。本研究中對醫院上報的藥物臨床試驗中受試者發生的SAE 進行統計與分析,為促進藥物臨床試驗的質量控制和規范化管理提供參考[4]。現報道如下。
1 資料與方法
收集醫院2016 年1 月至2019 年12 月上報藥物臨床試驗中65 例受試者發生的SAE,采用SPSS 22.0 統計學軟件,對65 例受試者發生的SAE 報告中涉及臨床試驗項目,受試者性別、年齡,以及上報科室,報告類型,SAE 在不同藥物種類的分布、類型、轉歸、與試驗藥物的相關性、對臨床試驗的影響進行統計與回顧性分析。將同一SAE 上報的首次報告、隨訪、總結報告、修正報告作為1 例SAE,統計SAE 類型及與試驗藥物相關性時,若首次報告、隨訪、總結報告不完全一致,則以總結報告為準統計。
2 結果
2.1 上報SAE 的科室分布及涉及項目
共發生SAE 129 例次(包括1 例妊娠事件),其中2016 年21 例次,2017 年36 例次,2018 年37 例次,2019 年35 例次。血液科上報例數及涉及藥物臨床試驗的項目數均最多,詳見表1。
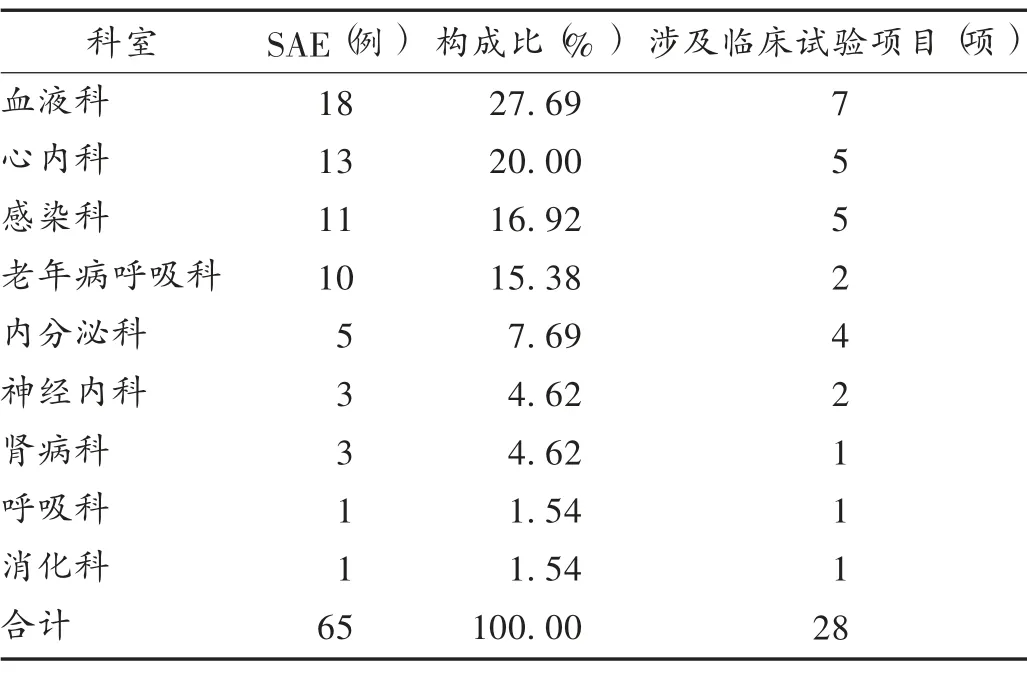
表1 上報SAE 的科室分布及涉及藥物臨……
登錄APP查看全文
猜你喜歡
新西部(2022年3期)2022-04-13 22:20:53
小哥白尼(趣味科學)(2020年7期)2020-05-22 06:48:38
童話世界(2018年25期)2018-10-10 08:14:52
浙江共產黨員(2017年11期)2017-11-15 09:22:06
南方人物周刊(2017年32期)2017-10-28 22:48:36
南風窗(2016年26期)2016-12-24 21:48:09
中國衛生(2016年8期)2016-11-12 13:27:10
南風窗(2015年22期)2015-09-10 07:22:44
南風窗(2015年14期)2015-09-10 07:22:44
南風窗(2015年7期)2015-04-03 01:21:48

