急性胸主動脈綜合征腔內修復術中局部麻醉經皮穿刺與股動脈切開臨床應用對比研究
周鐵楠,劉軒澤,王效增,李智佳,孔德福
北部戰區總醫院 心血管內科,遼寧 沈陽 110016
急性胸主動脈綜合征(acute thoracic aortic syndrome,ATAS)包括主動脈夾層(aortic dissection,AD)、急性主動脈穿透性潰瘍(penetrating aortic ulcer,PAU)、急性主動脈壁內血腫(aortic intramural hematoma,IMH)、假性動脈瘤和主動脈破裂等[1]。目前,ATAS的治療方法有內科保守治療、外科手術治療和胸主動脈腔內修復術(thoracic endovascular aortic repair,TEVAR)。腔內修復術由于具有創傷小、安全性高、療效好、并發癥少及恢復快等優勢,已成為Stanford B型主動脈夾層、胸降主動脈瘤及腎下型腹主動脈瘤治療的首選方法[2-3]。由于覆膜支架輸送器外鞘較粗,既往股動脈入路由外科醫師切開、顯露并縫合,其淋巴管瘺、切口感染、出血等并發癥發生率不容忽視[4-5]。Perclose ProGlide血管縫合器(Abbott公司,美國)的應用使患者免于股動脈切開,較傳統方式具有預埋縫合優勢,穿刺條件下即可完成[6-9]。本研究通過比較局部麻醉經皮穿刺與股動脈切開實施TEVAR的早期療效,以期為手術入路股動脈處理方式選擇提供依據。現報道如下。
1 對象與方法
1.1 研究對象 選取北部戰區總醫院自2018年10月至2020年3月收治的行TEVAR治療的236例ATAS患者為研究對象。根據TEVAR中采用的股動脈處理方式,將其分為A組(n=120)與B組(n=116)。A組采用股動脈切開,B組采用局部麻醉穿刺。納入標準:Stanford B型AD患者;潰瘍直徑≥20 mm或潰瘍深度≥10 mm的急性PAU患者;急性IMH復查計算機斷層掃描血管造影(computed tomography angiography,CTA)提示轉化為PAU、AD的患者;潰瘍直徑<20 mm或潰瘍深度<10 mm的急性PAU患者復查CTA提示轉化為AD、潰瘍直徑或深度增加;胸降主動脈假性動脈瘤患者;升主動脈置換、TEVAR后覆膜支架遠端出現再破口或伴有假性動脈瘤;因外傷導致的胸降主動脈損傷(假性動脈瘤或夾層);胸降主動脈不完全破裂合并左側胸腔積血,經補液或輸血、應用血管活性藥物,血壓穩定正常。排除標準:單純IMH無并發癥,且住院期間生命體征穩定,復查影像血腫面積穩定或減小者;在院期間疼痛再發,復查胸腹主動脈CTA+三維重建,主動脈出現逆行撕裂至升主動脈;潰瘍直徑<20 mm或潰瘍深度<10 mm的患者在院期間復查CTA提示潰瘍直徑、深度穩定;行TEVAR術中發現降主動脈夾層逆行撕裂至升主動脈。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 研究方法 所有患者均行胸腹主動脈CTA+三維重建檢查,明確診斷后分析其主動脈病變的性質、位置、累及范圍、血管供血分支情況等。入院后,給予監測生命體征,藥物治療控制血壓及心率,具體用藥為標準ATAS對癥治療方案[10]。給予鎮靜、鎮痛、通便等對癥治療。待患者生命體征穩定后,擇期行TEVAR治療。B組:局部麻醉下,穿刺左橈動脈,行主動脈造影,確認主動脈夾層范圍及破口位置、參考血管內徑。充分局部麻醉下于股動脈穿刺,植入6F股動脈鞘,造影見穿刺部位為股總動脈,適合血管穿刺后縫合。應用Perclose ProGlide血管縫合器預埋血管縫合線2條,送入10F股動脈鞘,擴張皮下組織及皮緣。給予患者嗎啡0.5 mg皮下注射,0.5 mg靜脈滴注,經加硬導絲推送主動脈覆膜支架,造影定位后逐節釋放。復查造影觀察支架膨脹情況及有無內漏。撤出支架輸送器,順序收緊預埋縫線并剪掉,觀察有無搏動性出血,可吸收線縫合穿刺入路皮下組織及皮緣,加壓包扎。A組:全身麻醉后,穿刺左橈動脈行主動脈造影,其余手術流程為我院標準手術方式[11]。手術完成后,支架撤出輸送器,逐層縫合股動脈前壁、皮下組織及皮膚,敷料包扎。
1.3 觀察指標 記錄并比較兩組患者的一般資料,包括體質量指數(body mass index,BMI)、血管緊張素轉換酶抑制劑(angiotensin-converting enzyme inhibitors,ACEI)、血管緊張素Ⅱ受體拮抗劑(angiotensin Ⅱ receptor antagonists,ARB)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)、谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、白細胞計數(white blood cell,WBC)、血小板計數(platelet,PLT)、血紅蛋白(hemoglobin,HB)、尿素氮(blood urea,BUN)、血肌酐(serum creatinine,SCr)等。記錄并比較兩組患者的手術及住院資料、在院期間臨床不良事件發生情況,以及隨訪結果。
2 結果
2.1 兩組患者一般資料比較 A組冠心病史比例高于B組,CK-MB低于B組,差異均有統計學意義(P<0.05)。見表1。
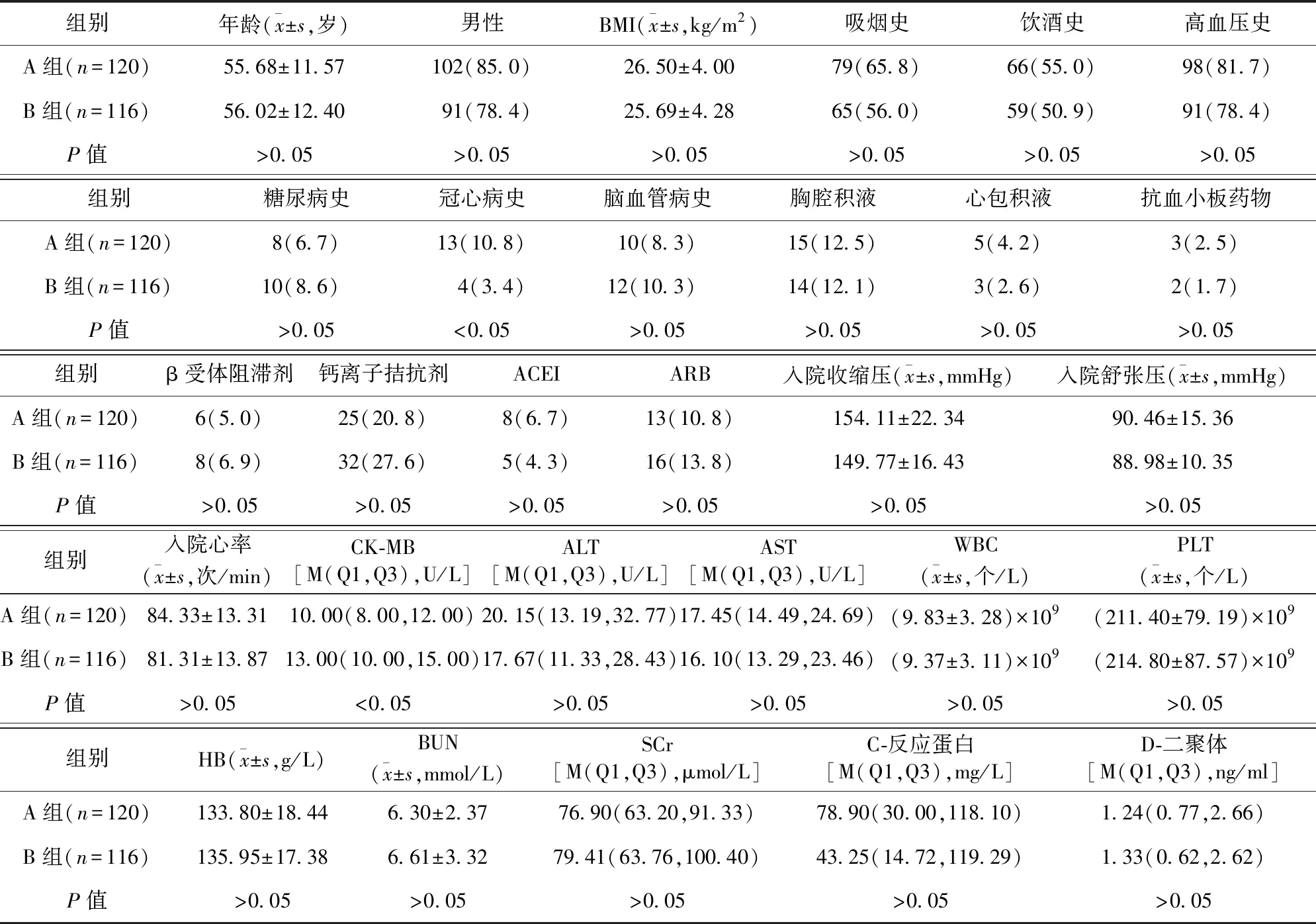
表1 兩組患者一般資料比較/例(百分率/%)
2.2 兩組患者手術及住院資料比較 A組患者的手術時間、住院天數、除支架外住院醫療費用均明顯高于B組,差異均有統計學意義(P<0.05)。見表2。
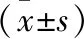
表2 兩組患者手術及住院資料比較
2.3 兩組患者在院期間臨床不良事件比較 A組患者新發急性腎功能衰竭發生率(4.2%比0)、傷口延期愈合發生率(5.8%比0.9%)均明顯高于B組,差異均有統計學意義(P<0.05)。
2.4 兩組患者隨訪結果比較 所有患者均獲得30 d隨訪,隨訪率100%(236/236),共4例死亡,A組、B組各2例。兩組患者全因死亡、新發腦卒中、傷口延期愈合、主動脈相關不良事件、總體不良事件發生率比較,差異均無統計學意義(P>0.05)。
3 討論
Perclose是上市較早的縫線類型血管縫合器,被批準縫合10~20 Fr外徑穿刺口,國外研究觀察了這種預先縫合技術的可行性[6-8]。有研究發現,在靜脈復合麻醉的情況下采用經皮穿刺預縫合技術實施TEVAR,優化了相關手術步驟,但術中仍需要麻醉科醫師協助[9-11]。本研究中,B組患者均采用單純局部麻醉完成穿刺預縫合技術實施TEVAR,進一步縮短了手術時間,同時患者在術中保持清醒狀態,能夠更加清晰了解患者的即時狀態,進一步證明了其安全性。
影響縫合成功率的主要因素包括患者血管情況、肥胖程度、支架輸送器鞘管外徑及術者操作的熟練程度[12]。本研究中,B組患者均順利完成血管縫合器預埋縫合股動脈穿刺點,止血成功率均為100%。成功的前提為:術前根據CTA觀察股動脈入路解剖是否適合此種術式,過度肥胖患者避免使用;約90%患者股動脈分叉位于股骨頭下方四分之一,于股骨頭中緣水平穿刺成功率較高[13];操作時動作要輕柔,在X線透視下進行[13];除充分局部麻醉外,酌情鎮靜,最大程度降低患者疼痛及血管迷走反射;操作結束前體外縫線應保持無張力狀態,不要急于抽離導絲,一旦發現縫合后穿刺點仍有搏動性出血,可經導絲置入縫合器;根據操作時間給予全身肝素化,縫合器止血打結前應用魚精蛋白中和部分肝素;如穿刺傷口直徑較大,縫合后適度力量壓迫3~5 min;預置Perclose縫合器夾角偏小可能導致縫線預置于血管壁相近部位;夾角過大可能導致穿刺部位動脈縮窄或閉塞。
本研究結果顯示,住院期間,A組患者新發急性腎功能衰竭發生率明顯高于B組,差異有統計學意義(P<0.05)。可能的原因為兩組術中血壓控制不同導致對腎灌注差異所致,A組在手術過程中需維持全身麻醉,術中對患者血壓控制范圍更為嚴格,收縮壓需控制在90 mmHg以下釋放支架,以免血壓過高影響支架位置,一過性低血壓可造成腎灌注不足。B組因無麻醉師參與手術,血壓控制有限,支架釋放過程中未執行一過性嚴格降壓,因此對腎供血無明顯影響。本研究結果還顯示,A組患者的手術時間、住院天數、除支架外住院醫療費用均明顯高于B組,差異均有統計學意義(P<0.05)。B組患者主要節省全身麻醉的準備時間,皮膚及皮下組織切開、術后縫合時間。既往研究認為,術中采用Perclose ProGlide裝置費用較高,可能增加患者經濟負擔[13-14]。但B組患者因無麻醉費用,同時住院時間減少、節約住院費用,可完全抵消血管縫合器的額外耗材費用,效價比優于股動脈切開。
綜上所述,對于ATAS患者,術前充分進行評估,局部麻醉經皮穿刺預縫合技術實施TEVAR,安全可行,可明顯減少術后下肢制動與住院時間,降低醫療費用。

