中山杉406ThSHR3 基因的克隆、表達及蛋白互作研究
宣 磊,王芝權,殷云龍,華建峰
(江蘇省中國科學院植物研究所,江蘇省落羽杉屬樹木種質創新與繁育工程研究中心,江蘇南京 210014)
中山杉(Taxodiumhybrid‘Zhongshanshan’)是江蘇省中國科學院植物研究所從落羽杉屬樹木雜交組合中選育出的,是具有一定超親性狀的優良無性系總稱。中山杉具有生長迅速、抗逆性強、景觀性好、成材率高等特點,已在我國沿海防護林建設、公路及城鄉綠化、農田林網和灘涂造林等方面得到廣泛應用[1]。目前,中山杉無性系主要通過嫩枝扦插的方法進行繁殖,近些年林業工作者一直致力于通過中山杉扦插技術改良來提高中山杉的生根率,研究表明:泥炭土、珍珠巖及沙壤土組成的混合基質有利于大多數中山杉無性系生根[2]。植物生長調節物質的濃度對中山杉扦插生根率影響顯著,2000mg·L?1IAA和2000mg·L?1NAA 混合液處理的中山杉無性系插條,生根率和生根數量都顯著提升。然而,在中山杉長期選育過程中發現,不同無性系間生根能力差異顯著,即使優化扦插技術,中山杉302 的平均生根率(57.50%)仍顯著低于中山杉118(83.93%)和406(87.14%)[3-4],且隨著無性系生理年齡的增長,早期選育出的無性系生根力出現衰退現象[1],中山杉的生根機理亟需深入研究。
SHR(SHORT-ROOT)是植物GRAS 家族中與根系發生及形態建成密切相關的一個分支,對根尖干細胞微環境的特化和維持起著關鍵作用,它調控根皮層、內皮層初始細胞及初始細胞子細胞的垂周和平周不均等分裂,影響植物根的輻射式生長模式[5-7]。擬南芥shr突變體植株根尖分生組織的基本組織子細胞不能發生不對稱平周分裂,僅產生一層類似皮層的細胞[8],shr突變體植株表現出主根生長減弱,側根數量減少,植株矮小,子葉顏色深暗等一系列表型。過量表達SHR基因,根尖形態變化顯著,基本組織發生大量的平周分裂,產生多個細胞層[9]。同時,SHR基因是一個功能進化比較保守的基因,目前已在玉米(Zea maysLinn.)[10]、水稻(Oryza sativaLinn.)[11]、毛果楊(Populus trichocarpaTorr.&Gray.)[12]、輻射松(Pinus radiataD.Don)[13]等植物中發現的SHR 家族成員均和根的生長發育息息相關。研究表明:SHR 轉錄功能的行使,通常需要依靠其下游另一個GRAS家族成員SCR(SCARECROW)[14]。SCR 與SHR 形成SCR/SHR 復合體共同激活下游基因表達,SCR/SHR 復合體直接作用于CYCD6.1(Dtype cyclin 6.1)蛋白,CYCD6.1 是細胞發生平周分裂的標志性蛋白,保證根尖細胞會在早期和晚期分別自發地進行2 次平周分裂,產生完整的基本組織[15-17]。國內外學者對于不同植物SHR基因的挖掘以及SHR對根部細胞分裂調控機制的解析一直處于探索之中,本研究在前期已獲得2個中山杉SHR基因(ThSHR1,ThSHR2)的基礎上[18],新篩選到1個在中山杉406 不定根生長期高表達的基因ThSHR3,而ThSHR3的生物學功能尚不清楚,擬通過生物信息學手段對其進行系統進化分析,探索其在中山杉不定根發育過程中表達模式,對ThSHR3 蛋白進行亞細胞定位以及互作研究,推測其可能存在的信號通路。以期為中山杉以及落羽杉屬植物不定根發育的分子機理研究提供新的理論依據。
1 材料和方法
1.1 材料和試劑
“中山杉406”的嫩枝扦插試驗于2019年7月中旬開展于江蘇省中國科學院植物研究所中山杉苗圃內。插穗長度約10~15 cm,扦插基質為珍珠巖和泥炭土,體積比例為1:1,光周期為14 h 的光照周期和10 h 的暗周期。根據中山杉406 插穗基部明顯的形態學改變,在4個時間點取樣:0 d 皮層休眠期(S0),21 d 愈傷組織形成期(S1),35 d初生根形成期(S2)和56 d 根系生長期(S3)[18]。其中,皮層休眠期和愈傷組織形成期的取樣部位為插穗基部皮層組織(0.3 cm 左右),初生根形成期和根系生長期的取樣部位為根系。
RNeasy Plant Mini Kit 及Plant Genomic DNA Kit 購自QIAGEN 公司;PrineScript @ RTase 逆轉錄試劑盒、3′-Full RACE 和5′-FullRACE 試劑盒、LAtaq 酶、rtaq 酶均購自TaKaRa 公司;載體構建使用的GATEWAY 技術及相關試劑均來自Invitrogen公司。
1.2 基因克隆
使用RNeasy Plant Mini Kit 試劑盒提取中山杉406 根總RNA,確保RNA 濃度為1 ng·μL?1,并通過2%瓊脂糖凝膠電泳檢測RNA 的完整性。使用PrineScript @ RTase 逆轉錄試劑盒合成中山杉406 根cDNA,根據前期不定根轉錄組數據,篩選到605 bp 的目的基因ThSHR3的片段(CL8931.Contig2),通過PCR 擴增驗證目的基因序列,PCR 擴增體系如下:cDNA 模板1.0 μL,TaKaRa LA Taq (5 U·μL?1)0.5 μL,10×LA PCR Buffer (Mg2+Free) 5.0 μL,MgCl2(25 mmol·L?1)5.0 μL,dNTP Mixture(各2.5 mmol·L?1)8.0 μL,正向引物(10 μmol·L?1) 2.0 μL,反向引物(10 μmol·L?1) 2.0 μL,加超純水補至50.0 μL。PCR擴增程序為:94℃ 3 min;94℃ 30 s,56℃ 30 s,72℃ 2 min,35個循環;72℃ 10 min。進一步參照TaKaRa 公司3′和5′-Full RACE 試劑盒說明進行巢氏PCR 擴增,完成ThSHR3基因全長克隆,其中,涉及到的引物參考(表1)。將擴增片段序列進行序列比對、拼接,最終獲得了ThSHR3基因的全長cDNA 序列。利用BioXM 軟件預測ThSHR3基因的開放閱讀框(ORF),進一步通過PCR 驗證。
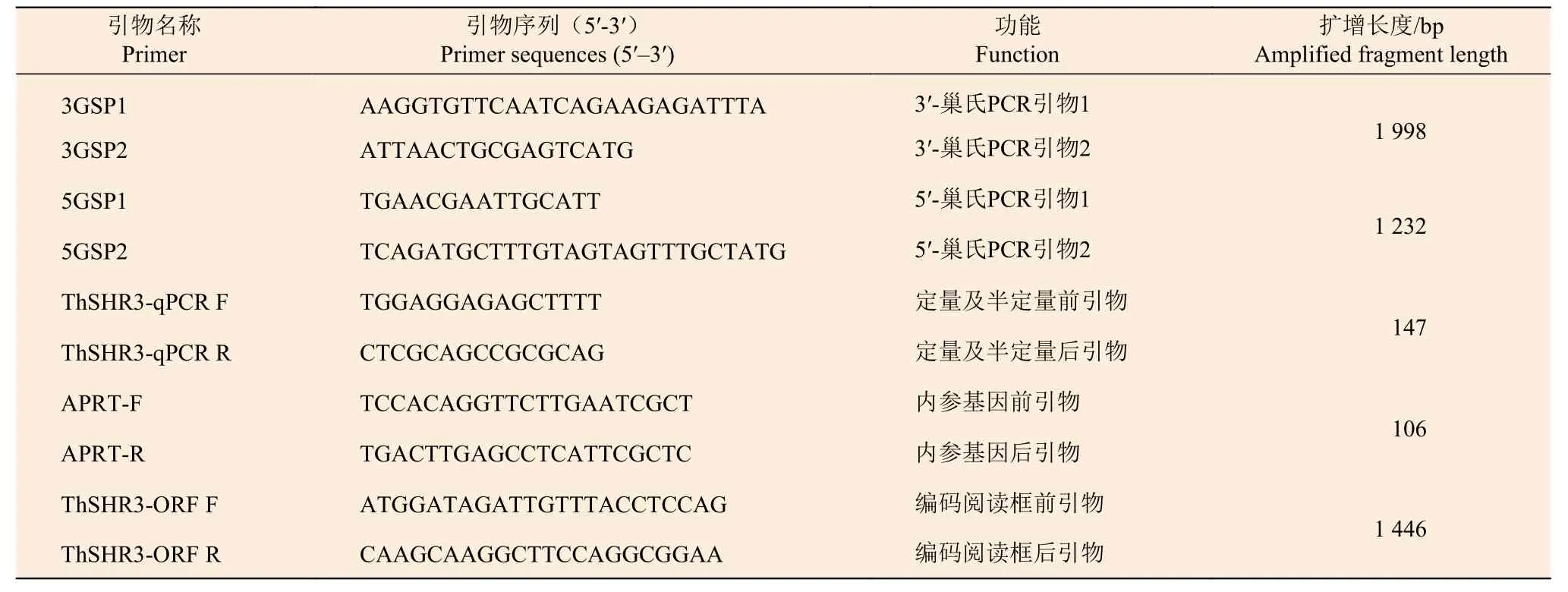
表1 引物序列Table 1 Primer sequences
1.3 生物信息學分析
利用美國國家生物信息中心(NCBI)在線BLAST 軟件比對分析ThSHR3的DNA 和蛋白質序列。使用在線程序Expasy Protparam 計算蛋白質的理論等電點(pI)、分子量(MW)和氨基酸組成。通過PROSITE 以及GORIV 二級結構檢測程序分別預測蛋白質的結構域及二級結構。使用ClustalX2軟件將ThSHR3 的蛋白序列與其他植物已公布的SHR 蛋白序列進行序列多重比對。利用NLStradamus程序預測ThSHR3 蛋白是否具有核定位信號。通過MEGA 7.0 軟件,選用最大似然法構建系統發育樹,自舉檢測1 000 次。
1.4 實時定量及半定量PCR
以中山杉406 不定根發育的4個時間點S0~S3為材料,根據已驗證的cDNA 序列設計定量引物(表1),以中山杉的APRT基因為內參基因[19],采用半定量PCR 和熒光定量PCR 分別對ThSHR3進行表達分析檢測。半定量PCR 反應體系及程序參照rtaq 酶說明書(https://www.takarabiomed.com.cn/)。選擇Analitik Jena qTOWER2.2 PCR 系統(Biometra,德國)進行熒光定量RT-PCR(qPCR)。反應程序設定為:50℃ 2 min;95℃ 10 min;40個循環:95℃ 15 s,60℃ 1 min;通過從60℃到95℃加熱擴增產物,獲得熔解曲線。反應體系共20 μL,其中包括2μL稀釋后的cDNA,10 μL FastStart Universal SYBR Green Master(Rox,德國),10 pmol正向引物,10 pmol 反向引物以及滅菌去離子水,每個樣品設3 次技術重復,采用2?ΔΔCT法進行相對定量的分析[20]。
1.5 載體構建和原生質體瞬時表達
表達的載體構建利用Gateway Technology(Invitrogen,美國)技術,先將不包含終止密碼子的ThSHR3ORF 序列連接到入門載體pCR8/GW/TOPO 上,再使用LR 酶將入門載體連接到包含綠色熒光蛋白(GFP) 標簽的目的載體p2GWF7 上。同理,使用相同的方法構建ThSHR3 及ThSCR 的蛋白互作載體,目的載體為含有黃色熒光蛋白(YFP)標簽的pUC-SPYNE、pUC-SPYCE。最終重組表達載體有:35S::ThSHR3-GFP、ThSHR3-YFPN、ThSHR3-YFPC、ThSCR-YFPN、ThSCR-YFPC。利用PEG 介導轉化法將測序正確的融合表達載體導入楊樹葉肉原生質體中[21]。利用BX51 熒光顯微鏡(Olympus,日本)觀測樣品中熒光表達情況。
2 結果與分析
2.1 ThSHR3 基因克隆及生物信息學分析
根據中山杉不定根發育的轉錄組及蛋白組數據,利用RACE 巢式PCR 擴增,拼接得到ThSHR3基因的全長序列。結果表明:ThSHR3基因的cDNA 全長為2 019 bp,包含1個1 446 bp 的開放閱讀框(ORF),5′端非編碼翻譯區(UTR)長度為354 bp,3′端非編碼翻譯區(UTR)長度為219 bp。ThSHR3基因編碼482個氨基酸殘基。ExpasyProtparma 預測ThSHR3 分子量和等電點分別為66.082 和5.17。GOR IV 的分析結果顯示:ThSHR3 含有30.03%α 螺旋(Hh),15.77% 延伸鏈(Ee),54.19% 的無規則卷曲(Cc),不含有beta 轉角(Tt)。NLStradamus 程序預測ThSHR3 蛋白主要定位在細胞核上。Prosite 分析表明:ThSHR3蛋白具有保守的GRAS 結構域。
2.2 ThSHR3 基因同源性及系統進化分析
將ThSHR3 的蛋白質序列與TAIR 中的擬南芥AtSHR(At4g37650.1) 蛋白序列和楊樹PeSHR1、PeSHR2、PeSHR3 蛋白序列[22],中山杉ThSHR1(MF045148)、ThSHR2(MF045149)蛋白序列進行多重序列比對。結果表明:ThSHR 蛋白的N 端不保守,而C 端相對比較保守,和其他物種的SHR 蛋白一樣,ThSHR 蛋白包括GRAS 家族成員特有的LHRI、VHIID、LHRII、PFYRE 和SAW基礎序列(圖1)。
將ThSHR3 的氨基酸序列與其他物種中已公布的45個較典型的GRAS 蛋白的氨基酸序列進行系統進化樹分析。結果表明:GRAS 蛋白家族可劃分為具有不同的特征的SHR、DELLA、PATl、SCL9、SCR、LAS/SCL18、SCL4/7、HAM 的8個分支[9](圖2)。ThSHR3 被劃分到SHR 分支,和其他物種的SHR 蛋白聚為一類,ThSHR3 和中山杉ThSHR1 親緣關系最近,同源性均為81%,和松科植物PmSHR(QCU71495.1)及輻射松PrSHR(ABW20412.1)的親緣關系也較近(圖2)。
2.3 ThSHR3 基因表達分析
本研究利用半定量PCR 和熒光定量PCR 方法,檢測ThSHR3基因在中山杉406 不定根皮層休眠期、愈傷組織形成期、初生根形成期和根系生長期4個時期的動態表達情況,內參基因均為APRT基因。結果表明:ThSHR3基因在中山杉不定根4個不同發育階段均有表達。ThSHR3表達呈現持續上升的表達模式,在根系生長期表達量最高,在皮層休眠期表達量最低,最高表達量是最低表達量的28.4 倍,且半定量PCR 和熒光定量PCR結果基本一致(圖3)。
2.4 ThSHR3 蛋白的亞細胞定位
本研究以綠色熒光蛋白作為報告基因,在前期已經成熟的楊樹葉肉原生質體瞬時表達體系的基礎上[21],將中山杉重組融合表達載體導入楊樹葉肉原生質體中。經過18 h,23℃暗培養,觀察可得GFP 標簽在488 nm 藍光激發下產生了509 nm 的綠色熒光,陽性對照35S::GFP 在細胞核、細胞質、細胞膜等區域中都產生了明顯的綠色熒光信號,35S::ThSHR3-GFP 融合蛋白僅在細胞核區域產生綠色熒光,表明中山杉ThSHR3基因所編碼的蛋白質定位于細胞核,這和前期在線程序預測結果一致,也符合其作為轉錄因子的特性(圖4)。
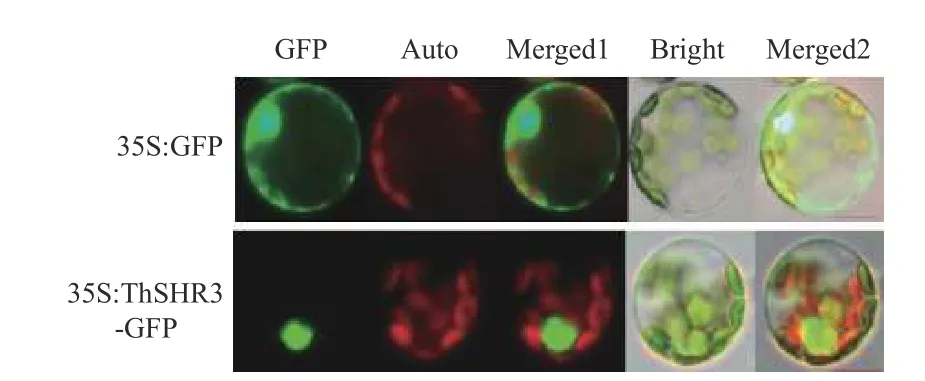
圖4 ThSHR3 在楊樹葉肉原生質體內的亞細胞定位Fig.4 Subcellular-localization of ThSHR3 in Populus mesophyll protoplasts
2.5 ThSHR3 與ThSCR 的蛋白互作
雙分子熒光互補(BiFC)是目前用于檢測細胞體內蛋白質互作的一項成熟技術,本研究利用BiFC 技術檢測中山杉的ThSHR3 與ThSCR 蛋白的互作情況,前期已經證明ThSHR3 及ThSCR 亞細胞定位結果均定位在細胞核[23]。3 次重復性實驗結果顯示:ThSHR3-YFPN與ThSCR-YFPC、ThSHR3-YFPC與ThSCR-YFPN這2個組合的YFP 熒光蛋白重新恢復活性,在細胞核處觀察到清晰的熒光信號,2 組對照組合均無熒光信號產生(圖5),表明ThSHR3 與ThSCR 在細胞核發生了互作。
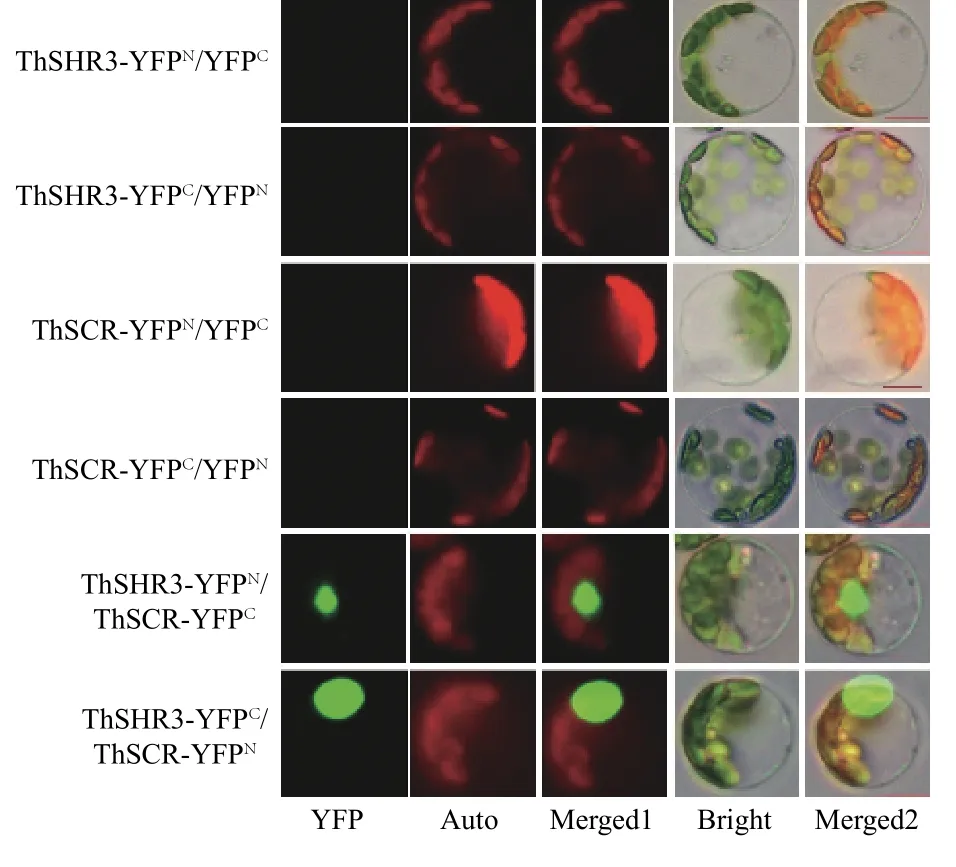
圖5 ThSHR3 和ThSCR 蛋白互作Fig.5 ThSHR3 and ThSCR interaction by BiFC
3 討論
根系是植物長期適應陸地生境而形成的重要器官,根系從土壤中吸收水分和礦質營養,并對植物起機械支撐作用[24]。2000年,Helariutta等首次在擬南芥根中發現了轉錄因子SHR[8],證明其參與根尖輻射形態建成,在基本組織細胞平周分裂形成過程中發揮著的重要作用,進而其他物種的SHR基因陸續被挖掘研究[25]。本研究成功克隆獲得了中山杉406ThSHR3基因全長。經過氨基酸序列比對和系統進化分析發現,ThSHR3和中山杉ThSHR1、ThSHR2高度同源,和其他物種的SHR基因一起劃分到SHR 分支,且具有植物GRAS 蛋白家族特有的結構域,因而推測ThSHR3可能參與中山杉406不定根的發育。
木本模式植物楊樹的SHR分支基因包含3個成員:PeSHR1、PeSHR2、PeSHR3,其表達存在著2種模式,PeSHR1、PeSHR2基因表達量在根的發育過程中呈逐漸上升趨勢,根發育到4 周時表達量最高,而PeSHR3基因在根中的表達模式為先上升后下降[22]。中山杉3個SHR基因的表達特性在不定根不同發育階段是否也存在著差異?研究表明:ThSHR1呈逐漸上升的表達趨勢,在根的生長期表達量最高,而ThSHR2表達量先上升再下降,在初生根形成期表達量最高[23],中山杉ThSHR3和ThSHR1的表達趨勢基本一致,且聚類分析發現二者的同源性較高,推測二者的功能可能更相近。SHR基因家族成員不同的表達模式,暗示著它們可能在根系發育過程中行使著不同的生物學功能,但也不排除它們之間存在功能冗余性,有待通過遺傳轉化等方法進行深入探究。
染色體免疫共沉淀及酵母雙雜交實驗表明,擬南芥中SCR 與SHR 互作區域在LHRI-VHIID-LHRII基序之間[15]。水稻的SHR 與SCR 蛋白也存在著互作,然而水稻的2個SHR基因OsSHR1和OsSHR2,僅發現OsSHR1可與OsSCR發生互作[11]。目前,關于SHR 和SCR 及其互作基因調控根部細胞不均等分裂的研究,主要集中在SHR/SCR/RBR/CYCD6-1-CDK 這信號通路中。SHR/SCR/RBR/CYCD6-1-CDK 是一條雙穩信號回路,細胞周期蛋白CYCD6及其依賴性激酶1-CDK 共同磷酸化RBR(RING Between RING)蛋白,進而影響SCR 蛋白活力,同時CYCD6 轉錄活性又受到SHR-SCR 復合物共同的轉錄調控,此通路中SHR-SCR 復合物的活性適中,才能保證根部細胞不均等分裂有序完成[15]。胥猛等利用BiFC 技術對楊樹SHR/SCR/RBR/CYCD6-1-CDK 信號通路基因的互作進行研究,發現僅PeSHR1 與PeSCR、PeSHR1 與PeCYCD6、PeSCR與PeCYCD6 三個組合發生了互作[22,26]。中山杉SHRSCR 信號通路的研究尚未開展,本研究對中山杉中新挖掘出的ThSHR3 進行了蛋白互作研究,BiFC實驗發現中山杉ThSHR3 可以和ThSCR 發生明顯互作,推測ThSHR3 可能和ThSCR 存在于同一信號通路中,通過形成ThSHR3/ThSCR 復合體來行使轉錄功能;而ThSHR 分支上的其它成員之間以及ThSHR1、ThSHR2 與ThSCR 的互作情況仍然未知,具體的作用機制仍需通過分子生物學手段進一步深入解析。
4 結論
本研究從中山杉406 扦插苗不定根中克隆獲得了ThSHR3基因,該基因編碼的蛋白具有GRAS家族成員特有的保守結構域,且從屬于SHR 亞家族。ThSHR3基因在中山杉皮層休眠期、愈傷組織形成期、初生根形成期、根系生長期4個時期中呈逐漸上升的表達趨勢。雙分子熒光互補實驗顯示:ThSHR3 蛋白和ThSCR 蛋白存在著明顯互作,而SHR-SCR 信號通路在植物根系發育過程中發揮著關鍵調控作用,表明ThSHR3 為中山杉不定根發育相關的重要轉錄因子,為進一步探究中山杉以及落羽杉屬樹木不定根發育的分子機理提供了理論基礎。

