大黃素對高脂飼料誘導ApoE-/-小鼠動脈粥樣硬化的影響
夏 麗,田維毅*,王和生*,李妹娟,張 磊,賴陳岑
(1.貴州中醫藥大學,貴州 貴陽 550000;2.貴州中醫藥大學第一附屬醫院,貴州 貴陽 550000)
近年來,心血管疾病的發生及死亡呈日益年輕化、增長化趨勢,作為其重要病理基礎,動脈粥樣硬化的預防與治療已成為重點研究對象。作為一種慢性炎癥疾病,從血管內脂質條紋產生到纖維斑塊,再進展為動脈粥樣斑塊,到斑塊不穩定和破裂,炎癥反應貫穿于動脈粥樣硬化發生發展的全過程[1],始終都能檢測到各種炎癥細胞和炎癥介質,例如巨噬細胞和白細胞介素等炎癥因子。經研究發現,制首烏中的大黃素具有抗心肌缺血、抗動脈粥樣硬化、降低血脂的作用[2]。本研究旨在研究大黃素對單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、干擾素γ(interferon gamma,IFN-γ)的影響,為今后防治動脈粥樣硬化提供理論依據。
1 材料
1.1 動物與飼料 雄性SPF級C57BL/6 J小鼠12只,ApoE-/-小鼠60只,6周齡,體質量(20±2)g,購自貴州醫科大學,實驗動物生產許可證號SCXK(黔)2012-0001,實驗操作符合倫理委員會要求。高脂飲食按照21%精煉豬油、0.15%膽固醇、78.85%基礎飼料比例制作[3]。
1.2 藥物、試劑與儀器 大黃素(黃色粉末,純度98.7%,貨號BH20150716,西安飛達生物技術有限公司);血脂康(批號Z10950029,北京北大維信生物科技有限公司)。小鼠MCP-1 ELISA試劑盒(貨號EMC113)、小鼠IFN-γ ELISA試劑盒(貨號EMC101)均購自欣博盛生物科技有限公司;脂多糖(貨號L2880,美國Sigma公司)。實時熒光定量PCR儀(型號CFX96)、微電腦PCR儀(型號C1000)均購自美國Bio-Rad公司。
2 方法
2.1 動物模型建立及給藥 將60只成年雄性ApoE-/-小鼠普通飼料喂養1周,隨機分為模型組,大黃素高、中、低劑量組,陽性對照組,每組12只。正常對照組為ApoE-/-小鼠的背景鼠C57BL/6 J成年小鼠,健康雄性,共12只,以基礎飼料常規飼養,灌胃生理鹽水;給藥組小鼠基于高脂飲食,大黃素高、中、低劑量組分別灌胃40、20、10 mg/kg藥物,陽性對照組灌胃200 mg/kg血脂康,連續6周。
2.2 血液、心肌組織采集 給藥6周后隔1 d,小鼠禁食12 h,眼球取血,3 000 r/min離心15 min,分離血清用于生化及ELISA檢測,取小鼠心臟并縱向剪開,得到的心肌組織放入RNA保存液用于提取RNA。
2.3 生化指標檢測 通過全自動酶標儀檢測總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)水平。
2.4 RT-qPCR檢測小鼠心肌組織MCP-1、IFN-γmRNA表達 按說明書提取心肌組織RNA,根據試劑盒說明書,冰上配制各組反應液,進行RT-qPCR分析,反應條件為預變性50 ℃,120 s;95 ℃,600 s;熱循環,95 ℃,15 s;退火60 ℃,60 s,40次循環。采用2-△△CT法計算mRNA表達量,引物序列見表1。

表1 引物序列
2.5 ELISA法檢測血清IFN-γ、MCP-1水平 于對照品孔內滴加梯度濃度對照品,樣品孔內滴加待測樣品,37 ℃水浴鍋孵育90 min,洗板5次,甩凈,于空白孔中滴加抗體稀釋液,其余孔中滴加抗體工作液,37 ℃水浴鍋孵育60 min,洗板5次,甩凈,空白孔加酶結合物稀釋液,其余孔加酶結合物工作液,37 ℃水浴鍋孵育30 min,洗板5次,每孔滴加顯色底物液,封板膠覆蓋反應孔,37 ℃水浴鍋孵育15 min,每孔滴加終止液后,置于酶標儀內,檢測吸光度。
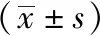
3 結果
3.1 各組小鼠血清中TC、TG、HDL-C、LDL-C水平變化 與正常對照組比較,模型組血清TC、TG、LDL-C水平升高(P<0.05),HDL-C水平降低(P<0.05);與模型組比較,大黃素各劑量組和陽性對照組TC、TG、LDL-C水平均降低(P<0.01),HDL-C水平均升高(P<0.01),見圖1。

注:與正常對照組比較,#P<0.05;與模型組比較,**P<0.01。圖1 各組小鼠血清中TC、TG、HDL-C、LDL-C水平
3.2 各組小鼠心肌組織MCP-1、IFN-γ的mRNA表達 與正常對照組比較,模型組MCP-1 mRNA表達升高(P<0.05),IFN-γmRNA表達降低(P<0.05);與模型組比較,大黃素各劑量組和陽性對照組MCP-1 mRNA表達降低(P<0.01),IFN-γmRNA表達升高(P<0.05,P<0.01),見圖2。

注:與正常對照組比較,#P<0.05;與模型組比較,*P<0.05,**P<0.01。圖2 各組小鼠心肌組織MCP-1、IFN-γ mRNA表達
3.3 各組小鼠血清MCP-1、IFN-γ水平 與正常對照組比較,模型組MCP-1水平升高(P<0.05),IFN-γ水平減低(P<0.05);與模型組比較,大黃素低、中劑量組和陽性對照組血清MCP-1水平降低(P<0.01),IFN-γ水平升高(P<0.01),大黃素高劑量組血清MCP-1、IFN-γ水平均降低(P<0.01),見圖3。

注:與正常對照組比較,#P<0.05;與模型組比較,**P<0.01。圖3 各組小鼠血清MCP-1、IFN-γ水平
4 討論
動脈粥樣硬化作為心腦血管疾病的病理基礎,主要涉及脂類代謝、炎癥與氧化應激等。上世紀90年代動脈粥樣硬化的炎癥理論提出后[4],逐漸被世界廣泛接受。血脂與動脈粥樣硬化之間關系已是眾所周知,現在大多數認可,TC、TG、LDL-C的發展誘導動脈粥樣硬化,尤其ox-LDL刺激泡沫細胞生成從而釋放出更多的炎癥介質加重,而HDL-C則是幫助減少其發生發展[5]。MCP-1是巨噬細胞分泌的促炎癥因子,是加速形成動脈粥樣硬化的重要因素之一。臨床研究發現,患有動脈粥樣硬化內膜斑塊的患者,體內血清MCP-1的水平高于正常組[6]。既往研究表明,MCP-1不僅可以趨使單核細胞聚集,加速泡沫細胞形成,還可以對白介素、腫瘤壞死因子等其余促炎癥因子產生影響,促進血管內皮細胞的增殖,加速動脈粥樣硬化斑塊形成[7-8]。IFN-γ曾用名叫巨噬細胞活化因子,為水溶性二聚體,是Ⅱ型干擾素。研究發現,ApoE-/-小鼠建模成功后主動脈壁斑塊免疫組化中可見IFN-γ呈現陽性,表達高于正常組[9]。IFN-γ是雙向調節因子,在動脈粥樣硬化發生發展過程中扮演重要角色。另有學者報道通過調控IFN-γ可以改善動脈粥樣硬化的病變程度[10],在巨噬細胞中抑制極低密度脂蛋白受體表達,抑制泡沫細胞形成[11]。
大黃素作為制首烏游離蒽醌主要成分,具有抗炎、抗氧化、降低血脂等作用。本課題組前期研究發現,制首烏游離蒽醌抗動脈粥樣硬化作用可能通過上調ABCA1,調控血脂,影響血清NO水平,降低NF-κB、IL-1β表達抑制炎癥反應[12-14]。本研究結果顯示,模型組TC、TG、LDL-C水平較正常對照組升高,提示動脈粥樣硬化模型復制成功;與模型組比較,大黃素各劑量組和陽性對照組TC、TG、LDL-C均有不同程度的下降,提示大黃素可以加速TC、TG、LDL-C的分解,促進血清中HDL-C的合成,起到有良好的調脂作用。從基因表達上看,本研究模型組中MCP-1 mRNA表達升高,IFN-γmRNA表達降低,這與文獻報道一致,進一步說明MCP-1伴隨著動脈粥樣硬化的發展。通過大黃素干預后,MCP-1 mRNA表達降低,IFN-γmRNA表達升高,提示大黃素可以降低MCP-1、升高IFN-γmRNA表達,抑制炎癥反應。ELISA檢測MCP-1水平變化趨勢與基因表達基本一致。大黃素中、低劑量干預后IFN-γ水平升高,而高劑量組表現不同,考慮是大黃素高劑量組在轉錄過程中能升高IFN-γ的表達,但其翻譯修飾等各種因素出現蛋白變化,具體表現差異有待進一步研究。
綜上所述,本研究以ApoE-/-小鼠為對象,炎癥與動脈粥樣硬化的關系為切入點,觀察大黃素對炎癥因子MCP-1、IFN-γ的影響。結果表明,大黃素可以通過調控MCP-1、IFN-γ抑制動脈粥樣硬化的炎癥反應,具有抗炎及抗動脈粥樣硬化的作用,為臨床防治動脈粥樣硬化及藥物的開發提供了新思路。

