薄荷醇促進SK-LU-1細胞凋亡的機制
陶興魁,段 紅,張興桃,馮 凡*
(1.宿州學院生物與食品工程學院,安徽 宿州 234000;2.宿州市天然產物與功能性食品工程技術研究中心,安徽 宿州 234000)
薄荷醇,又稱薄荷腦,是薄荷中的主要成分,一種環類單萜化合物,被廣泛應用于食品、藥品等領域[1]。近年來,關于薄荷醇對各種癌癥細胞的抗癌作用的基礎研究取得了一些進展。研究發現,薄荷醇對前列腺癌、結腸癌等多腫瘤細胞均有抑制作用[2-5],其主要通過誘導腫瘤細胞的周期阻滯、凋亡及信號調控等方式抑制癌細胞增殖[6]。苗延青等[7]研究薄荷醇在適宜的濃度時,對胃癌SGC-7901細胞的增殖抑制作用明顯,抑制率為26.73%~42.53%。薄荷醇可激活DU145細胞中的TRPM8通道,誘導腫瘤細胞中Ca2+熒光強度,從而起到抑制細胞增殖的作用[8]。
目前,其他藥物單體在抗肺癌細胞作用及相關機制等方面已有比較多的研究。羅林明等[9]研究發現,百合總皂苷對肺癌A549細胞增殖、遷移及侵襲具有抑制作用,可通過下調PCNA的表達抑制肺癌細胞DNA合成,通過調控Bcl-2、Bax蛋白表達誘導肺癌細胞的凋亡。顏曉靜等[10]研究丹參-人參組分配伍能夠抑制肺癌A549細胞增殖,誘導凋亡和降低細胞骨架的面積,且抑制效果呈劑量依賴性。但目前關于薄荷醇在抗肺癌機制方面的研究報道較少,對于其通過自噬促進細胞凋亡機制方面的研究鮮見報道。因此,本實驗以人肺癌SK-LU-1細胞為體外研究材料,將不同濃度的薄荷醇作用于肺癌SK-LU-1細胞,分析細胞增殖、凋亡及遷移特性,并檢測自噬信號通路LC-3 Ⅰ/Ⅱ、Beclin-1、Atg12蛋白表達,以期為薄荷醇通過細胞自噬促進肺癌SK-LU-1細胞的凋亡機制提供實驗依據。
1 材料
1.1 細胞 人肺癌SK-LU-1細胞,購自中國科學院生物化學與細胞生物學研究所。
1.2 試劑與藥物 薄荷醇(上海麥克林生化科技有限公司,批號C10458801,純度≥99.5%)。細胞培養基DMEM(北京索萊寶科技有限公司,批號11965);BI胎牛血清(美國Gibco公司,批號10270106);CCK-8試劑盒(上海碧云天生物技術有限公司,批號07302020);5-乙炔基-2′-脫氧尿嘧啶核苷(EdU)試劑盒(廣州市銳博生物科技有限公司,批號R1127);LC-3 Ⅰ/Ⅱ、Atg12、Beclin-1、GAPDH抗體(英國Biorbyt公司,批號orb33328、orb33381、orb380530、orb555879);Bcl-2、Bax、caspase-3、caspase-9抗體(美國CST公司,批號4223-T、5023-T、14220-T、9502-T),保存于宿州學院生物與食品工程學院實驗室;3-甲基腺嘌呤(3-MA)(美國Sigma公司,批號M9281);二抗抗體(美國Bioworld公司,批號BS13278);Transwell小室(美國Corning公司,批號353090)。其他試劑均為分析純。
1.3 儀器 IX71倒置熒光顯微鏡、CX41型光學顯微鏡(日本Olympus公司);流式細胞儀(美國BD公司);Infinite 200 PRO型多功能酶標儀(瑞士Tecan公司);電子天平(萬分之一,美國奧豪斯公司);超微量分光光度計(美國Thermo公司);電泳儀、轉膜儀(美國Bio-Rad公司);熒光成像系統(美國ProteinSimple公司)。
2 方法
2.1 細胞培養 37 ℃水浴加熱解凍SK-LU-1細胞,接種于DMEM培養基(含12%胎牛血清、100 U/mL青霉素-鏈霉素)中,PBS洗滌后胰酶消化,置于5%CO2,37 ℃、飽和濕度培養箱中培養,3~4 d傳代1次,共培養3~4代,取對數生長期的細胞進行實驗。
2.2 CCK-8法檢測薄荷醇對細胞增殖的影響 待細胞生長到對數生長期、密度達到80%以上后將其消化,制成細胞懸液,設置對照組(不加薄荷醇)和給藥組(薄荷醇濃度25、50、100、200、400 μmol/L),每組6個復孔,每孔100 μL細胞懸液(0.6×105/mL)接種于96孔板中[11],置于37 ℃、5%CO2培養箱中培養48 h后,每孔加入100 μL CCK-8溶液(純CCK-8∶純培養基=1∶9),放入CO2培養箱中孵育2 h左右,將處理好的培養板置于酶聯免疫檢測儀中,在450 nm波長處測定吸光度值(A),生長抑制率=(1-A給藥組/A對照組)×100%。
2.3 5-乙炔基-2′脫氧尿嘧啶核苷(EdU)檢測方法檢測薄荷醇對細胞增殖的影響 以每孔1.0×104個細胞接種于96孔板中,置于培養箱中培養24 h,吸棄細胞板舊培養液,給藥組加入含薄荷醇50、100 μmol/L的完全培養液,另外設置對照組(不加薄荷醇),平行6個復孔,加入250 μL溶液,培養箱培養48 h后參照EdU試劑盒步驟進行EdU標記細胞、固定促滲、檢測及DNA復染等操作[12],最后將培養板置于IX71倒置熒光顯微鏡下,隨機選擇拍攝熒光圖像,采用Image J軟件進行計數。
2.4 Transwell法檢測薄荷醇對細胞遷移的影響 取對數生長期細胞,PET膜鋪板,每小室加入200 μL細胞懸液,鋪板時細胞數量為2.6×104個/孔放入每孔提前加好500 μL 20% DMEM的下室中,37 ℃放入二氧化碳培養箱中培養12 h,次日觀察。進行薄荷醇培養操作,設置對照組(不加薄荷醇)和給藥組(加入含薄荷醇50、100 μmol/L的完全培養液),每組3個復孔,每個上室加入200 μL溶液,下室加入500 μL溶液,孵育48 h后室溫固定30 min,染色30 min,棉簽蘸水后吸干,在光學顯微鏡下隨機拍攝圖像,觀察細胞形態[13],采用Image J軟件進行計數。
2.5 Annexin V/PI雙染色法檢測細胞凋亡 取對數生長期細胞,將細胞密度1.0×105/mL的懸浮液接種于培養板上,每組4個復孔,隨機分為對照組(不加薄荷醇)、薄荷醇組(100 μmol/L),在培養箱中孵育48 h后取出,1 000 r/min離心,棄去上清液,根據Annexin V/PI試劑盒說明,用PBS洗細胞2~3次,不含EDTA的胰蛋白酶消化,再用4%PBS洗細胞2次,收集細胞進行重懸,加入5 μL AnnexinV/PI,室溫避光染色10~15 min,加入2.5 μL PI試劑后,30 min內完成細胞凋亡的檢測。
2.6 Western blot法檢測自噬相關蛋白表達 取對數生長期細胞,接種在培養皿中培養,當細胞飽和度達到80%以上時分為對照組(不加薄荷醇)、薄荷醇組(100 μmol/L)、抑制劑組(自噬抑制劑3-甲基腺嘌呤)、薄荷醇+抑制劑組(薄荷醇100 μmol/L+自噬抑制劑3-甲基腺嘌呤),培養48 h,離心分離收集細胞,PBS漂洗2次,加入細胞裂解液進行裂解,收集細胞總蛋白。取蛋白樣品25 μg上樣,SDS-PAGE電泳分離后轉移至PVDF膜,室溫封閉2 h,加入LC-3 Ⅰ/Ⅱ、Beclin-1、Atg12蛋白(1∶1 000)、GAPDH(1∶8 000)抗體,4 ℃孵育12 h,PBS漂洗3次,加入二抗(1∶10 000),室溫下孵育1.5 h,TBST洗膜2次,ECL顯色,用凝膠成像系統拍照,采用Image J軟件分析灰度,計算LC-3 Ⅰ/Ⅱ,Beclin-1、Atg12蛋白相對表達。
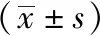
3 結果
3.1 薄荷醇對SK-LU-1細胞增殖的影響 圖1顯示,與對照組比較,不同濃度薄荷醇處理48 h后抑制率升高,并呈濃度依賴性,IC50為97.94 μmol/L,故選擇50、100 μmol/L作為后續實驗藥物濃度。圖2顯示,50 μmol/L薄荷醇對細胞增殖的影響不明顯,而在100 μmol/L下具有抑制作用(P<0.01)。
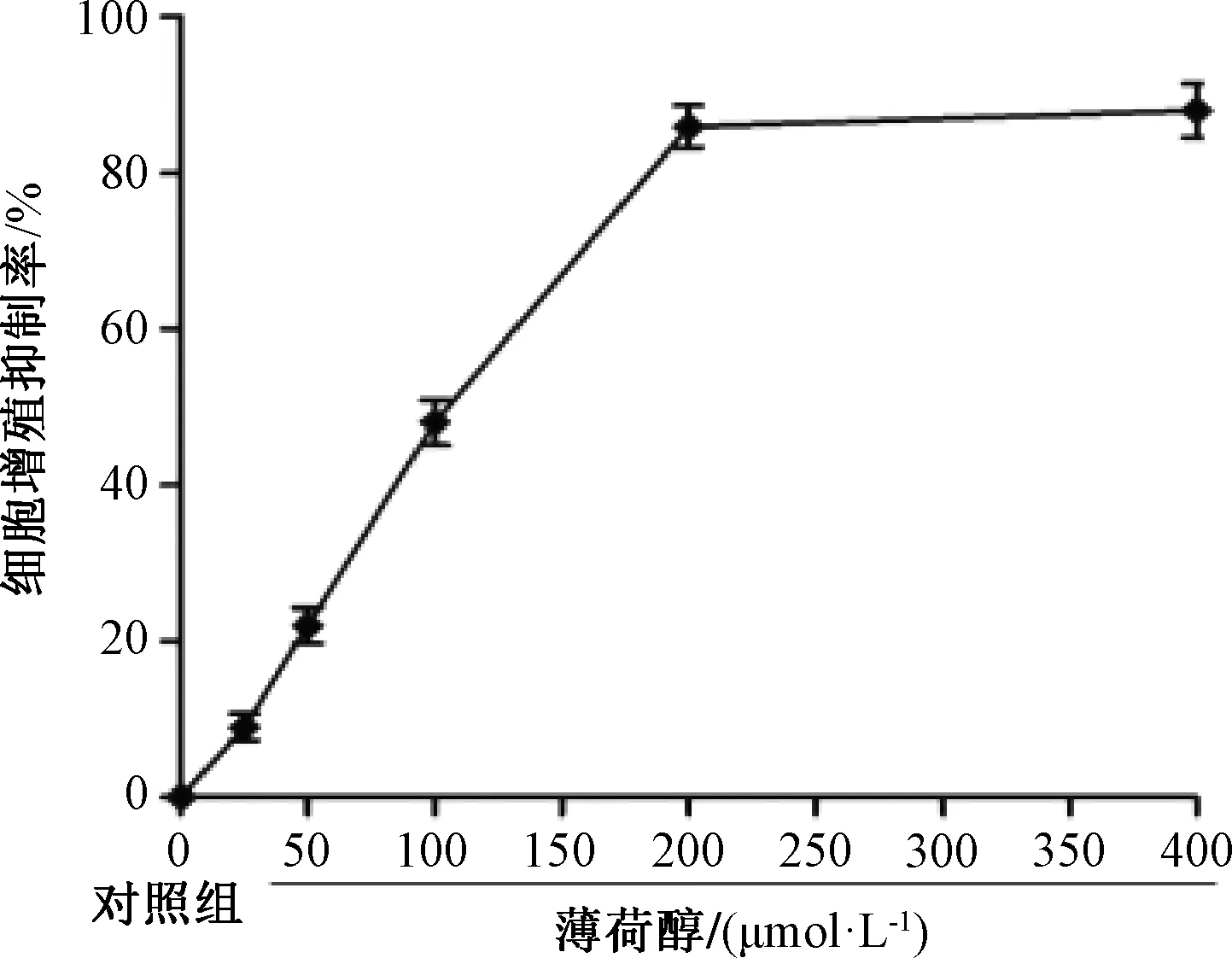
圖1 薄荷醇對SK-LU-1細胞增殖的抑制率
注:A為染色成像圖(EdU,×200),B為陽性細胞百分率柱狀圖與對照組比較,**P<0.01。圖2 薄荷醇對SK-LU-1細胞增殖的影響
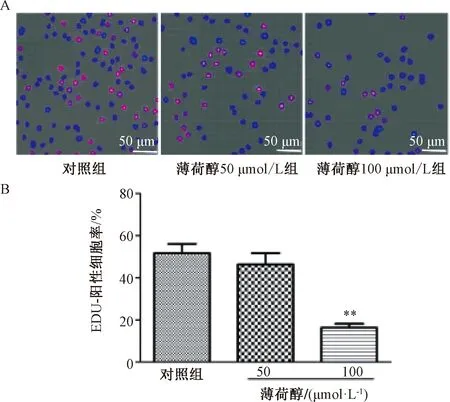
3.2 薄荷醇對SK-LU-1細胞遷移能力的影響 圖3顯示,PET膜上遷移的細胞數目在薄荷醇濃度為50 μmol/L時減少不明顯,而在100 μmol/L下可抑制細胞遷移侵襲,與對照組比較,差異具有統計學意義(P<0.01),與“3.1”項下結果基本一致。
注:A為染色成像圖(結晶紫染色,×200),B為陽性細胞遷移數柱狀圖與對照組比較,**P<0.01。圖3 薄荷醇對SK-LU-1細胞遷移的影響
3.3 薄荷醇對SK-LU-1細胞凋亡的影響 圖4顯示,對照組和給藥組(50、100 μmol/L)細胞早期凋亡率分別為(0.53±0.12)%、(3.83±1.20)%、(21.83±1.87)%,中期凋亡率分別為(0.07%±0.03)%、(2.79±0.78)%、(4.79±1.40)%,晚期凋亡率分別為(0.20±0.05)%、(1.31±0.62)%、(1.30±0.57)%,表明100 μmol/L薄荷醇能促進細胞凋亡(P<0.01)。圖5顯示,100 μmol/L薄荷醇處理后Bcl-2表達降低,Bax、caspase-3、caspase-9表達升高。
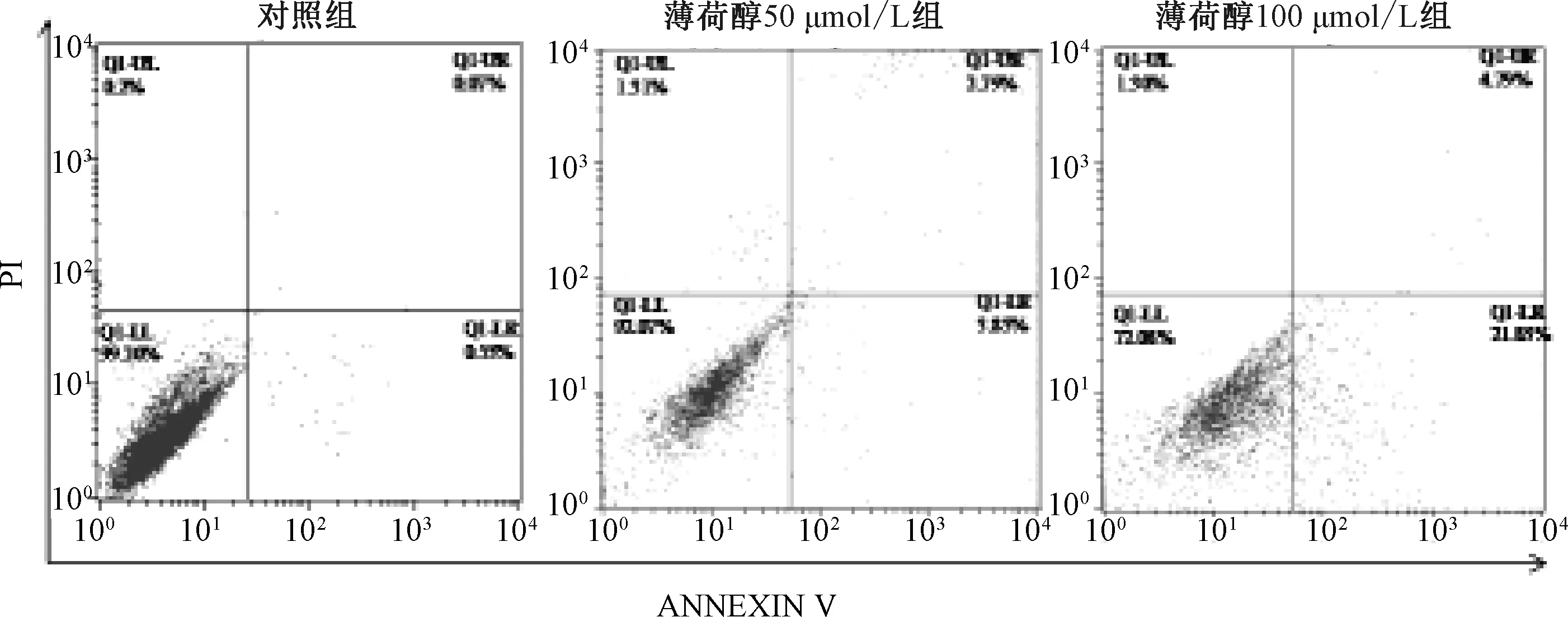
圖4 薄荷醇對SK-LU-1細胞凋亡的影響
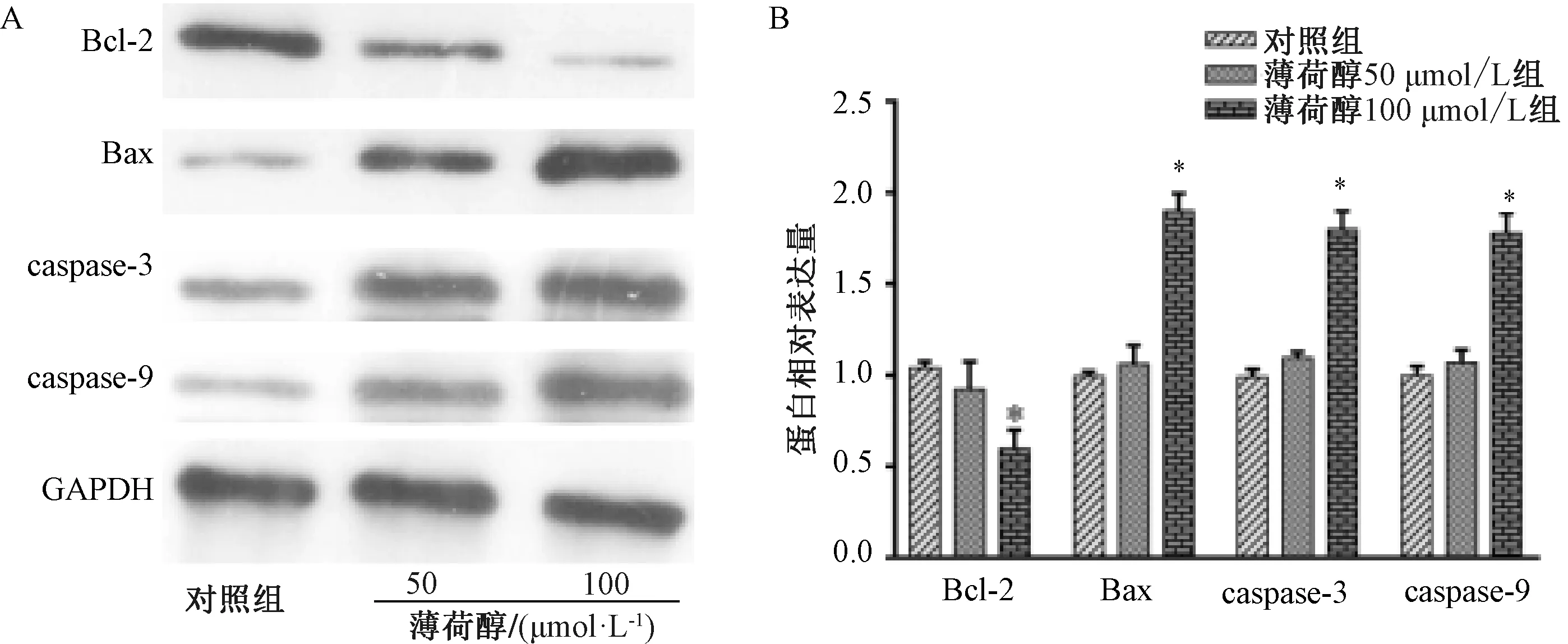
注:A為蛋白免疫印跡圖,B為蛋白條帶灰度值掃描柱狀圖與對照組比較,*P<0.05。圖5 薄荷醇對SK-LU-1細胞凋亡通路蛋白表達的影響
3.4 薄荷醇對SK-LU-1細胞自噬信號通路關鍵調控蛋白的影響 圖6顯示,與對照組比較,給藥組SK-LU-1細胞自噬信號通路蛋白LC-3 Ⅱ/Ⅰ,Beclin-1、Atg12表達升高,差異具有統計學意義(P<0.01);雖然抑制劑組(自噬抑制劑3-甲基腺嘌呤)抑制了自噬信號通路蛋白表達(P<0.05),但薄荷醇+抑制劑組(100 μmol/L薄荷醇+自噬抑制劑3-甲基腺嘌呤)有所提高(P<0.01)。
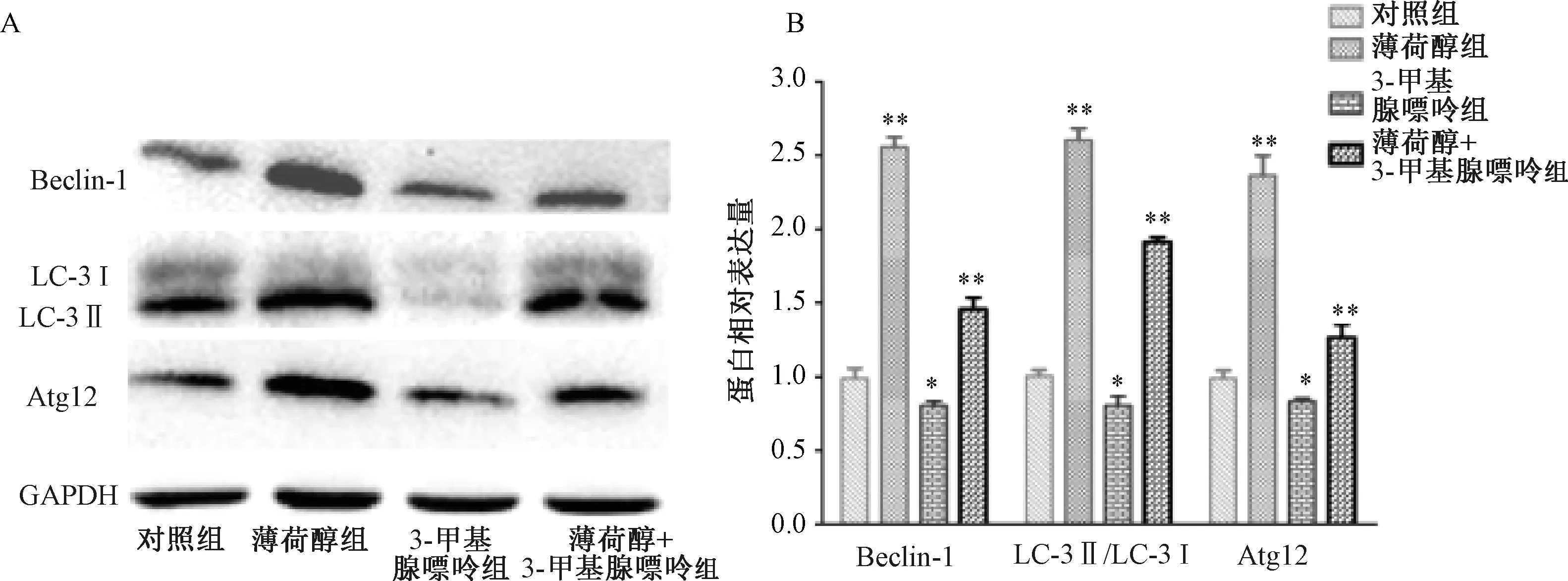
注:A為蛋白免疫印跡圖,B為蛋白條帶灰度值掃描柱狀圖與對照組比較,*P<0.05,**P<0.01。圖6 薄荷醇對SK-LU-1細胞自噬通路蛋白表達的影響
4 討論
薄荷醇在抑制多種腫瘤細胞的的增殖方面已有大量研究,其抑制腫瘤細胞增殖和遷移的可能機制也已有不少報道。研究薄荷醇對小鼠皮膚癌變的預防潛力中發現,薄荷醇能明顯抑制皮膚癌細胞的增殖和生長,顯著降低腫瘤發生率[5]。越來越多的證據表明,薄荷醇通過TRPM8非依賴性途徑抵抗多種人類的癌癥細胞增殖擴散。薄荷醇通過獨立于TRPM8的Ca2+流入機制,促使Ca2+在PC-3細胞中增加,在高濃度薄荷醇作用下可誘導前列腺癌細胞凋亡[14]。研究薄荷醇對PC-3前列腺癌細胞基因表達的影響發現,薄荷醇誘導G2/M阻滯,特別是顯著下調了G2/M期進展的關鍵調控因子PLK1,并抑制了其下游信號通路[15]。還有研究表明薄荷醇可以通過TRPM8通道誘導人膀胱癌細胞系T24細胞線粒體膜去極化,導致細胞死亡[16]。
本研究通過CCK-8法和EdU法研究薄荷醇對肺癌SK-LU-1細胞增殖的影響,結果表明薄荷醇對肺癌SK-LU-1細胞增殖有抑制作用。當薄荷醇濃度為100 μmol/L,肺癌SK-LU-1細胞在作用48 h后抑制作用顯著(P<0.01);分析Transwell遷移實驗結果,薄荷醇對肺癌SK-LU-1細胞遷移作用在100 μmol/L時抑制效果明顯(P<0.01),綜合該部分薄荷醇實驗結果發現,當薄荷醇濃度為100 μmol/L時,肺癌SK-LU-1細胞增殖和遷移抑制作用顯著。
本研究選用肺癌SK-LU-1細胞,流式細胞術檢測薄荷醇對肺癌SK-LU-1細胞凋亡的影響,并且免疫印跡實驗檢測薄荷醇對細胞凋亡通路蛋白表達的影響。結果表明薄荷醇能夠通過降低凋亡通路蛋白Bcl-2的表達以及提高Bax、caspase-3、caspase-9的表達促進肺癌細胞發生細胞凋亡,同時提高自噬信號通路關鍵蛋白LC-3 Ⅱ/Ⅰ、Beclin-1、Atg12的表達。目前的研究顯示Atg5和Atg12為自噬小體形成的“核心”,是啟動自噬小泡形成的重要蛋白質,在癌細胞凋亡過程中起到關鍵調控作用。Atg5可以被Caplains剪切,導致Atg5 N端片段以一種特定未知的機制轉移,在線粒體上與抗凋亡蛋白Bcl-xL結合,促使線粒體細胞大量釋放C色素,從而誘導細胞凋亡[17]。研究發現在不同凋亡因子刺激下,Atg12不但是caspase激活所必需蛋白,它還可通過不同途徑結合Bcl-2、Mcl-1表現促凋亡能力,進一步研究發現,Atg12是因為具備和Bcl-2、Mcl-1結合的BH3結構域而具有促使細胞凋亡功能[18]。而薄荷醇對肺癌SK-LU-1細胞具有明顯的促凋亡作用,且能夠提高Atg12蛋白表達,同時能夠促進形成自噬小體關鍵囊泡蛋白LC-3Ⅱ/Ⅰ和Beclin-1的表達,說明薄荷醇能夠活化肺癌細胞的自噬信號通路,從而誘導肺癌細胞發生凋亡,抑制肺癌細胞的增殖和遷移。該結果為薄荷醇抗肺癌研究及其分子機制研究提供了新思路,為薄荷醇在治療肺癌上提供了新的理論和實驗基礎。

