ARNT調控低氧通路促進小鼠骨骼肌再生的實驗研究
李玢,張譽騰,魯峰
南方醫科大學南方醫院整形美容外科,廣州 510515
骨骼肌的損傷修復是臨床治療的一大難題,研究證實低氧通路活性與骨骼肌再生能力密切相關[1]。低氧誘導因子(hypoxia inducible factor,HIF)以及血管內皮細胞生長因子A(vascular endothelial growth factor-A,VEGF-A)等被認為是促進肌肉再生的重要因素[2,3]。當外界氧氣含量下降時,活性HIF-1α轉移到胞核內,與HIF-1β結合形成特定的低氧應答元件,可以激活下游對血管生成、紅細胞生成等重要基因的表達,從而恢復機體微環境的氧代謝平衡[4]。HIF-1α和HIF-2α進入細胞核的過程,以及異二聚體結合誘導缺氧相關基因的表達都是需要與芳基烴受體核轉運子(aryl hydrocarbon receptor nuclear translocator,ARNT)相結合的。ARNT即HIF-1β,屬于堿性螺旋環螺旋helix-loop-helix(bHLH)-Per-ARNT-Sim家族[5]。ARNT作為一個重要的轉錄調節器,已經被證實參與器官發生,神經發育,以及胎兒生長受限中的血管化受損,并與癌、糖尿病、黑色素瘤等疾病密切相關[6,7]。但在骨骼肌再生過程中,ARNT的作用尚未得到評估。本課題圍繞ARNT在骨骼肌老化及再生過程中的作用及機制進行深入研究,探索改善骨骼肌再生能力的方法。
1 材料和方法
1.1 材料
1.1.1 實驗動物 幼齡組C57BL/6小鼠48只(8~10周、雌雄各半),老齡組C57BL/6小鼠48只(22~24個月、雌雄各半)。環境恒溫、恒濕,每籠飼養小鼠不超過5只,12 h晝夜規律交替,小鼠可隨意取食、飲水。
本實驗使用了可誘導的Cre-lox小鼠品系。ARNTfl/fl小鼠曾被用作高效敲除組織特異性的ARNT相關實驗的動物模型[8]。首先,將轉基因的老鼠品系ARNTfl/fl小鼠與可調控的、其骨骼肌中表達含人骨骼肌肌動蛋白α-actin(HSA)-Cre ER基因的Cre小鼠進行雜交,獲得一個新的轉基因小鼠品系。此轉基因小鼠品系所培育出的后代中,不含Cre ER重組酶的ARNTfl/fl小鼠作為對照組,為ARNT野生型小鼠(ARNT wild type,ARNT WT);而所產生的α-actin(HSA)-Cre ERARNTfl/fl小鼠,為實驗組轉基因小鼠。實驗組小鼠其Cre ER基因在接觸三苯氧胺(Tamoxifen)后會被激活重組并導致骨骼肌細胞中ARNT基因表達的丟失,這種小鼠作為肌肉ARNT敲除小鼠(muscle ARNT knockout,ARNT mKO)。理論上此小鼠只在骨骼肌細胞中失去ARNT基因的表達,并不影響其它組織和器官中ARNT的表達及功能。新生小鼠3周時,取鼠尾血進行基因型檢測并分籠飼養。待小鼠8~10周時,腹腔注射混合玉米油載體(10 μl/g)的三苯氧胺(0.1 mg/g)連續5 d進行基因激活,骨骼肌冰凍損傷實驗在末次注射后1周開始。并于損傷后第5 d、第10 d取材檢測(圖1)。
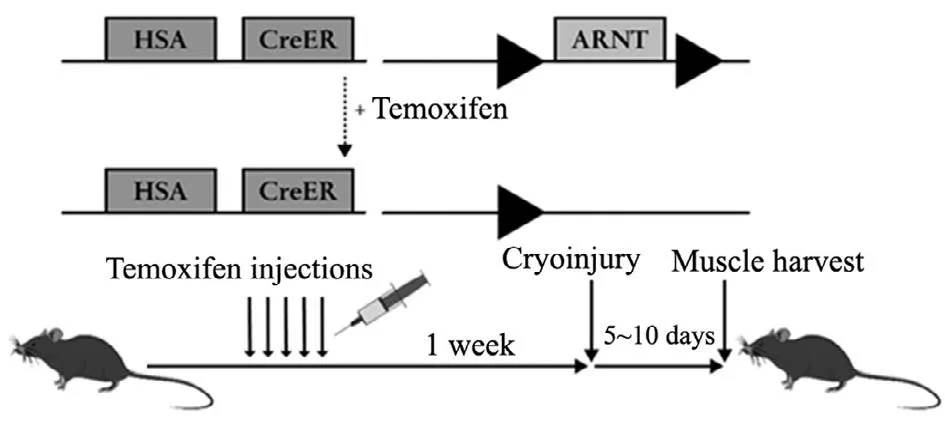
圖1 轉基因小鼠制備模式圖Fig.1 The production model diagram of transgenic mice
1.1.2 主要試劑及儀器 ELISA試劑盒購于美國LS公司,qRT-PCR相關試劑購于美國Qiagen、BIO-RAD公司,Tamoxifen購于美國Sigma公司,ML228購于美國Tocris公司。
1.2 實驗方法
1.2.1 小鼠骨骼肌冰凍損傷模型的構建 將異氟醚麻醉狀態下的小鼠仰臥位置于手術臺上,左后肢備皮,75%酒精消毒術區,鋪無菌孔巾。使用無菌手術刀于小鼠左下肢內側膝關節處做長約2 cm的縱向切口,切開皮膚和皮下組織,鈍性分離肌膜,充分暴露脛骨前肌、股四頭肌及腓腸肌。將在干冰中冷卻的金屬探針放置在目標肌肉上5 s,造成局部的低溫損傷。損傷后立即使用4-0縫線原位縫合皮膚,之后對小鼠進行復蘇。術后即刻予以皮下注射叔丁啡注射液0.03 mg/ml,并每12 h注射0.1 ml,連續3 d,以緩解實驗動物術后的不適感。術后第5、10 d取材。
1.2.2 組織染色切片 4%多聚甲醛固定肌肉,行脫水、包埋等處理制作石蠟切片。蘇木素-伊紅(HE)染色后,將切片置于10倍視顯微鏡下觀察,每個樣本在整個再生區橫截面上拍攝10張照片,使用Image J系統在每張圖像上測量10個再生肌纖維(由其中心位置的細胞核進行識別)的面積。每個樣本統計100個再生肌纖維面積,結果輸入SPSS軟件進行統計分析。
1.2.3 ELISA檢測 使用Mouse HIF1 Alpha ELISA Kit、Mouse ARNT ELISA Kit試劑盒進行檢測。將配制好的梯度標準液加入96孔板中,每孔100μl并至少設定兩排復孔。每孔加入骨骼肌蛋白質樣本100 μl,于37℃溫箱中孵育1 h;加入配液A 100μl,37℃溫箱中孵育1 h;清洗后加入配液B 100μl,37℃溫箱中孵育1 h;清洗后加入TMB溶液90μl,于37℃溫箱中孵育20 min后加入終止液50μl終止反應。使用分光光度儀檢測并計算蛋白質含量。
1.2.4 qRT-PCR檢測 使用RNeasy Mini Ki試劑盒進行骨骼肌RNA的提取,nano drop儀器檢測RNA含量,Superscript IIIReverse Transcriptase Supermix Kit試劑盒進行逆轉錄獲得cDNA。96孔板每孔依設計加入:cDNA 1.5μl;上游引物1μl;下游引物1μl;SYBR green supermix 12.5μl;去離子水9μl構成25μl反應體系,其中β-actin設定3個復孔。使用ABI StepOnePlus PCR擴增儀進行擴增,數據采用儀器自帶軟件分析(ABIPrism 7300 SDSSoftware)。所使用的引物序列如表1。

表1 引物序列Tab.1 Primer sequences
1.2.5 多普勒檢測 小鼠異氟醚麻醉滿意后,取俯臥位固定于檢測區,設定檢測儀以4 ms/pixel的速度測量左后肢LDPI平均通量強度。所得數據以平均通量強度表示。
1.3 統計方法
數據以平均值和標準差(Mean±SD)表示。正態分布數據的統計比較采用Student t檢驗進行統計評估;對兩組以上數據進行比較的結果采用單因素方差分析(ANOVA)和Tukey多重比較檢驗,P<0.05有統計學意義。
2 結果
2.1 老齡鼠骨骼肌再生能力顯著低于幼齡鼠
HE染色片中可見同一取材時間點,幼齡鼠的再生骨骼肌纖維面積顯著大于老齡鼠,老齡鼠的骨骼肌再生區域內可見更多的炎性細胞,甚至出現局部壞死,提示衰老導致骨骼肌再生能力下降。ELISA、qRT-PCR、多普勒結果均提示,衰老導致胞質內ARNT含量下降,HIF-1α含量下降、骨骼肌再生相關基因(MyoD、Myogenin和Myf5)的表達以及血流灌注量也均有下調(圖2)。

圖2 幼齡鼠與老齡鼠骨骼肌再生對比A:再生肌纖維橫截面積(HE染色)B:ELISA檢測骨骼肌損傷前后細胞質與細胞核內ARNT蛋白質的表達含量 C:ELISA檢測骨骼肌損傷前后細胞質與細胞核內HIF-1α蛋白質的表達含量 D:qRT-PCR檢測再生骨骼肌相關肌生成基因的表達量 E:多普勒檢測未損傷時左后肢血流 標尺=100μmFig.2 The comparison of muscle regeneration between young and old miceA:Cross-sectional areas of regenerated muscle fibers(HE staining);B:The expressions content of cytoplasmic and nuclear ARNT protein pre-and post-injury detected by ELISA;C:The expressions content of cytoplasmic and nuclear HIF-1αprotein preand post-injury detected by ELISA;D:The expression content of myogenesis genes detected by qRTPCR;E:The blood flow at the hindlimb pre-injury detected by Doppler test;Scale Bar=100μm
2.2 轉基因小鼠模型的ARNT特異性敲除驗證
選取野生型小鼠(ARNT WT)和轉基因小鼠(ARNT mKO)各6只,規律注射三苯氧胺。1周后選取小鼠股四頭肌及心、肝、腎和肺組織,qRT-PCR檢測ARNT、HIF-1α,HIF-2α基因,結果顯示轉基因小鼠骨骼肌中的ARNT表達含量減少了約95%,HIF-1α、HIF-2α的表達含量無明顯變化;在心、肝、腎和肺組織中的ARNT基因表達水平無差異,表明此轉基因小鼠可以達到高效的、特異性的ARNT基因敲除(圖3)。

圖3 qRT-PCR檢測野生型小鼠和轉基因小鼠基因表達A:骨骼肌中ARNT基因的表達B:骨骼肌中HIF-1α,HIF-2α基因的表達C:心、肝、腎和肺組織中ARNT基因的表達水平Fig.3 The comparison of gene expression between ARNTWT and ARNT mKO mice detected by qRT-PCRA:The ARNT gene expression in skeletal muscle;B:The HIF-1αand HIF-2αgene expression in skeletal muscle;C:The ARNT gene expressionsin heart,lung,kidney,and liver
2.3 敲除ARNT基因使骨骼肌再生能力顯著下降
HE染色片中可見同一取材時間點,轉基因小鼠的骨骼肌再生肌纖維面積明顯小于野生型小鼠,提示敲除ARNT基因會使骨骼肌再生能力顯著下降。ELISA檢測提示轉基因小鼠細胞質內的ARNT表達受到抑制;細胞核內的ARNT含量無明顯差別,但HIF-1α表達量明顯下降。qrt-PCR檢測提示轉基因小鼠的肌再生相關基因表達量下降;二組小鼠下肢的血流量無統計學差異(圖4)。

圖4 野生型小鼠與轉基因小鼠骨骼肌再生對比 A:再生肌纖維橫截面積 B:ELISA檢測骨骼肌損傷前后細胞質與細胞核內ARNT蛋白質的表達含量 C:ELISA檢測骨骼肌損傷前后細胞質與細胞核內HIF-1α蛋白質的表達含量 D:qRTPCR檢測再生骨骼肌相關肌生成基因的表達量E:多普勒檢測未損傷時左后肢血流 標尺=100μmFig.4 Thecomparison of muscleregeneration between ARNTWTand ARNTmKOmiceA:Cross-sectional areas of regenerated muscle fibers;B:The expressions content of cytoplasmic and nuclear ARNT protein pre-and post-injury detected by ELISA;C:Theexpressionscontent of cytoplasmic and nuclear HIF-1αprotein pre-and post-injury detected by ELISA;D:The expressions content of myogenesis genes detected by qRT-PCR;E:The of blood flow at the hindlimb pre-injury detected by Doppler test;Scale Bar=100μm
2.4 ML228增強骨骼肌再生能力
目前沒有簡便的外源性ARNT添加方法,本實驗使用一種小分子誘導物—ML228,此化合物可以增加HIF的核易位及促進DNA綁定。實驗組小鼠,將1 mg ML228溶于32 ml二甲基亞砜(Dimethyl sulfoxide,DMSO)溶液中,腹腔注射0.1 ml/次/日,連續5 d;對照組小鼠注射等量的DMSO溶液。于第2次ML228注射之后對小鼠進行冰凍損傷處理,術后第5天、第10天取材(圖5)。

圖5 實驗鼠制備模式圖Fig.5 The production model diagram of mice
HE染色片顯示老齡ML228組小鼠的骨骼肌再生肌纖維面積顯著增加,提示ML228可以提高老齡鼠骨骼肌再生能力。且老齡ML228組小鼠肌內HIF-1α與肌生成基因表達含量升高;兩組小鼠下肢血流量無統計學差異(圖6)。
3 討論
骨骼肌是維持人體正常活動、代謝以及保障個人生長發育和生活品質最重要的儲備。一定范圍內的骨骼肌損傷能夠快速地進行自我修復和再生,但當缺損超過20%,則很難實現自身性的再生修復。本實驗發現隨著年齡的增長,骨骼肌的再生能力呈下降趨勢。幼齡鼠細胞質內的ARNT表達含量顯著高于老齡組,表明ARNT的表達含量也隨著年齡的增長而逐漸降低。實驗觀察到老齡鼠與幼齡鼠細胞質內HIF-1α無差別而細胞核內差異明顯,結合ARNT是低氧通路中HIF-1α向核內轉移并轉錄多個下游低氧通路因子的關鍵因子,提示ARNT的丟失是導致HIF-1α核易位減少的關鍵因素。在特異性敲除骨骼肌ARNT基因后,細胞核內HIF-1α水平顯著降低;添加低氧通路激活劑ML228后HIF-1α水平得到恢復。以上結果均驗證了ARNT是低氧通路中的關鍵因子,是骨骼肌再生過程中的關鍵因子,而低氧通路與骨骼肌再生能力密切相關。
qRT-PCR檢測結果表明,MyoD、Myogenin、Myf5這幾個與骨骼肌再生相關的肌生成基因在老齡鼠組、轉基因小鼠組、老齡DMSO組小鼠中的表達明顯下降,這與骨骼肌再生能力下降的組織學結果相吻合。多普勒測量發現,老齡鼠左下肢中部的血流量與幼齡鼠相比降低約30%,提示骨骼肌再生能力的差異可能與年齡相關的血流量變化有關,然而在轉基因小鼠與野生型小鼠、老齡ML228與老齡DMSO組小鼠中,左下肢血流量并無統計學差異,表明血流灌注不是造成骨骼肌再生能力改變的主要原因。因此,敲除ARNT基因會降低骨骼肌再生能力的機制,是由于ARNT基因沉默改變了缺氧信號,限制了低氧通路相關因子的轉錄和表達,進而對骨骼肌的再生產生了負性的影響。而添加ML228后,低氧信號得到激活,老齡鼠骨骼肌的再生能力得到改善。
ML228是Theriault等人[9]于2012年發現的一種小分子化合物,該化合物在結構上與目前已知的其它HIF激活劑有本質的不同。ML228在體外已被證明可以有效激活HIF及其下游靶點VEGF;且在體內可以促進低氧通路的活化,增加VEGF等相關促血管化因子的表達,達到促進脊髓損傷修復、誘導腫瘤再生等作用[10]。本實驗結果提示ML228可以逆轉受損的骨骼肌再生能力,且是由于ML228增強了低氧通路來實現的,也再一次驗證了ARNT通過減少低氧通路抑制骨骼肌的再生能力。
綜上所述,ARNT隨年齡的增長而表達下降是造成老齡骨骼肌再生能力降低的主要原因,其機制是與年齡相關骨骼肌內低氧通路受到抑制。低氧信號的藥理學激活劑有望改善受損骨骼肌的再生能力,以此為靶點的治療方式為促進老齡人口骨骼肌的再生提供了新的思路。