釀酒酵母表達中華絨鰲蟹甲殼肽及其抗菌功能研究
*杜婕 張容彬 徐浩鵬 周廣帥
(江蘇農林職業技術學院 江蘇 212400)
中華絨螯蟹(Eriocheir sinensis)是我國淡水水產養殖中的重要經濟物種。隨著現代集約化水產養殖的發展,由細菌、病毒和螺原體引起的各種疾病在中華絨鰲蟹的主要養殖區種群中頻繁爆發[1-6],給我國淡水蟹類養殖造成了災難性的經濟損失。
中華絨鰲蟹作為甲殼動物代表物種之一,雖其機體缺乏獲得性免疫系統-特異性免疫,但它們具備非特異性先天免疫系統來保護自己免受微生物病原體的侵害。甲殼動物的血淋巴細胞在其先天性免疫系統發揮著最為重要的免疫防御作用。雖然至今國際上仍沒有一個明確的分類標準,但一般認為可分為3類:大顆粒細胞(granular cells,GC)、小顆粒細胞(semi-granular cells,SGC)又稱為半顆粒細胞,以及無顆粒細胞(agranular)或透明細胞(hyaline cells,HC)。通常認為酚氧化酶類主要存在于大顆粒細胞中,而小顆粒細胞和透明細胞在吞噬病原和凝集作用中發揮著重要的作用。甲殼動物先天免疫系統包括酚氧化酶原激活系統(proPO系統),血淋巴的凝血過程、細胞吞噬和包裹作用、細胞凝集及各種機體通用和特有的抗菌肽(AMP)等來共同抵御病原菌的入侵[7]。AMP幾乎是所有甲殼動物生命體中存在的關鍵防御效應因子[8]。抗菌肽在甲殼動物先天免疫中表現出多種功能,包括殺菌活性和選擇性免疫調節作用[9-10]。由于抗菌肽具有抗革蘭氏陰性和陽性菌,以及真菌、病毒和原生動物病原體的特性,因此非常適合作為新型抗生素及治療劑進行開發研究[7,11]。
甲殼肽(Crustin)是甲殼動物中重要的抗菌肽之一。第一個報道的甲殼肽是從濱蟹(Carcinus maenas)的血淋巴細胞中分離出來的。它是一種分子量為11.5kDa的陽離子蛋白,為一種疏水性抗菌肽,可用于抵御海洋革蘭氏陽性細菌[12]。至今約60多種甲殼肽類基因已經在多種不同的甲殼動物中發現,包括蟹類和對蝦類[13-19]。在對蝦中的這些甲殼肽蛋白通常具有共同的結構:它們均為疏水性蛋白質,在C端區域具有單個乳清酸性蛋白(WAP)結構域[20]。此結構域包含50個氨基酸殘基和8個半胱氨酸殘基,形成四個二硫鍵,稱為四二硫鍵核心結構[13],該結構域包含多種功能,如蛋白酶抑制[21]和抗菌反應[22]。關于抗菌活性,大多數研究表明有活性的甲殼肽(天然和重組的)表現出對革蘭氏陽性菌的抗菌活性。例如上文提到的從C.maenas純化的甲殼肽對藤黃微球菌和草綠色氣球菌等有活性,而這些都是革蘭氏陽性海洋細菌[12]。中國明對蝦的甲殼肽具有抑制革蘭氏陽性菌生長的活性,然而卻幾乎沒有檢測到針對革蘭氏陰性細菌或真菌的活性[23]。此外,也有部分研究[14-16,23]表明,甲殼肽對革蘭氏陽性和革蘭氏陰性細菌菌株均具有抗菌活性。
目前,多數研究人員集中在對中華鱉重要免疫基因全長cDNA序列的克隆和分析,以及分子水平的表達模式和功能分析,但對其蛋白功能的研究報道較少。此外,對這些重要免疫因子在甲殼類動物中蛋白表達的研究主要是通過大腸桿菌原核系統[21-24],而利用酵母真核系統表達基因的研究則較為有限。與大腸桿菌相比,酵母具有先進的異源蛋白質折疊途徑,此外,利用酵母信號序列可以讓酵母細胞分泌正確折疊和加工的蛋白質。隨著工業發酵技術的廣泛應用,酵母在臨床和工業重要蛋白質的表達方面也表現出極大的優勢[25-26]。
釀酒酵母作為一種普遍被認為安全的(GRAS)生物體,它廣泛應用于食品和飲料行業,且已成功表達多種外源真核蛋白,例如:乙肝疫苗、人胰島素、人粒細胞集落刺激因子和人體血管抑制劑等[27]。然而,利用釀酒酵母真核系統表達中華絨鰲蟹甲殼肽基因的研究較少。
在本研究中,我們利用釀酒酵母系統表達了一種中華絨鰲蟹甲殼肽(以下簡稱EsCrustin)。將EsCrustin基因的ORF克隆到質粒載體pHAC181中,然后利用同源重組技術將重組質粒整合到釀酒酵母菌株GAL1-ScRCH1中的GAL1的啟動子下游以啟動表達。在D-半乳糖的誘導下,目的蛋白EsCrustin在酵母細胞中表達,并對重組蛋白的抗菌活性和抗菌功能進行了初步研究。本研究旨在為甲殼類動物先天免疫提供有價值的理論基礎及實驗依據,以期預防和控制水生甲殼動物疾病的發生。
1.實驗材料和方法
(1)實驗動物及實驗菌株
健康的中華絨螯蟹(平均體重25g)來自中國江蘇省句容的某水產養殖場。購買的中華絨鰲蟹飼養在紫外水循環養殖系統中,該系統可保持在水溫為28±1℃下進行充氣和過濾。在實驗前2周,每天以4%體重的比例投喂商業蝦飼料(巴大飼料,南通)。
實驗所用質粒載體pHAC181在LB液體培養基(10g/L蛋白胨,5g/L酵母提取物,10g/L NaCl,pH7.0)中于37℃培養,釀酒酵母菌株GAL1-ScRCH1在30℃ YPD培養基(10g/L酵母提取物、20g/L蛋白胨、20g/L葡萄糖)中進行培養。
(2)中華絨鰲蟹血淋巴中分離RNA及cDNA合成
用75%乙醇擦拭健康的中華絨鰲蟹進行消毒,以500μL ACD-B(14.7g/L葡萄糖,4.8g/L檸檬酸,13.2g/L檸檬酸鈉)作為抗凝劑置于1mL注射器中從其腹部第二附肢中進行血淋巴抽取。然后,將稀釋后的血淋巴在20℃以4000g離心5min,獲得血淋巴細胞,然后根據Trizol試劑盒(Takara,日本)的方法提取血淋巴總RNA。具體步驟為:將0.2mL氯仿及Trizol試劑(Takara,日本)加入到血淋巴細胞中,劇烈搖晃,靜置15min。將混合物4℃ 12000g離心15min,然后將分離出的上層水相中加入異丙醇(0.5mL),4℃、12000g離心10min。去上清,將所得沉淀用75%乙醇洗滌,然后進行空氣干燥,最后溶解于20μL DEPC處理過的無菌水中。通過在紫外-可見分光光度計(Eppendorf,德國)中測量260/280nm和260/230處的吸光度來評估RNA的濃度和質量。選擇符合質量標準的RNA(1.8≤OD260/280≤2.1且OD260/230≥2.0)用于后續cDNA合成。使用1.0%瓊脂糖凝膠電泳檢測總RNA的總體完整性。使用PrimeScript RT Reagent Kit(Takara,日本)對1μg RNA進行cDNA合成。
(3)表達載體的構建及同源重組
將獲得的中華絨鰲蟹甲殼肽cDNA序列(EsCrustin,GenBank登錄號GQ200833.1)[28]使用5'末端分別帶有EcoR I和Sph I位點的特異性引物進行PCR擴增。本實驗使用質粒pHAC181[29]作為目的基因克隆的載體(pHAC181是一種多拷貝質粒,它是在商業化質粒YEplac181中插入了三個HA標簽)。在經過酶切和T4 DNA連接酶(Takara,日本)孵育連接后,將混合物轉化到感受態細胞Trans1-T1(TransGen,中國)中。菌落PCR后,通過限制酶來驗證陽性轉化子,進一步通過DNA測序驗證陽性重組質粒是否正確。使用同源重組技術將目標基因與重組質粒的HA標簽整合到釀酒酵母菌株GAL1-ScRCH1的GAL1啟動子(S.cerevisiae GAL1-ScRCH1為實驗室構建的菌株,用GAL1代替ScRCH1菌株的原啟動子)下游,利用高保真PrimeSTARGXL DNA聚合酶(Takara,日本)和同源重組引物(表1)來擴增同源重組長片段,采用檢測引物用于驗證整合是否成功(表1)。
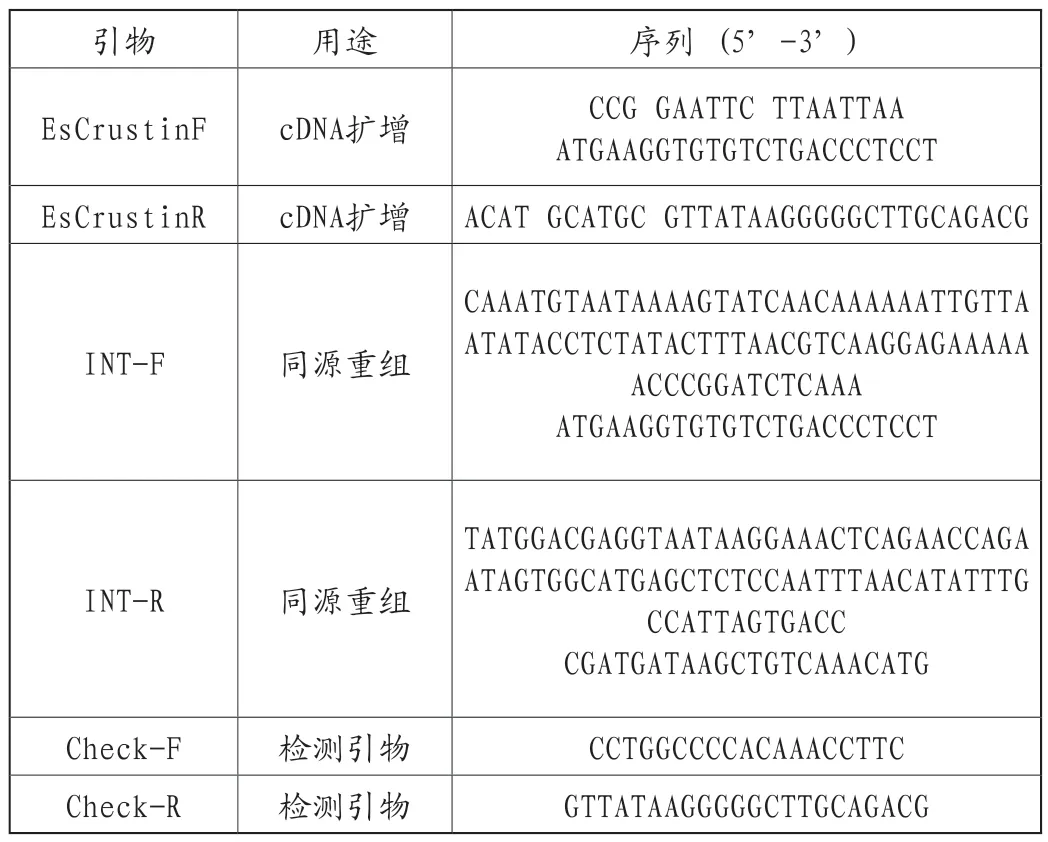
表1 實驗中用到的特異性引物
(4)重組蛋白EsCrustin的表達
將成功同源重組的菌株在D-半乳糖誘導培養基YPG(20g/L Peptone、20g/L D-半乳糖、10g/L酵母提取物;D-半乳糖為誘導劑)30℃條件下220rpm劇烈振蕩培養,當細胞培養物OD600達到1.0-1.5時,提取蛋白,用十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)和Western Blot分析檢測重組蛋白EsCrustin的表達情況。
(5)SDS-PAGE及Western Blot分析
使用標準10% SDS-PAGE分析重組EsCrustin的表達。通過考馬斯亮藍染色使蛋白質條帶可視化。通過SDS-PAGE分離的蛋白質在電泳轉移裝置(Trans-blot SD,Bio-Rad)中以25V電轉移到硝酸纖維素膜(Bio-Rad)上30min。然后將硝酸纖維膜用Tris緩沖鹽水(TBS:10mM Tris-HCl,150mM NaCl,pH7.5)在室溫下洗滌10min,并在室溫下在封閉緩沖液(TBS緩沖液中的3%BSA)中孵育2h。隨后將膜用含有0.05%(v/v)Tween 20(TBST)的TBS在室溫下洗滌10min,并與抗HA抗體(Abcam,英國)在室溫下孵育2h。用TBS洗滌3次后,加入與辣根過氧化物酶(Abcam,英國)偶聯的二抗。孵育2h后,洗膜3次,采用曝光顯影法檢測重組蛋白,通過與蛋白Maker比對,以確認重組表達的EsCrustin的分子量。
(6)抗菌活性測定
本實驗抗菌活性驗證所使用的菌株包括4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和三種革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)。對于抗菌活性,最低抑菌濃度(MIC)值是通過液體生長抑制試驗確定的[30]。本實驗中使用貧肉湯營養培養基(10g/L胰蛋白胨,5g/L NaCl,pH7.5)來進行細菌的標準培養,細菌在30℃劇烈搖動下培養24h,然后測定細菌懸浮液的OD600來檢測細菌生長濃度,統一選擇對數期細菌進行實驗,且將細菌濃度統一調整為OD600=0.001。將10μL的重組蛋白EsCrustin樣品(同時以釀酒酵母GAL1-ScRCH1空菌株作為陰性對照)在無菌96孔板中進行孵育,在該板中每個孔中均有100μL對數期細菌培養物(統一稀釋為OD600=0.001)。MIC值為觀察到細菌生長的重組蛋白EsCrustin最高濃度和導致100%抑制細菌生長(殺菌)最低濃度之間的范圍。
(7)細菌凝集實驗
重組蛋白EsCrustin對細菌識別和凝集作用通過細菌凝集實驗來進行測定[31]。本研究選取4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和3種革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)進行實驗。在貧肉湯培養基中將以上細菌進行培養且細菌濃度調整為1.0×107cells/mL,將10μL的重組蛋白EsCrustin(終濃度為20ug/μL)加入至90μL細菌懸浮液中,同時將不表達目的蛋白的釀酒酵母菌株GAL1-ScRCH1蛋白作為陰性對照。將細菌與重組蛋白混合物在30℃下孵育過夜,然后在光學顯微鏡下觀察細菌。
(8)瓊脂平板擴散法測定抑菌活性
將4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和三種革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)培養至對數期且濃度統一調整為1.0×107cells/mL來進行實驗。用玻璃珠將每種菌懸液100μL均勻涂布在LB平板中,然后將直徑為5mm的濾紙貼在平板上,在濾紙上滴入10μL重組EsCrustin蛋白。將平板在30℃培養過夜,觀察抑菌圈。同時,設定不表達目的蛋白的釀酒酵母菌株GAL1-ScRCH1為陰性對照。
(9)數據分析
所有實驗均進行3次生物學重復,采用SPSS 20.0軟件進行數據統計分析。使用one-way ANOVA分析的數據表示為平均值±SE,統計顯著性定義為P<0.05。
2.實驗結果
(1)EsCrustin cDNA的克隆和同源重組
圖1A為本實驗中釀酒酵母表達系統的構建策略。從中華絨鰲蟹血淋巴中提取總RNA,并使用甲殼肽蛋白的特異引物進行擴增。擴增出的目的cDNA開放閱讀框(ORF)為336bp(圖1B),共編碼112個氨基酸。在酶切和T4DNA連接酶后,將cDNA片段與載體pHAC181連接并轉化到感受態細胞Trans1-T1中。通過限制酶驗證陽性轉化子(圖1C)。同源引物INT-F和INT-R擴增的同源重組大片段為4705bp(圖1D),而檢測引物擴增的633bp則表明該轉化子為正確的同源重組(圖1E)。
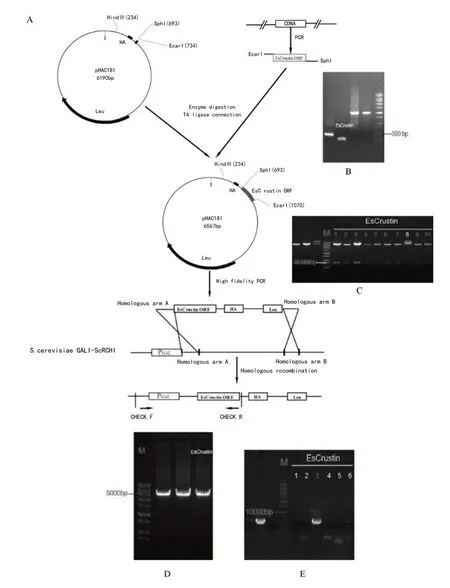
圖1 釀酒酵母菌株表達中華絨螯蟹Crustin的真核表達構建策略圖
圖1A為酵母真核表達系統的構建過程;圖1B表示中華絨鰲蟹Crusin的cDNA開放閱讀框(ORF)為336bp;圖1C表明通過酶切驗證陽性轉化子。圖1D表示重組質粒采用高保真PrimeSTARGXLDNA聚合酶通過同源重組引物擴增,其目的片段長度為4705bp,圖1E表示檢測引物用于驗證陽性同源重組轉化子,目的片段為633bp的為同源重組成功的轉化子,M:Marker。
(2)蛋白表達及Western Blot分析
中華絨鰲蟹甲殼肽EsCrustincDNA在酵母真核系統中進行表達。該表達載體在氨基末端具有3個HA標簽,因此估測重組EsCrustin的分子量約為20kDa。將重組質粒整合到釀酒酵母菌株GAL1-ScRCH1的GAL1啟動子下游,YPG(20g/L蛋白胨、20g/LD-半乳糖、10g/L酵母提取物)用作誘導培養基,通過D-半乳糖誘導重組EsCrustin的表達。通過10%SDS-PAGE電泳分析表明,含有重組蛋白的釀酒酵母菌株可表達大小約為20kDa的蛋白質,Western Blot分析表明,HA抗體與重組蛋白EsCrustin結合,且其分子量為20kDa,表明重組蛋白成功表達(圖2)。
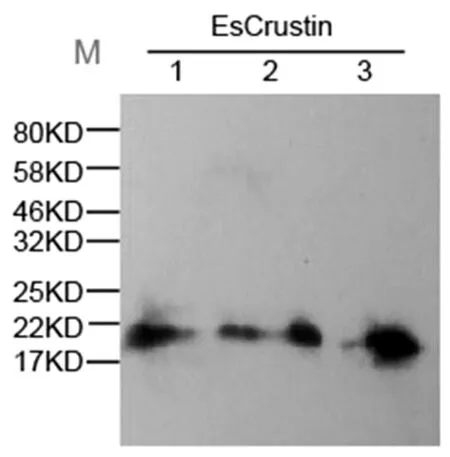
圖2 Western blot驗證重組蛋白EsCrustin的表達
用HA抗體進行Western blot驗證表明,重組蛋白EsCrustin分子量約為20kDa,泳道1-3代表3個不同的同源重組轉化子均表達了目的蛋白。M:蛋白Marker。
(3)重組蛋白EsCrustin的抗菌活性
為了測定EsCrustin的抗菌活性,我們檢測了最低抑菌濃度(MIC)和最低殺菌濃度(MBC),以評價抑菌和殺菌活性。重組蛋白EsCrustin對4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和3種革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)的生長有不同程度的抑制作用。MIC和MBC值分別在0.467-0.921μM和0.887-1.135μM的范圍之內(表2)。
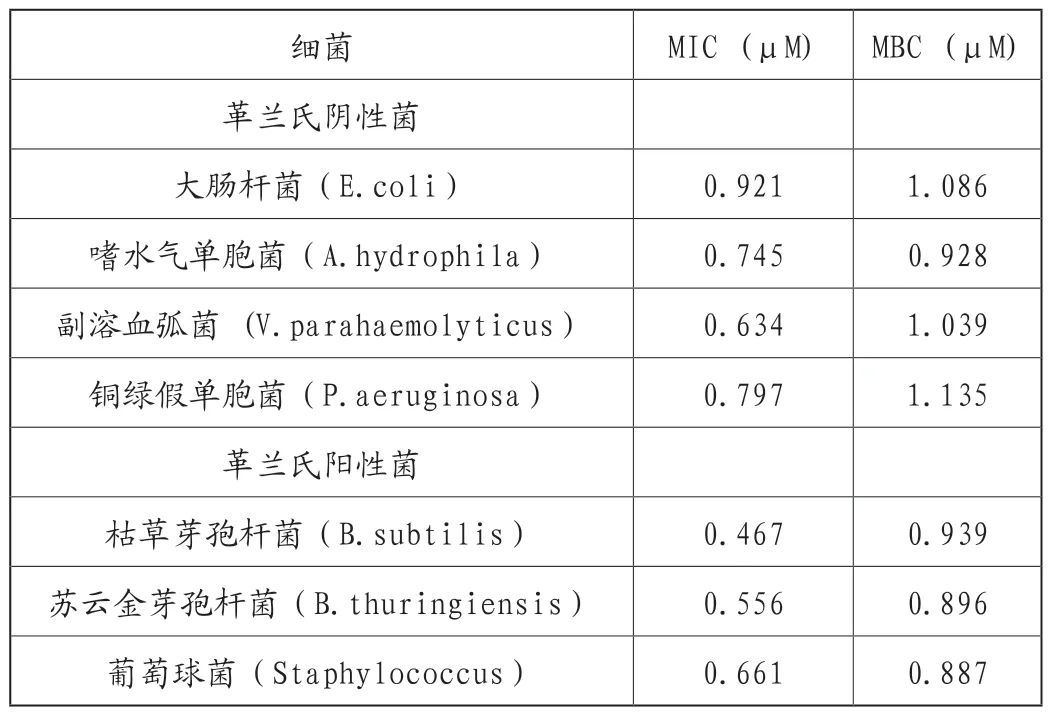
表2 重組蛋白的抗菌功能
(4)細菌凝集實驗
為驗證重組蛋白EsCrustin是否可以與微生物表面產生相互作用,我們用4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和三種革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)進行細菌凝集試驗。結果表明,除銅綠假單胞菌外,所有革蘭氏陰性菌株都能被EsCrustin凝集(圖3A)。此外,實驗中3種革蘭氏陽性細菌均可被重組蛋白凝集(圖3B)。以上結果表明,重組蛋白EsCrustin可識別部分革蘭氏陰性菌和革蘭氏陽性菌的表面分子。另一方面,兩株甲殼動物病原菌嗜水氣單胞菌(A.hydrophila)和副溶血弧菌(V.parahaemolyticus)發生凝集,表明重組蛋白EsCrustin可能為中華絨鰲蟹的一種重要的抗菌免疫蛋白。

圖3 細菌凝集實驗
圖3A顯示除銅綠假單胞菌外,其他3種革蘭氏陰性菌都被重組蛋白EsCrustin凝集,而圖3B中3種革蘭氏陽性菌與對照蛋白相比均出現凝集現象。Bar:5μm。
(5)瓊脂糖平板擴散法檢測重組蛋白抑菌活性
在涂布有嗜水氣單胞菌(A.hydrophila)的平板上,重組蛋白EsCrustin明顯抑制其生長,在平板上出現明顯的抑菌圈,且重組蛋白EsCrustin的抑菌圈明顯大于對照蛋白C。
本研究中采用瓊脂平板擴散法檢測重組蛋白EsCrustin對不同細菌的抑制能力,觀察抑菌圈的出現及其大小。采用了革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌和銅綠假單胞菌)和革蘭氏陽性菌(枯草芽孢桿菌、蘇云金芽孢桿菌和葡萄球菌)進行測定。將這7種細菌均勻涂布在LB平板上,同時在平板上貼有濾紙,其上滴有10μL重組EsCrustin蛋白,將平板在30℃培養過夜后,可以觀察到在嗜水氣單胞菌平板上濾紙周圍出現明顯的抑菌圈,且重組蛋白的抑菌圈明顯大于對照蛋白(對照蛋白為未表達目的蛋白的釀酒酵母菌株GAL1-ScRCH1)(圖4)。其他6種菌在平板上抑菌圈不明顯。
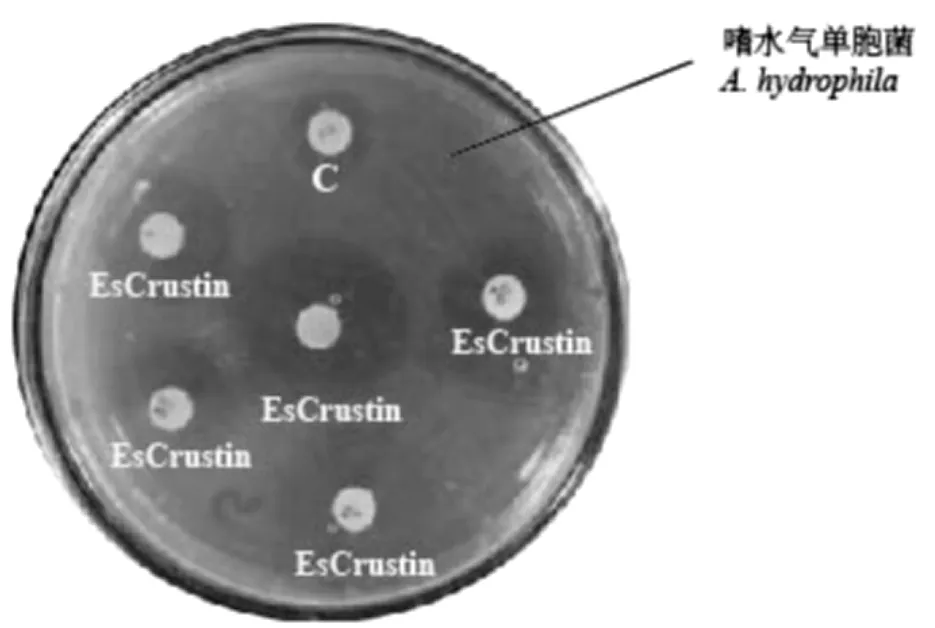
圖4 瓊脂平板擴散法檢測細菌抑菌圈
3.討論
Crustin作為一種甲殼動物抗菌肽,因其抗菌的完整性而被認為是一種重要的免疫基因,并且它被認為在甲殼類動物的非特異免疫中非常重要,具體表現為它存在于機體血淋巴顆粒細胞,在其對病原微生物的胞吐中發揮重要作用[32]。本研究采用釀酒酵母表達中華絨鰲蟹甲殼肽,我們將EsCrustincDNAORF(336bp)克隆到載體pHAC181中,然后利用同源重組技術將重組質粒整合到釀酒酵母菌株GAL1-ScRCH1中GAL1啟動子的下游,最后成功構建重組蛋白,通過在培養基中添加D-半乳糖使重組甲殼肽蛋白過表達,經過收集、裂解將總蛋白在10%SDS-PAGE上進行分析。WesternBlot表明重組蛋白EsCrustin的分子量約為20kDa(圖2)。
前期的研究表明,甲殼肽EsCrustin序列在N端包含一個19個氨基酸的信號肽,在C端包含一個WAP結構域[28],WAP結構域已被描述為具有多種功能,例如包括蛋白酶抑制作用[21]和抗菌活性[22-33]。多數報道中,甲殼肽對革蘭氏陽性菌有活性,例如從C.maenas純化的第一個甲殼肽,它對柑橘假單胞菌、科庫里假單胞菌、藤黃假單胞菌和草綠色細菌均表現了抗菌活性[12]。此外,也有研究表明,甲殼肽對革蘭氏陽性和陰性細菌均具有抗菌活性[14-18]。在我們的研究中,重組蛋白EsCrustin的抗菌活性在4種革蘭氏陰性菌(大腸桿菌、嗜水氣單胞菌、副溶血性弧菌、銅綠假單胞菌)和三種革蘭氏陽性菌(包括枯草芽孢桿菌、蘇云金芽孢桿菌、葡萄球菌)中進行。結果表明,重組蛋白EsCrustin對4種革蘭氏陰性菌和3種革蘭氏陽性菌的生長有不同程度的抑制作用,其中MIC和MBC值分別為0.467-0.921μM和0.887-1.135μM(表2)。本實驗結果與之前的報道相似,斑節對蝦的甲殼肽重組蛋白對革蘭氏陽性菌和陰性菌[17-18]均表現出明顯的抗菌活性。此外,高等動物中的幾種含有WAP結構域的蛋白質,例如SLPI(分泌性白細胞蛋白酶抑制劑)[34-35]、彈性蛋白[36-37]對革蘭氏陽性菌和革蘭氏陰性菌也都表現出抗菌活性。以上結果表明,不同的甲殼肽可能具有不同的生物學功能,它們在甲殼動物的免疫防御系統中對細菌的抗菌活性具有選擇性。
本研究用細菌凝集實驗來檢測重組蛋白EsCrustin是否與微生物表面相互作用,結果顯示重組蛋白EsCrustin可凝集除銅綠假單胞菌外的其他六種細菌。因此,重組表達的EsCrustin可有效地凝集某些入侵的細菌并抑制其進一步的感染到機體組織。重組蛋白EsCrustin可識別細菌細胞壁的脂多糖并與其底物結合,從而有效識別并凝集病原體。根據Christie的研究,蛋白質中WAP結構域的存在為甲殼肽蛋白分子提供了蛋白酶抑制活性和抗菌活性[38]。本文的細菌凝集實驗也表明EsCrustin是一種有效的抗菌肽,可抵抗部分革蘭氏陰性菌和革蘭氏陽性菌。此外,瓊脂平板擴散法也表明重組蛋白EsCrustin對嗜水氣單胞菌具有明顯的抑菌作用。因此,本研究結果表明EsCrustin是甲殼類動物中一種重要的先天免疫因子,它是可直接對細菌起到效應作用的抗菌蛋白。
綜上,本研究將中華絨鰲蟹甲殼肽EsCrustin在釀酒酵母真核系統中成功表達且預測其蛋白分子量約為20kDa。重組蛋白的抗菌活性表明,EsCrustin是甲殼類先天免疫系統中一種重要的免疫因子,而這種具有抗菌活性的甲殼肽可應用于水產健康養殖領域以控制細菌和病原體的侵染及促進水產養殖業生態、健康發展。

