含水量和劣變時間對高丹草種子活力及幼苗生長的影響
閆慧芳 ,孫娟 ,2*
(1. 青島農業大學草業學院,草地農牧業研究中心,山東青島266109;2. 東營青農大鹽堿地高效農業技術產業研究院,山東東營257300)
種子活力作為評價種子質量優劣的重要指標,通常在其生理成熟期達到最高峰[1]。貯藏過程中,種子劣變導致其活力水平不可逆下降,進而造成萌發滯緩,幼苗生長和植株發育受阻,給農業生產帶來嚴重經濟損失[2]。種子活力水平由自身遺傳特性及外部環境條件共同決定[3]。McDonald[4]提出,種子含水量(moisture content,MC)和環境溫度是影響貯藏過程種子活力保持的重要因素,較高溫度和相對濕度促進種子活力損失。楊晗等[5]研究貯藏溫度和含水量對扁穗冰草(Agropyron cristatum)種子質量的影響發現,含水量對種子造成的劣變作用遠大于溫度。Lehner 等[6]在小麥(Triticum aestivum)種子劣變生理研究中也報道,對種子內部氧化代謝等反應及種子壽命影響最關鍵的因子是含水量。貯藏的高含水量正常性種子(而非頑拗性種子),其呼吸和代謝活性迅速增加,儲藏物質加速消耗,進而導致種子發芽和活力潛力過早喪失[7]。長期貯藏禾谷類作物和牧草種子的安全含水量為6%~7%,臨 界 含 水 量 為 13%[8]。 燕 麥(Avena sativa)[9]、草 木 樨(Melilotus officinalis)[10]、老 芒 麥(Elymus sibiricus)[11]等多種植物中,均有關于含水量對種子活力影響的研究。
劣變(或貯藏)時間很大程度上也影響了種子壽命,是限制種子活力水平和發芽特性的重要因素[12]。陳泉竹等[9]在研究劣變時間對不同含水量燕麥種子活力影響中發現,45 ℃下隨劣變時間延長,10%和16%MC 種子發芽率、發芽勢和發芽指數均呈顯著下降趨勢。陳玲玲等[13]也報道,貯藏3 年的紫花苜蓿(Medicago sativa)種子活力下降,種用價值降低,不適宜在人工草地建植中使用。老芒麥種子隨老化時間或貯藏年限延長,其發芽率、發芽勢、發芽指數、活力指數也呈下降趨勢[14-15]。類似研究在狗尾草(Setaria viridis)[16]、羊草(Leymus chinensis)[17]等種子中均有報道。長時間劣變處理(或貯藏)會導致種子老化,抗氧化酶活性降低,細胞結構受損,進而造成種子活力下降。
高丹草(Sorghum bicolor×Sorghum sudanense)是由飼用高粱(S. bicolor)和蘇丹草(S. sudanense)雜交育成的一年生禾本科暖季型C4作物,具有非常明顯的雜種優勢,抗旱抗寒能力強、莖粗葉寬、產量高、營養價值高、適口性好等優良特性,可作為多種畜禽的優質飼草來源,在畜牧業和漁業生產發展中具有非常重要的作用[18-20]。此外,作為新型牧草品種,高丹草還具有一定生態保護價值,其耐貧瘠、耐鹽堿等優良抗性在減少水土流失和減輕水資源壓力方面發揮優勢,是環境修復和資源開發利用方面具有廣闊應用前景的生態修復植物[21-22]。隨著草地畜牧業快速發展及牧草種植企業化生產,作為禾本科一年生高大飼草,高丹草優質種子需求量激增,其研究、開發和利用也越來越受人們關注。目前,關于高丹草的研究主要集中在優良品種選育與創制[23-24]、栽培與管理[25-27]、營養價值與飼用價值開發利用[28-29]等方面。高丹草所具有的優良特性均為雜種一代優勢的表現,種子質量優劣直接關系到其有效建植與生產利用,并影響畜牧業健康發展。高丹草種子劣變及其對種子活力影響的研究較少,王媛媛等[30]在老化時間和溫度對高丹草種子發芽率影響的研究中報道,老化時間是促進種子老化的關鍵因素。然而,含水量對高丹草種子活力的影響尚不清楚。因此,本試驗采用控制劣變方法,研究不同含水量和劣變時間處理后高丹草種子活力及幼苗生長變化,比較不同含水量種子活力及抗劣變能力差異,以期為高丹草種質資源保存與利用、劣變生理與分子機制深入探索提供科學理論基礎。
1 材料與方法
1.1 試驗材料與處理
1.1.1 試驗材料 供試高丹草種子(品種“冀草2 號”)保存于青島農業大學草學實驗室,種子初始含水量為9.4%;外形呈扁圓形;千粒重11 g。發芽情況:正常種苗96%,不正常種苗2%,新鮮未發芽種子0,死種子2%。
1.1.2 種子含水量測定 試驗于2019 年10 月-2020 年1 月在青島農業大學草學實驗室進行。參照國際種子檢驗協會種子檢驗規程[31]進行種子含水量測定。選取均勻潔凈高丹草種子放入樣品鋁盒內,用電子天平(AR223CN,奧豪斯,美國)準確稱重約4.5 g(精確到0.001 g),設置2 次重復。預先將電熱恒溫鼓風干燥箱(DHG-9140A,上海一恒科學儀器有限公司,中國)設置為130 ℃,開啟樣品鋁盒蓋后放入干燥箱內烘2 h。到達規定時間后,蓋好樣品鋁盒蓋,放入干燥器內冷卻30 min 后再次稱重,并按照公式計算種子初始含水量(MC0)。
MC0=[(M2-M3)/(M2-M1)]×100%,M1為樣品鋁盒和蓋重量(g),M2為樣品鋁盒+蓋+樣品烘前重量(g),M3為樣品鋁盒+蓋+樣品烘后重量(g)。
1.1.3 種子含水量調整 采用飽和鹽溶液平衡靜態稱重法進行種子含水量調整。根據已測定的種子MC0和初始重量(initial weight,M0),按照以下公式計算種子所需調整含水量(MCr,10%、12%和16%)對應的種子重量(required weight,Mr)。將潔凈的高丹草種子放入盛有NaBr 飽和溶液(平衡相對濕度57%)的密閉容器內,25 ℃下平衡并持續稱量種子重量,待種子重量達到Mr時,立即將其裝入120 mm×170 mm 鋁箔袋內,并用多功能真空封裝機密封,每袋25 g。
Mr=[(100-MC0)/(100-MCr)]×M0,Mr為所需調整含水量(MCr)對應的種子重量(g);M0為種子初始含水量(MC0)對應的初始重量(g)。
1.1.4 控制劣變處理 將裝有調整好含水量(MCr,10%、12%和16%)高丹草種子的鋁箔袋,置于45 ℃電熱恒溫水箱(CU-600,上海一恒科學儀器有限公司,中國)內進行控制劣變處理,每隔4 d 取樣一次,即分別在劣變0(對照)、4、8、12、16、20、24 和 28 d 進行取樣。種子取出后保存于-20 ℃冰箱,以備種子發芽及幼苗生長試驗所用。
1.2 測定指標與方法
1.2.1 種子發芽試驗 參照國際種子檢驗協會種子檢驗規程[31],選取均勻飽滿、大小一致的高丹草種子50粒,將其擺入盛有10 mL 蒸餾水潤濕3 層濾紙的有蓋培養皿(110 mm×110 mm)中;將培養皿置于光照培養箱(GXZ-380A 型,寧波江南儀器廠,中國)內,在30 ℃光照8 h、20 ℃黑暗16 h 條件下進行發芽培養。每個處理設置4 次重復。以正常種苗作為發芽標準,每24 h 統計種子發芽情況,待第10 天發芽結束后,參照Abdul-Baki 等[32]的方法,計算種子發芽率(germination percentage,GP)、發芽指數(germination index,GI)和種子活力指數(vigor index,VI),以反映種子劣變后的活力水平變化。
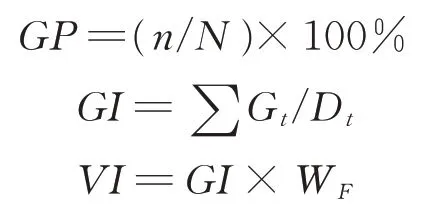
式中:n為前10 d 全部正常種苗數;N為供試種子總數;Gt為第t天內的發芽種子數;Dt為相應的發芽天數;WF為幼苗鮮重(g)。
1.2.2 幼苗生長狀況測定 按照1.2.1 中方法進行高丹草種子發芽試驗。待種子發芽第10 天結束后,用刻度尺測量全部正常種苗苗長(shoot length,SL)和根長(root length,RL),分別為從種胚到最長葉葉尖或最長根根尖的長度;用電子天平(AR223CN,奧豪斯,美國)稱量苗鮮重(shoot weight,SW)和根鮮重(root weight,RW)。參照 Abdul-Baki 等[32]的方法,計算幼苗活力指數(seedling vigor index,SVI),SVI=(ASL+ARL)×GP,ASL(average shoot length)為平均苗長(cm),ARL(average root length)為平均根長(cm)。
1.3 數據統計與分析
采用Excel 2010 和SPSS 17.0 軟件分析試驗數據顯著性,采用單因素方差分析(ANOVA)檢驗和Duncan 檢驗比較不同處理平均值(P<0.05),結果以平均值±標準誤表示。采用SigmaPlot 10.0 軟件作圖。
2 結果與分析
2.1 含水量和劣變時間對高丹草種子活力的影響
隨劣變時間延長,10%MC 高丹草種子GP 呈先升高后下降趨勢,并在劣變4 d 達最大值94%,且顯著(P<0.05)高于其他各劣變時間處理;12%MC 種子GP 在劣變過程中則呈不斷下降趨勢,并在劣變4、8、12 和 16 d 之間差異顯著(P<0.05);16%MC 種子 GP也呈不斷下降趨勢,且劣變0、4 和8 d 之間差異顯著(P<0.05)(圖 1A)。同時,10%MC 種子 GP 在劣變28 d 時仍為10%,而12%和16%MC 種子GP 分別在劣變16 和8 d 時降低為1%,可見,3 種含水量種子的抗劣變能力存在差異。此外,控制劣變4~12 d 時,不同含水量種子間GP 均差異顯著(P<0.05);其中,劣變8 d 時,各含水量種子GP 分別為83%、53%和1%,相比于對照(0 d),下降了2%、28%和88%;控制劣變16~28 d 時,10%MC 種子 GP 顯著(P<0.05)高于12%和16%MC 種子,而12%和16%MC 種子間差異不顯著(P>0.05)。
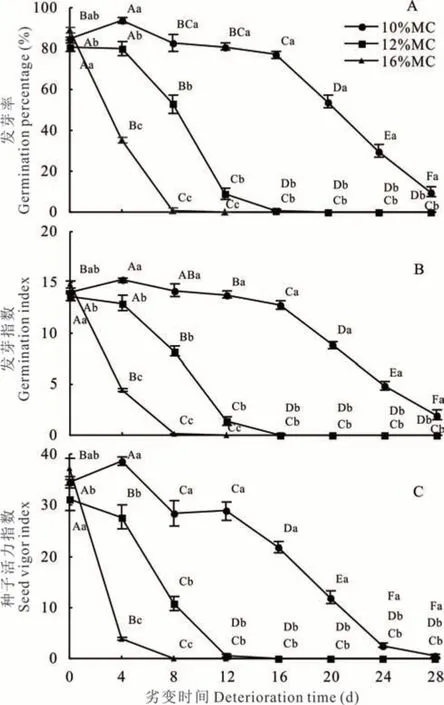
圖1 含水量和劣變時間對高丹草種子活力的影響Fig. 1 Effect of moisture content and deterioration time on seed vigor of S. bicolor×S. sudanense seeds
控制劣變過程中,10%MC 種子GI 呈先升高后下降趨勢,在劣變4 d 時達最大值,且顯著(P<0.05)高于對照和劣變 12~28 d;12%MC 種子 GI 隨劣變時間延長則呈不斷下降趨勢,且劣變 4、8、12 和 16 d 之間差異顯著(P<0.05);16%MC 種子 GI 也呈不斷下降趨勢,并在劣變 0、4 和 8 d 之間差異顯著(P<0.05)(圖1B)。控制劣變4、8 和12 d 時,不同含水量種子間GI均 差 異 顯 著(P<0.05);控 制 劣 變 16~28 d 時 ,10%MC 種 子 GI 顯著(P<0.05)高于 12% 和 16%MC,而 12% 和 16%MC 種 子 間 GI 差 異 不 顯 著(P≥0.05)。
隨劣變時間延長,10%MC 種子VI 呈先升高后下降趨勢,劣變4 d 時達最大值,且顯著(P<0.05)高于其他劣變時間處理;12%MC 種子VI 在劣變過程中則呈不斷下降趨勢,且劣變0、4、8 和12 d 處理間差異顯著(P<0.05);16%MC 種子 VI 也呈下降趨勢,并在劣變 0、4 和 8 d 處理間差異顯著(P<0.05)(圖 1C)。控制劣變 4 和 8 d時,不同含水量種子間 VI 均差異顯著(P<0.05);控制劣變 12~28 d 時,10%MC 種子 VI 顯著(P<0.05)高于12%和16%MC,而12%和16%MC 間差異不顯著(P≥0.05)。
2.2 含水量和劣變時間對高丹草幼苗生長特性的影響
10%MC 高丹草種子劣變 4~20 d 時,幼苗 SL 均與對照(0 d)差異不顯著(P≥0.05);劣變 24 和 28 d 后,幼苗SL 顯著(P<0.05)低于對照和劣變 4 d 時的 SL;與對照相比,幼苗 SW 在劣變4 d 時變化不顯著(P≥0.05),但隨劣變時間延長,幼苗SW 呈下降趨勢,且各劣變時間之間差異顯著(P<0.05)。然而,劣變時間對幼苗RL 影響不大,4~28 d 處理與對照間均差異不顯著(P≥0.05);而對幼苗 RW 影響較大,相比于對照,4~28 d 處理均顯著(P<0.05)降低幼苗RW,且各劣變時間處理間均差異顯著(P<0.05)。SVI在劣變4~12 d 時均與對照差異不顯著(P≥0.05),而劣變時間延長至16~28 d 時顯著(P<0.05)降低(表1)。
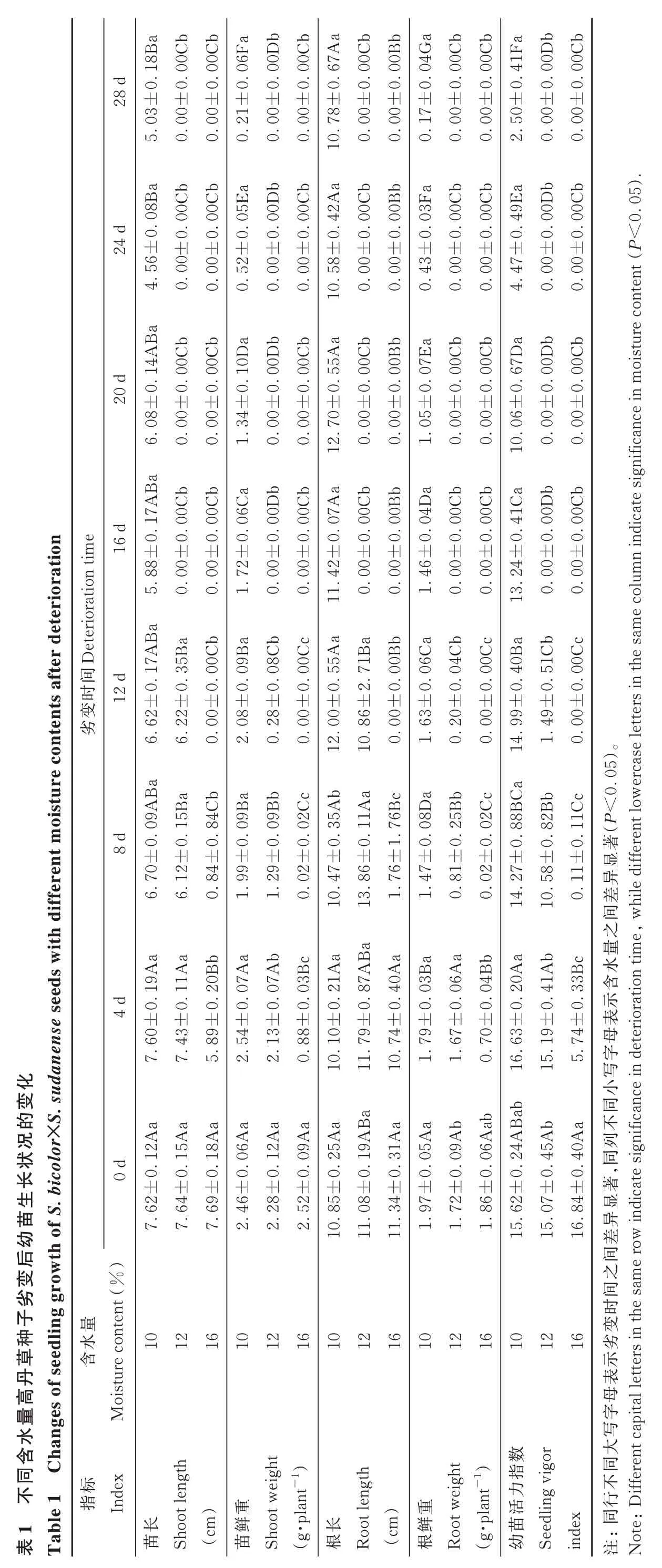
表Ta ab 8B 0C 0C ba 6F bb 0D 0C Aa bb 0C 0B 28 d .167±0.0.0.0.0.0 0..0.0 03±0±0±0±0±0 8±±0±0 5.00 0.00 0.21 0.00 0.00 0..700 0.00 0.ab ba 0C 8B bb Aa 0C bb 5E 0C 420C.0.0 10 0B.0 24 d±0.0.0 0D.0 0..0.0 5600±0±0 00±0±0±0 8±±0±0 4.0.0.52 0.00 0.00 0..500 0.00 0.4A 0C bb Ba 0C 0D ab 0D b Aa 0C bb 0C 0B.0.0.1.1 20 d .0±0.0 0.±0 55.0±0.0±0±0±0 080±±0 00±0 00 0.6.34 1.0.00 0.00 0..700 0.00 0.12 7A ab bb 10 0C Ba 0C 6C 0D b 0C Aa bb 0C 0B.0.1.0.0 16 d e .0±0±0 tion .0 0.±0.0±0.0 07±0±0 88 n tim ra 0072 00002±±0 00±0 0000 0.5.0.Deterioratio 1.0.0..4 eterio 110.0.B a 7A 5B fter d ab ab c 0C 9B 8C 0C Aa Ba 0B b.1 tents a 間.371.0.0.0 0.12 d±02.55±0±0±0.0.0變62±0±0 0±006±22±0 08280000劣6.6.0.2.時oisture con 0.0..0 12.8 100.ab Ba 9B 5B ab 9B c 2C Ab Aa 6B c 4C.0.8.011.1.0.035±0±0 8 d 0.±00.±0±0.7±0±1 709929 1202 846±7±ifferent m 0.6.6.1.1.0.76.8 1..4 1013 1A aa se seeds w 0B ba 7A ith d a bc 9A 7A 3B AB 9A Aa Aa 87.040.1.1.2 0.4 d±0.0 0.21±00..0±0±0 604389±0 en 54±0 0±139±884±7.5.2..1 2..7 0.7..7 an 11 1010變.sud 8A AB Aa aa aa 6A 2A的2A 9A aa Aa化a icolor×S 5A 25.1.0.1.119 0..0±0 0 d±00.±0 31±0.1±0長生.b 8±62狀46況28±0 52 0.4±69苗f S 5±7.7.64 7.2.2.2..8.0.3 11后wth o 1011變ro幼草丹f seedlin g g ten t(%)re con劣101216101216101216水種子含量es o istu高水ng Mo含ha t h量ab 4G 0C ba 0C 1F 0D bb 0C.0.0.0.4.0.0±0±0±0±0±0±0 5)17 0.00 0.00 0.50 2.00 0.00 0..ab ba bb 3F 0C 0C 9E 0D 0C .0.0.0.0.4.0.0<0±0±0±0±0±0±0 43 0.00 0.00 0.47 4.00 0.00 0.tent(P ab 7E b Da 0C bb 0C 0D 670C oisture con.0.0.0 0..0.0±0±0±0 6±±0±0 0500 1.0.00 0.00.000 0.0.nificance in m b Ca bb ab 4D 0C 0C 410D 0C icate sig.0.0.0 0..0.0±0±0±0 4±±0 46±0 n ind 00000000 1.0.0..2 130.0.e colum a 4C bc 0C Ba bc 1C 0C 40.0.0.0 0..5.0±0±0±0 9±63±0 20±0 0049 0.6C 00 1.0..9 141.0.(P<0 5)ercase letters in the sam a c 8D BC Bb bc顯ifferent low.0 5B 2C 881C 82.0.2.0 0.0..1著±0±0±0 7±8±±0 4781 1.0.0211 0..2 14.5 100.異間差wh ile d a aa 3B b Aa Ab 水6A 4B 2041之e,3B 含c量.0.0.0 0.0..3示ration tim表±0±0±0 3±9±±0 79677074 1.1.0..6 16.1 155.母eterio寫小同ab ab字5A AB Ab Aa 9A 不nificance in d 6A 24列4540.0.0.0 0.0.±00.,同±0 ab±0著2±7±4±977286顯dicate sig 1.1.1..6 15.0.8 15異in之間e row間 變劣差101216101216示。16表母字ital letters in the sam寫t 數eigh大or ble 1 C同ig指dex同gt eigh標不不ifferent cap In 力t w lant-1)指(cm)gth重長oo lant-1)t len重活ling v行1 oo苗Sh 鮮Sh(g·p 長根Ro (cm)鮮ot w根Ro時10 ot len苗同苗(g·p幼Seed in dex:te:D注No
12%MC 高丹草幼苗 SL 和 SW 均隨劣變時間延長而呈下降趨勢,盡管劣變4 d 時均與對照差異不顯著(P≥0.05),但劣變8~28 d 顯著(P<0.05)降低,且 SW 在劣變4、8、12 和 16 d 之間差異顯著(P<0.05)。幼苗RL 對劣變時間響應較晚,相比于對照 ,劣變 4~12 d 時均 無 顯著變化(P≥0.05);隨劣變時間延長,幼苗RW 呈下降趨勢,除在劣變4 d 時與對照差異不顯著(P≥0.05)外,劣變 8~28 d 時均顯著(P<0.05)降低,且在劣變 4、8 和 12 d 之間差異顯著(P<0.05)。SVI 在劣變 0~28 d 的變化情況與SW 一致(表1)。
隨劣變時間延長,16%MC 高丹草SL、SW、RL、RW 和 SVI 均呈下降趨勢(表 1)。除 RL 外,劣變 4 d 時 SL、SW、RW 和 SVI 均顯著(P<0.05)低于對照;劣變 8 d 則顯著(P<0.05)降低了SL、SW、RL、RW 和SVI,且與劣變4 d 之間差異顯著(P<0.05)。
控制劣變 4、8 和 12 d 時,10% 和 12%MC 高丹草 SL 差異不顯著(P≥0.05),但均顯著(P<0.05)高于16%MC;而不同含水量間的 SW 和 SVI 均差異顯著(P<0.05)。就RL 而言,各含水量種子在劣變4 d 時差異不顯著(P≥0.05),而在劣變8 d 時差異顯著(P<0.05);劣變 12 d 時,盡管 10% 和12%MC 間差異不顯著(P≥0.05),但均顯著(P<0.05)高于 16%MC。至于 RW,劣變 4 d 時 10% 和 12%MC 間差異不顯著(P≥0.05),但 均 顯 著(P<0.05)高 于16%MC;劣變 8 和 12 d 時,各含水量間差異 顯著(P<0.05)。此外,劣變 16~28 d 時,10%MC 幼苗 SL、SW、RL、RW 和 SVI 均顯著(P<0.05)高于 12% 和16%MC,但12%和16%MC 間差異不顯著(P≥0.05,表1)。
2.3 含水量和劣變時間對高丹草種子活力及幼苗生長的雙因素方差分析
雙因素方差分析表明(表2),種子含水量、劣變時間及兩者互作對種子GP、GI、VI 和幼苗SL、SW、RL、RW、SVI 均具有極顯著(P<0.01)影響,二者對高丹草種子劣變過程中活力水平及幼苗生長變化起關鍵作用。
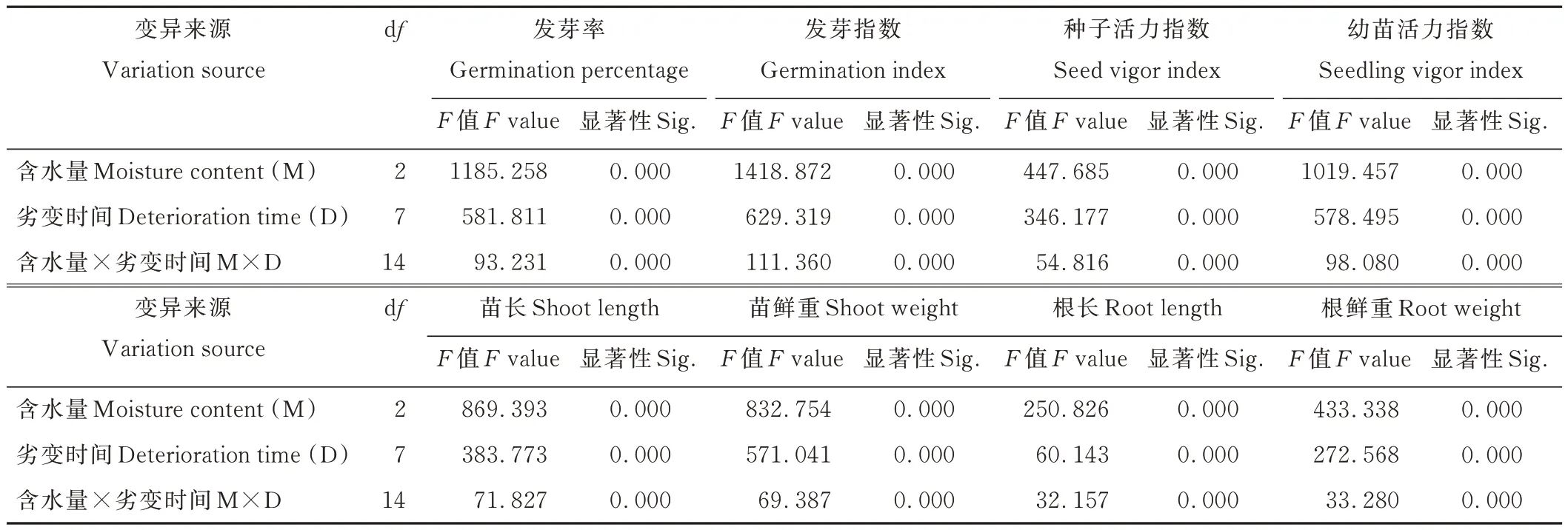
表2 含水量和劣變時間對高丹草種子活力及幼苗生長特性影響的雙因素方差分析Table 2 Two-way variance analysis of moisture content and deterioration time on seed vigor and seedling growth characteristics of S.bicolor×S.sudanense
3 討論
種子活力反映種子質量和綜合特性,決定了其在復雜田間環境下萌發、出苗及幼苗生長的能力[33]。種子壽命及抗劣變能力也是種子質量的重要指標,受遺傳、生理保護和貯藏條件影響[34]。通常種子活力越高,其萌發及幼苗生長潛在活性水平越高,種子抗劣變能力也越明顯[35]。有關種子劣變生理研究報道,種子活力變化與含水量密切相關,長期貯藏應保持在適宜范圍內[36-38],如水稻(Oryza sativa)種子含水量應在12%~14%以下[39]。本試驗中,不同含水量高丹草種子劣變后活力水平均呈整體下降趨勢,幼苗生長受到明顯抑制,但變化速率因含水量差異而不同。10%MC 種子GP、GI 和VI 均下降最慢,至劣變28 d 時仍分別保持有原水平的10.0%、14.1%和1.5%,而12%和16%MC 種子活力各項指標均下降較快,分別在劣變12 和8 d 時已幾乎降為0(圖1),表明高丹草種子含水量越高,其活力越容易喪失,抗劣變能力也越差。這與對水稻[40]、紫花苜蓿[41]和香椿(Toona sinensis)[42]種子的研究結果相一致,均表明含水量是影響種子活力水平的重要因素,且隨含水量升高,劣變后的種子活力下降速度加快。水分作為種子內細胞的重要組成成分,參與細胞生理代謝和種子正常生命活動。朱萍等[11]研究發現活性氧積累是引起4%~16%MC 老芒麥種子劣變和活力下降的原因,李吟平等[43]則發現15%高含水量造成黃精(Polygonatum sibiricum)種子膜系統破壞,也加快了劣變進程,進而導致種子活力下降。同時,由含水量引起的種子劣變也對高丹草幼苗生長產生了明顯抑制作用。短時間(4 d)劣變處理時,除幼苗RL 不受影響外,16%高含水量導致幼苗生長狀況(SL、SW、RW 和SVI)均顯著低于10%安全含水量劣變后的幼苗生長,且隨劣變時間延長,高含水量引起的種子劣變對后續幼苗生長造成的抑制作用越明顯(表2)。種子萌發和幼苗生長過程主要發生有機物轉化,適宜條件下種子貯藏物質被酶解為小分子化合物,而高含水量可能過度激活種子呼吸,消耗大量脂質、蛋白質等物質,無法滿足幼苗生長所需要能量,從而使幼苗生長受到抑制。本試驗表明,高丹草種子抗劣變能力與含水量密切相關,高含水量既加劇種子活力下降,又阻礙幼苗正常生長。
種子活力隨貯藏時間延長而逐漸下降,陳泉竹等[9]研究劣變時間對10%和16%MC 燕麥種子活力影響發現,45 ℃條件下,劣變時間延長導致兩種含水量種子發芽勢、發芽率和發芽指數均顯著下降。金小雯等[35]在研究貯藏1~8 年的燕麥種子活力變化中也報道,種子發芽率、發芽指數、活力指數、幼苗芽長和根長均隨貯藏年限增加而顯著下降,種子浸提液電導率明顯上升,膜透性增大。王媛媛等[30]認為,老化時間是促進高丹草種子老化的關鍵因素,其發芽率在老化60 h 后降幅最大。本試驗中,隨劣變時間延長,除10%MC 高丹草種子GP、GI 和VI 呈先升高后下降趨勢外,12%和 16%MC 種子活力指標(GP、GI 和 VI)及幼苗生長指標(SL、SW、RL、RW 和 SVI)均呈不斷下降趨勢,尤其16%MC 種子各項指標下降非常迅速(圖1 和表2),表明長時間的高含水量條件對種子安全貯藏危害很大。Xia 等[44]在研究劣變1~40 d 對不同含水量燕麥種子發芽及生理變化影響中發現,10%含水量種子胚中抗壞血酸過氧化物酶、脫氫抗壞血酸還原酶、單脫氫抗壞血酸還原酶、谷胱甘肽還原酶活性隨劣變時間延長先升高后降低,認為相對溫和的劣變階段有助于激活某些抗氧化酶的活性或合成。本試驗中,10%MC 高丹草種子短期劣變4 d 后,種子活力升高,或許是因為相對溫和的損傷或活性氧增加暫時激活了某些抗氧化酶活性,進而有效調節細胞內氧化狀態,而隨含水量升高和劣變時間延長,抗氧化酶保護和清除作用受限,細胞氧化還原失衡,物質轉化和能量代謝等紊亂,從而使種子活力降低。
高丹草種子活力及幼苗生長指標隨含水量增加與劣變時間延長均呈下降趨勢。在相同劣變條件處理下,與10%安全含水量相比,16%高含水量導致高丹草種子活力下降更迅速,幼苗生長所受抑制作用也更明顯;短時間(8 d)劣變就會使16%高含水量種子喪失活力,說明含水量是影響高丹草種子活力保持的關鍵因素。綜合比較,高丹草種子含水量越高,種子活力越容易喪失,抗劣變能力也越差。45 ℃條件下劣變8 d 處理可以較好地評價不同含水量種子的活力水平。
4 結論
控制劣變處理降低了高丹草種子的活力水平、抑制了幼苗生長,且這種影響與種子含水量、劣變時間及兩者互作有關。種子含水量越高,劣變時間越長,高丹草種子活力下降越快,幼苗生長所受抑制作用越明顯。另外,10%、12%和16%含水量高丹草種子抗劣變時間分別為28、16 和8 d,劣變8 d 能夠將各不同含水量種子區分開,可較好地評價不同含水量高丹草種子的活力水平。

