蟾毒靈抑制肝癌干細胞lncRNAs分子篩選研究
王海永,張晨月,李佳,部帥,李成,趙成龍
蟾毒靈抑制肝癌干細胞lncRNAs分子篩選研究
王海永1,張晨月2,李佳3,部帥4,李成1,趙成龍1
1.山東省腫瘤防治研究院,山東 濟南 250117;2.復旦大學附屬腫瘤醫院,上海 200032;3.鄭州大學附屬腫瘤醫院,河南 鄭州 450003;4.山東中醫藥大學第二附屬醫院,山東 濟南 250001
觀察蟾毒靈對肝癌干細胞的影響,并探討其相關機制。方法 利用無血清懸浮培養技術富集肝癌干細胞球,分子生物實驗檢測腫瘤干細胞標記物CD133、CD44和上皮特異性抗原(ESA)表達,測序技術篩選蟾毒靈干預肝癌干細胞后lncRNAs分子的差異表達。結果 通過無血清懸浮培養方法成功富集肝癌干細胞球,進一步發現蟾毒靈可抑制肝癌干細胞球的形成;蟾毒靈能顯著抑制肝癌干細胞標記物CD133、CD44和ESA表達;測序結果顯示,蟾毒靈可引起肝癌干細胞lncRNAs分子的差異表達。結論 蟾毒靈具有抑制肝癌干細胞的作用,其機制可能與調控lncRNAs分子有關。
蟾毒靈;肝癌干細胞;長鏈非編碼RNA
肝細胞癌(hepatocellular carcinoma,HCC)是全球惡性程度最高的腫瘤之一[1]。由于其癥狀不明顯且具有非特異性,大多數HCC患者就診時已處于晚期,因而失去最佳治療時機。迄今為止,HCC發生發展的機制仍未完全明確[2]。研究表明,肝癌干細胞在促進HCC發生發展中扮演重要角色,HCC的復發與肝癌干細胞的浸潤密切相關[3]。
腫瘤干細胞的調控過程十分復雜。研究表明,長鏈非編碼RNA(lncRNA)可通過多種機制調控不同種類腫瘤中的干細胞[4]。lncRNA是一組至少具有200個堿基但不具備翻譯蛋白質功能的轉錄本,可通過與miRNA、mRNA和蛋白質的相互作用調節基因表達[5]。lncRNA具有促進和抑制腫瘤發生發展的雙重作用。研究表明,降低lncRNA H19表達可逆轉CD133+腫瘤干細胞所致化療耐受性[6]。此外,lncRNA HOTTIP可通過調控Wnt/catenin通路影響胰腺癌干細胞的特性[7]。
蟾毒靈可在抑制肝癌血管生成、侵襲和轉移及誘導肝癌細胞凋亡等方面發揮作用[8-10],然而,其對肝癌干細胞的作用及其與lncRNAs的相關性鮮有報道。本研究觀察蟾毒靈對肝癌干細胞的影響,并篩選其可能調控的lncRNAs分子。
1 實驗材料
1.1 細胞和藥物
人肝癌細胞PLC/PRF/5,購自中國科學院上海細胞庫。蟾毒靈,德國Sigma Aldrich,貨號B0261。
1.2 主要試劑與儀器
CD133,德國Miltenyi公司,貨號170-070-702;CD44,德國Miltenyi公司,貨號170-078-029;上皮特異性抗原(ESA),德國Miltenyi,貨號130-110-998;4%多聚甲醛,上海碧云天生物技術有限公司,貨號P0099;0.1%結晶紫溶液,北京索萊寶,貨號G1064;TRIzol?試劑,美國Invitrogen公司,貨號10296010。FACSA流式細胞儀(美國BD公司),2100生物分析儀(美國Agilent公司),ND2000超微量分光光度計(美國Thermo Scientific公司),移液槍(美國Thermo公司),3-18KS高速低溫離心機(美國Sigma公司),CO2細胞培養箱(美國Thermo公司)。
2 實驗方法
2.1 肝癌干細胞球培養
采用無血清懸浮培養分離肝癌干細胞,并富集肝癌干細胞球。將生長良好的PLC/PRF/5細胞消化后離心,棄去含血清培養基,PBS清洗,用不含血清的腫瘤干細胞培養基重懸,細胞計數,取1×103個PLC/PRF/5細胞,加入超低吸附細胞培養皿中培養,觀察細胞成球狀態[11]。
2.2 肝癌干細胞鑒定
將1×103個PLC/PRF/5細胞和肝癌干細胞分別接種至6孔板,加入含10%胎牛血清的DMEM培養基培養,每3 d更換1次培養基,14 d后觀察2組細胞克隆形成情況。PBS清洗細胞,4%多聚甲醛固定,0.1%結晶紫溶液染色15 min,PBS清洗3次,晾干。由2位研究人員讀取克隆數目。
0.25%胰蛋白酶消化2組細胞,100 μL PBS重懸,加入CD133、CD44和ESA一抗(均為1∶100),4 ℃避光孵育15 min;PBS洗滌3次,加入二抗(1∶1 000)孵育15 min;PBS洗滌,流式細胞儀檢測腫瘤干細胞標記物CD133、CD44和ESA表達。
2.3 肝癌干細胞增殖能力檢測
將肝癌干細胞分為對照組和蟾毒靈組,分別加入正常培養基和含5 nmol/L蟾毒靈的正常培養基培養24 h,統計干細胞球數目。
2.4 腫瘤干細胞標記物檢測
將肝癌干細胞分為對照組、5 nmol/L蟾毒靈組和20 nmol/L蟾毒靈組,分別加入相應藥物培養,Western blot檢測CD133、CD44和ESA表達。
2.5 RNA提取和測序
將肝癌干細胞分為對照組、5 nmol/L蟾毒靈組和20 nmol/L蟾毒靈組,分別加入相應藥物培養,TRIzol試劑提取總RNA,加入DNaseⅠ去除基因組DNA;生物分析儀測定RNA質量,超微量分光光度計對RNA進行定量。用高質量RNA樣品(OD260/280=1.8~2.2,OD260/230≥2.0,RNA完整值≥6.5,28 S∶18 S≥1.0)構建測序文庫。實驗由上海凌恩生物科技有限公司協助完成。
2.6 差異通路GO富集分析
使用Goatools軟件(https://github.com/tanghaibao/ GOatools)對3組lncRNAs進行富集分析,采用Fisher精確檢驗。為控制計算的假陽性率,共使用4種多重檢驗方法(Bonferroni、Holm、Sidak和false discovery rate)對值進行校正,當≤0.05時,認為此GO功能存在顯著富集情況。
3 統計學方法
4 結果
4.1 肝癌干細胞富集和鑒定結果
本研究采用無血清懸浮培養成功培養出肝癌干細胞球,見圖1。克隆形成實驗顯示,肝癌干細胞克隆形成能力明顯增強(<0.05),見圖2。流式細胞儀檢測結果顯示,CD133、CD44和ESA在肝癌干細胞中的表達明顯高于PLC/PRF/5細胞,表達CD133、CD44和ESA的PLC/PRF/5細胞分別為2.0%、1.9%、1.1%,表達CD133、CD44和ESA的肝癌干細胞分別為18.4%、95.1%和57.7%,見圖3。
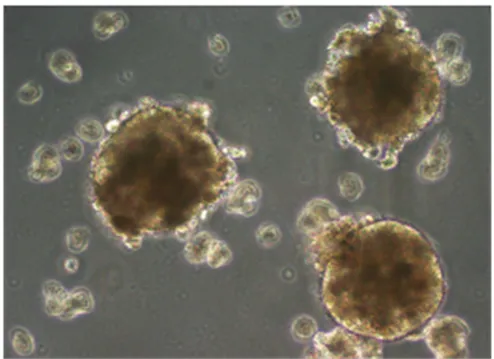
圖1 肝癌干細胞球形態(×200)

圖2 2組肝癌細胞克隆形成數目比較(±s,n=3)
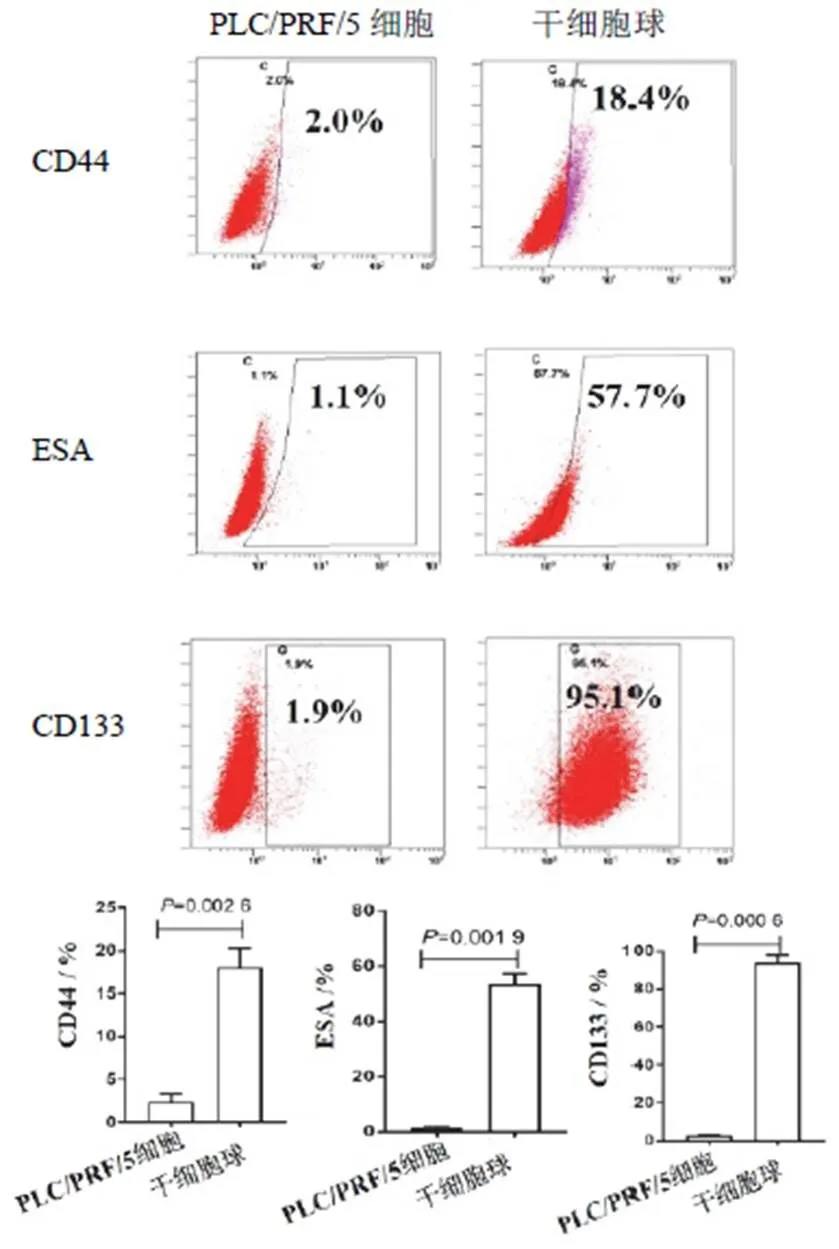
圖3 2組肝癌細胞CD44、ESA和CD133表達比較(±s,n=3)
4.2 蟾毒靈對肝癌干細胞增殖和相關標記物表達的影響
與對照組肝癌細胞比較,5 nmol/L蟾毒靈干預后,肝癌干細胞球數目明顯減少,見圖4。Western blot結果顯示,5、20 nmol/L蟾毒靈均可顯著抑制CD133、CD44和ESA表達,見圖5。
4.3 蟾毒靈對肝癌干細胞lncRNAs表達的影響
與對照組比較,5、20 nmol/L蟾毒靈組均能引起肝癌干細胞lncRNAs分子的差異表達。見圖6。
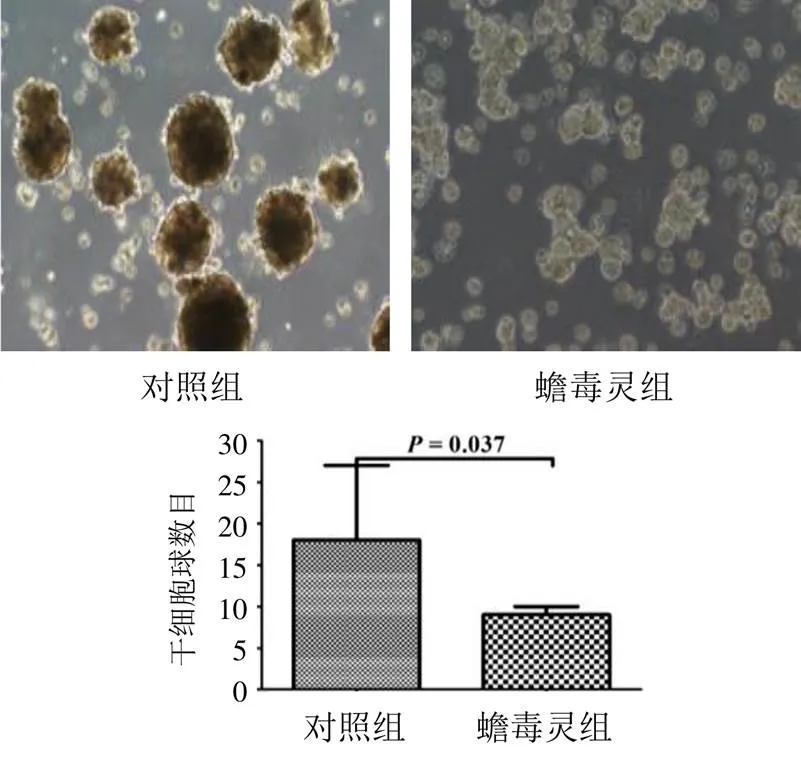
圖4 2組肝癌干細胞增殖能力比較(±s,n=3)
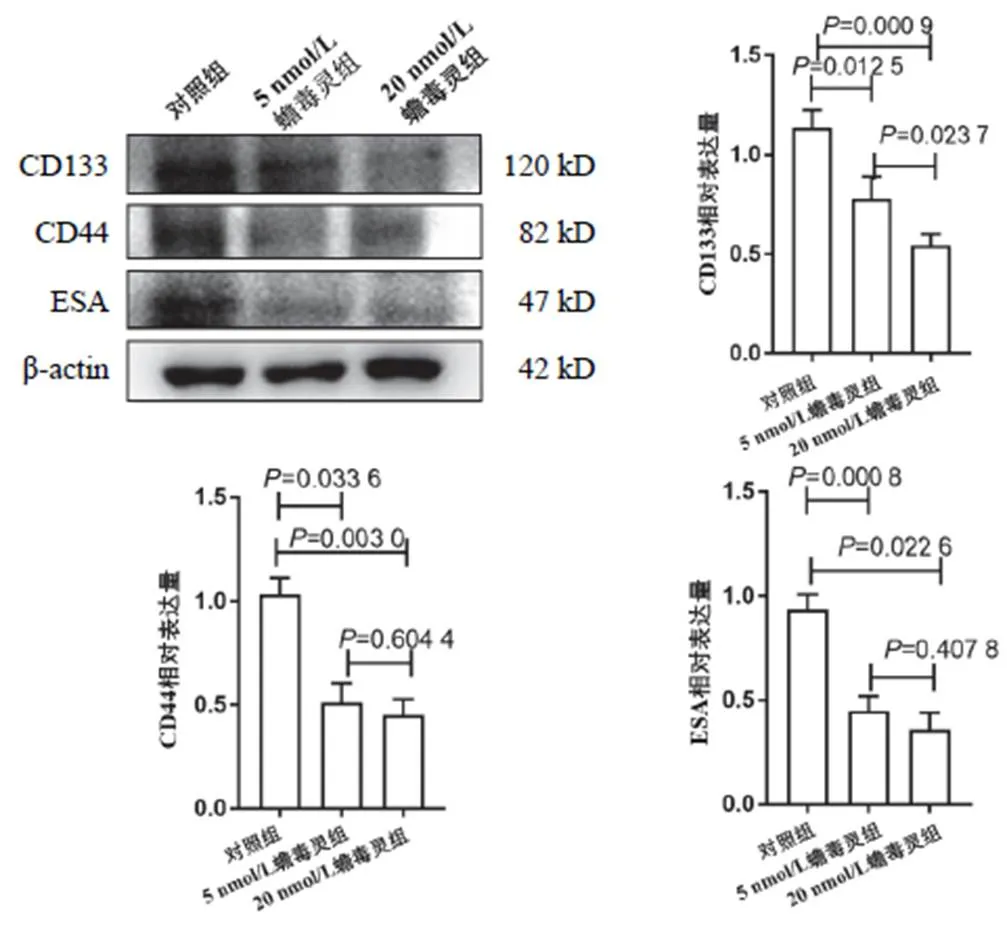
圖5 2組肝癌干細胞CD133、CD44和ESA表達比較(±s,n=3)
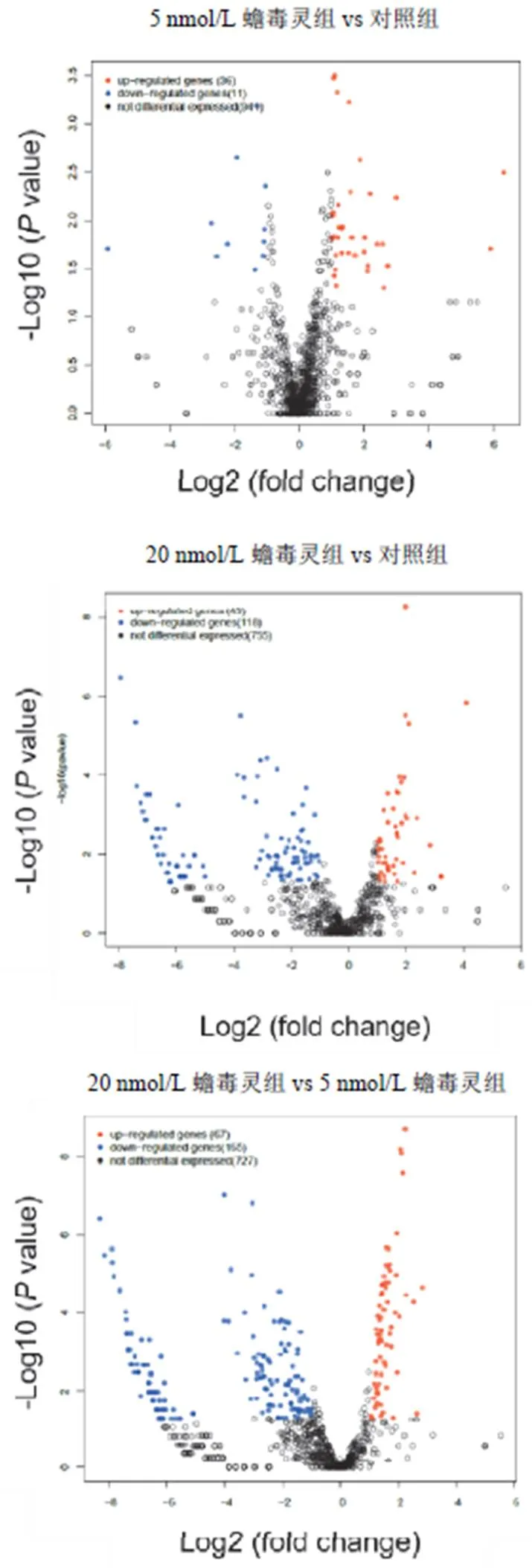
圖6 蟾毒靈對人肝癌干細胞相關lncRNAs分子的影響
5 討論
研究表明,lncRNA主要參與干細胞調節[12]。本研究通過體外實驗探討蟾毒靈對肝癌干細胞的作用,結果提示lncRNA與肝癌干細胞之間具有相關性。腫瘤干細胞僅占腫瘤細胞中一小部分,因具有自我更新、分化和轉移的能力而有別于其他腫瘤細胞[13]。腫瘤干細胞標記物CD44、CD24和ESA在胰腺癌中首次被發現[14]。此后,作為腫瘤干細胞標記物的CD133、CXCR4、CXCR1、ABCG2、ALDH1和Nestin等被逐步鑒定[15]。已有研究致力于探索腫瘤干細胞形成和調節的潛在機制。lncRNA參與了多個生物學過程,主要通過調控轉錄組水平發揮作用[16]。肝癌干細胞的表型和功能可由lncRNAs直接或間接調控。
關于lncRNAs在腫瘤干細胞中的作用和功能的研究還處于起步階段。已有研究表明,lncRNAs的異常表達可通過轉化為惡性表型而導致腫瘤進展[17]。目前,lncRNAs對腫瘤干細胞的作用主要集中在肺癌、前列腺癌、乳腺癌和膠質瘤上,具體機制包括組蛋白修飾、SOX2/KLF4途徑的調控、上皮-間質轉化的誘導及其與miRNA的相互作用[18-19]。此外,研究發現,lncRNAs可根據腫瘤類型通過不同方式調節腫瘤干細胞功能[20]。
綜上所述,本研究結果提示,蟾毒靈可能通過調節lncRNAs分子表達降低肝癌干細胞比例,發揮治療HCC的作用。對lncRNAs分子的深入研究可為治療HCC提供更多新的靶點。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[2] SIA D, VILLANUEVA A, FRIEDMAN S L, et al. Liver cancer cell of origin, molecular class, and effects on patient prognosis[J]. Gastroenterology,2017,152(4):745-761.
[3] GUO Z, LI LQ, JIANG J H, et al. Cancer stem cell markers correlate with early recurrence and survival in hepatocellular carcinoma[J]. World J Gastroenterol,2014,20(8):2098-2106.
[4] YAN H, BU P. Non-coding RNAs in cancer stem cells[J]. Cancer Lett,2018,421:121-126.
[5] MAO Y, LIU R, ZHOU H, et al. Transcriptome analysis of miRNA- lncRNA-mRNA interactions in the malignant transformation process of gastric cancer initiation[J]. Cancer Gene Ther,2017,24(6):267-275.
[6] DING K, LIAO Y, GONG D, et al. Effect of long non-coding RNA H19 on oxidative stress and chemotherapy resistance of CD133+cancer stem cells via the MAPK/ERK signaling pathway in hepatocellular carcinoma[J]. Biochem Biophys Res Commun,2018, 502(2):194-201.
[7] FU Z, CHEN C, ZHOU Q, et al. LncRNA HOTTIP modulates cancer stem cell properties in human pancreatic cancer by regulating HOXA9[J]. Cancer Lett,2017,410:68-81.
[8] WU S H, BAU D T, HSIAO Y T, et al. Bufalin induces apoptosis in vitro and has antitumor activity against human lung cancer xenografts in vivo[J]. Environ Toxicol,2017,32(4):1305-1317.
[9] WANG H, ZHANG C, XU L, et al. Bufalin suppresses hepatocellular carcinoma invasion and metastasis by targeting HIF-1α via the PI3K/AKT/mTOR pathway[J]. Oncotarget,2016,7(15):20193-20208.
[10] WANG H, ZHANG C, CHI H, et al. Synergistic anti-hepatoma effect of bufalin combined with sorafenib via mediating the tumor vascular microenvironment by targeting mTOR/VEGF signaling[J]. Int J Oncol,2018,52(6):2051-2060.
[11] WANG H Y, NING Z, LI Y, et al. Bufalin suppresses cancer stem-like cells in gemcitabine-resistant pancreatic cancer cells via Hedgehog signaling[J]. Mol Med Rep,2016,14(3):1907-1914.
[12] WONG C M, TSANG F H, NG I O. Non-coding RNAs in hepatocellular carcinoma:molecular functions and pathological implications[J]. Nat Rev Gastroenterol Hepatol,2018,15(3):137-151.
[13] MEDEMA J P. Cancer stem cells:the challenges ahead[J]. Nat Cell Biol,2013,15(4):338-344.
[14] LI C, HEIDT D G, DALERBA P, et al. Identification of pancreatic cancer stem cells[J]. Cancer Res,2007,67(3):1030-1037.
[15] ABBASZADEGAN M R, BAGHERI V, RAZAVI M S, et al. Isolation, identification, and characterization of cancer stem cells:a review[J]. J Cell Physiol,2017,232(8):2008-2018.
[16] TAKAKURA N. Formation and regulation of the cancer stem cell niche[J]. Cancer Sci,2012,103(7):1177-1181.
[17] GRELET S, LINK L A, HOWLEY B, et al. A regulated PNUTS mRNA to lncRNA splice switch mediates EMT and tumour progression[J]. Nat Cell Biol,2017,19(9):1105-1115.
[18] GHUWALEWALA S, GHATAK D, DAS P, et al. CD44(high) CD24(low) molecular signature determines the cancer stem cell and EMT phenotype in oral squamous cell carcinoma[J]. Stem Cell Res,2016, 16(2):405-417.
[19] BOUMAHDI S, DRIESSENS, LAPOUGE G, et al. SOX2 controls tumour initiation and cancer stem-cell functions in squamous-cell carcinoma[J]. Nature,2014,511(7508):246-250.
[20] ZHOU W, YE X L, XU J, et al. The lncRNA H19 mediates breast cancer cell plasticity during EMT and MET plasticity by differentially sponging miR-200b/c and let-7b[J]. Sci Signal, 2017,10(483):eaak9557.
Study on Screening of lncRNAs Involved in the Inhibitory Effect of Bufalin on Hepatocellular Carcinoma Stem Cells
WANG Haiyong1, ZHANG Chenyue2, LI Jia3, BU Shuai4, LI Cheng1, ZHAO Chenglong1
To investigate the effects of bufalin on hepatocellular carcinoma stem cells; To discuss the possible mechanism.Hepatocellular carcinoma stem cells spheres were enriched by serum-free suspension culture. Molecular biological experiments were used to detect the expressions of tumor stem cell markers CD133, CD44 and ESA in vitro, and sequencing technique was used to screen the differential expression of lncRNAs in hepatocellular carcinoma cells treated with bufalin.Hepatocellular carcinoma stem cells spheres were successfully enriched by serum-free suspension culture. Bufalin inhibited the formation of hepatocellular carcinoma cells spheres, and the expression of hepatocellular carcinoma stem cells markers CD133, CD44 and ESA were inhibited by bufalin in vitro. Sequencing result showed that bufalin induced the differential expression of lncRNAs.Bufalin can inhibit hepatocellular carcinoma stem cells, and the mechanism may be related to the regulation of lncRNAs.
bufalin; hepatocellular carcinoma stem cells; lncRNAs
R285.5
A
1005-5304(2021)12-0041-04
10.19879/j.cnki.1005-5304.202104541

山東省重點研發計劃(2018GSF119014);山東省泰山學者基金(tsqn201812149);山東第一醫科大學學術提升計劃(2019RC004)
(2021-04-27)
(修回日期:2021-06-01;編輯:華強)

