NaCl共熔作用提高鈣基脫硫劑利用率研究
張 旺,王 賀,韓 瑞,邢 爽,龐彩虹,鄔學倩
(1.天津泰達股份有限公司, 天津 300457;2.天津大學環境科學與工程學院,天津 300350)
0 引言
在燃燒過程中直接實現源排放控制是煙氣污染控制技術的重要發展趨勢。循環流化床鍋爐由于燃燒溫度較低,鈣基吸收劑適宜與SO2發生硫酸化反應,因此可以實現源排放控制。在高溫固硫過程中,吸收劑表面會形成連續產物層。由于產物摩爾體積大于反應物摩爾體積,產物層會堵塞孔隙(特別是小孔)入口,造成有效反應接觸表面積減小和擴散阻力增大,表面反應由化學反應控制逐漸進入到產物層擴散控制階段,反應速率急劇下降[1-3],吸收劑的實際利用率往往只能達到30%~40%[1]。
由于較低的利用率,大量吸收劑未參與脫硫反應,造成廢物處理成本增加,自然資源過量消耗,以及溫室氣體CO2的排放加劇。對此,國內研究者提出了一些方法來發掘乏吸收劑的潛力和提高吸收劑的利用率,如機械破碎活化[4],水/蒸汽活化[5-7]和添加劑調制等[8-11]。添加劑調制由于能實現固硫過程中吸收劑直接利用率的提高而引起了重視。
在各種調制方法中,用NaCl調質吸收劑得到了廣泛的研究,但其作用效果和作用機理仍是爭論的焦點。Davini[12]用NaCl溶液處理石灰石,發現含2wt% NaCl石灰石的鈣轉化率比處理前提高了近6%。而Laursen[13]在石灰石上負載3wt% NaCl后發現,鈣轉化率下降了近14%。對于NaCl的作用機理,Davini[12]發現調質石灰石鍛燒所得CaO的大孔徑分布趨勢增強,比表面積減小。因而用孔徑分布和比表面積對吸收劑脫硫性能的綜合影響來解釋NaCl的作用機理。Shearer[14]的研究取得了相似的結論。Fuertes[15]和Adanez[16]則認為,NaCl的作用機理在于高溫下Na+替代了脫硫產物晶格中的Ca2+,從而增加了晶格中的點缺陷,提高了產物層的離子擴散速率。由此可見,盡管針對NaCl調制石灰石已經有了眾多的研究,但就其作用效果及作用機制仍有很多不確定和有爭議的地方,這嚴重限制了NaCl作為脫硫促進劑的應用。本文結合SEM、TG-DSC、N2吸附等手段在固定床反應器中分別研究了吸收劑和硫酸化產物層的NaCl共熔作用,初步獲得了NaCl調質對吸收劑脫硫活性的影響規律。
1 實驗材料和方法
1.1 實驗材料及改性吸收劑制備
實驗過程中使用的原料主要為NaCl和石灰石。NaCl原料分兩種,一種是分析純NaCl(250~500μm),一種是亞微米級NaCl(<5μm),亞微米級NaCl采用反溶劑法制備[17],制備方法如下:室溫下,將NaCl溶于水制得50mL的飽和NaCl溶液,然后加入200mL無水乙醇作為反溶劑,攪拌0.5h后快速過濾收集結晶,將過濾物放入真空干燥箱中80℃下干燥12h,即可制得亞微米級NaCl粉體。石灰石來自浙江長興,經研磨后篩選出粒徑為150~180μm的顆粒,采用X射線熒光光譜分析測得其成分含量如表1所示。

表1 石灰石化學成分組成 %
NaCl調質石灰石通過濕混合法獲得:稱取10g石灰石,將其浸泡于10mL按預定NaCl/石灰石摩爾比配制的NaCl溶液中,將懸濁液置于磁力攪拌器上,在80℃下邊攪拌邊蒸發出大部分液體,以確保NaCl均勻附著在石灰石表面,最后將漿液置于110℃的干燥箱中干燥12h,即可得到NaCl調質石灰石。
NaCl調質乏吸收劑通過干混合法獲得:稱取10g乏吸收劑,將其與按預定摩爾比稱取的亞微米級NaCl(<5μm)進行均勻混合,即可得到NaCl調質乏吸收劑。
1.2 儀器及方法
石灰石煅燒在臥式一維管式爐中進行,煅燒溫度維持在850℃,煅燒過程中持續通入200mL/min的N2和50mL/min的O2。石灰石煅燒完畢后將樣品取出,得到的CaO用于脫硫實驗及孔隙結構分析。脫硫實驗在長0.5m,直徑為10mm的常壓固定床反應器中進行,反應溫度維持在850℃,實驗系統如圖1所示。
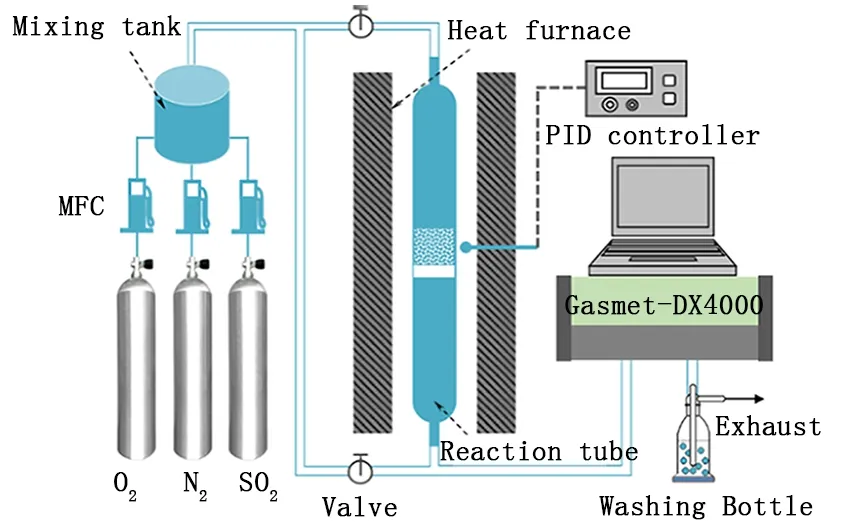
圖1 實驗系統
在實驗過程中(見圖1),將吸收劑顆粒放入反應器內的砂芯上。由一定濃度(體積分數)的SO2(0.2%)、O2(6%)與高純N2混合制成的模擬煙氣以1.5L/min的流量進入反應器與吸收劑發生反應。反應器進出口SO2的濃度由便攜式FTIR (GASMET-DX4000,芬蘭)連續監測。吸收劑的鈣轉化率通過積分脫硫曲線獲得,計算公式如下:
式中:L為氣體總流量(L/min);MCaCO3、MNaCl和MCaO分別為CaCO3、NaCl和CaO的摩爾質量(g/mol);k為樣品中Na/Ca摩爾比(%);n為石灰石中CaCO3的質量分數(%);SO2in、SO2out對應進氣和出氣中的SO2濃度(mg/m3),m為樣品質量(g)。
脫硫乏吸收劑由固定床實驗系統制得,乏吸收劑的脫硫實驗過程與吸收劑相同。樣品的表面形貌采用冷場發射掃描電子顯微鏡(S-4700,日本日立)觀測。吸收劑的孔隙結構參數采用N2吸附儀(ASAP2020,美國麥克)測定。調質吸收劑在高溫下的失重及熔融特性由同步熱分析儀(SDTA851e,瑞士)測定。
2 實驗結果與討論
2.1 NaCl調質對吸收劑孔隙結構的影響
吸收劑的孔隙結構對其脫硫活性影響較大,為探究NaCl調質對吸收劑孔隙結構的影響,本文通過氮氣吸附/脫附實驗對NaCl調制吸收劑的孔隙結構進行了測量,實驗結果如表2所示。從表2可知,吸收劑的比表面積和比孔容隨NaCl添加量的增加而迅速下降,比表面積從4.35m2/g降至0.75m2/g,比孔容從0.044cm3/g降至0.002cm3/g。
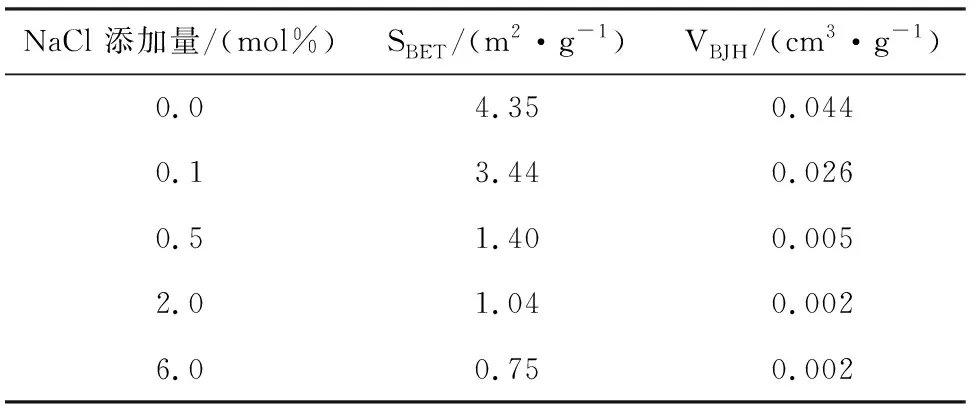
表2 不同NaCl添加量下吸收劑的比表面積(BET)和比孔容(BJH)
為了更直觀地觀察吸收劑表面形貌的變化,采用SEM對原始石灰石和NaCl調制石灰石煅燒后的表面形貌進行了觀測,如圖2所示。對比調質和未調質吸收劑的SEM圖像,可以看出未調質吸收劑表面棱角分明并存在較多細小孔隙,而NaCl調質吸收劑的表面非常光滑,細小孔隙消失,大孔數量顯著增加。孔徑適當增加會使SO2/O2更適宜于向吸收劑內部擴散[18],但如果吸收劑孔隙過大,則會使吸收劑表面積顯著降低,不利于脫硫反應的進行[19]。

圖2 石灰石顆粒煅燒后的表面形態SEM圖;(a,b)未調質石灰石;(c,d)2.0mol%NaCl調質石灰石
NaCl調質吸收劑的物理結構與高溫燒結(1200℃)后的吸收劑非常相似。這表明NaCl的加入顯著促進了燒結,有研究者認為NaCl對燒結的促進作用在于Na+取代吸收劑晶格中的Ca2+,提高了晶格中點缺陷的數量,加速了表面離子的擴散速率,從而產生同高溫燒結相似的效果[10]。圖3為相同Na+物質的量的NaCl和Na2CO3對吸收劑脫硫的影響,從圖中可以看出,相同Na+物質的量的NaCl和Na2CO3對吸收劑脫硫具有完全相反的作用。由此可見,離子取代機制很難用來描述NaCl對吸收劑孔隙結構的調節作用。
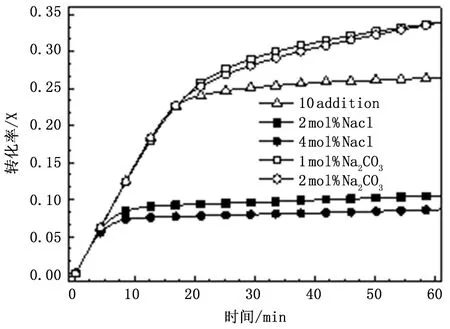
圖3 NaCl和Na2CO3調質時吸收劑的硫酸化特性曲線
在BeO-CaO體系的一些研究中,研究人員發現,只需加入微量的液相添加劑即可顯著促進燒結,這是因為表面粒子在液相中的擴散要比固相中的快得多。鑒于以上分析,我們利用熱分析儀對NaCl調質吸收劑的高溫熔融特性進行了分析。從圖4中的TG曲線可以看出,在388℃左右改性吸收劑發生了1.2%的失重,分析原因認為,氧化鈣具有強吸水性,在轉移、儲存、分析測試等過程中不可避免的會吸收空氣中的水分形成Ca(OH)2,因此該處失重可能為Ca(OH)2分解所致,由于Ca(OH)2分解是吸熱反應,因此在DSC曲線上對應著一個吸熱峰。在733℃左右,DSC曲線上又出現了一個吸熱峰,而吸收劑并未對應失重現象,表明在該溫度下,吸收劑表面發生了熔融,由于該溫度低于NaCl的熔點(801℃),因此NaCl很可能與CaO發生了低溫共融,在吸收劑表面形成了一層由NaCl和CaO混合物組成的液膜。表面液膜的出現極大地加速了吸收劑的燒結,導致了圖2(c)(d)所示的表面形貌。此外,很多研究者認為NaCl的加入可能會增加過熱器結渣和腐蝕的風險[13],但根據TG曲線可知,在循環流化床的燃燒溫度區間內(800~900℃),吸收劑表面的NaCl并未蒸發。高繼錄等[20]研究了準東煤燃燒過程中堿金屬遷移規律,結果表明煤樣中Na的揮發主要與溫度有關,與燃燒氣氛中的O2含量無顯著關系。由此可知,在循環流化床燃燒條件下,NaCl添加所引發的結渣和腐蝕風險可能非常微小。
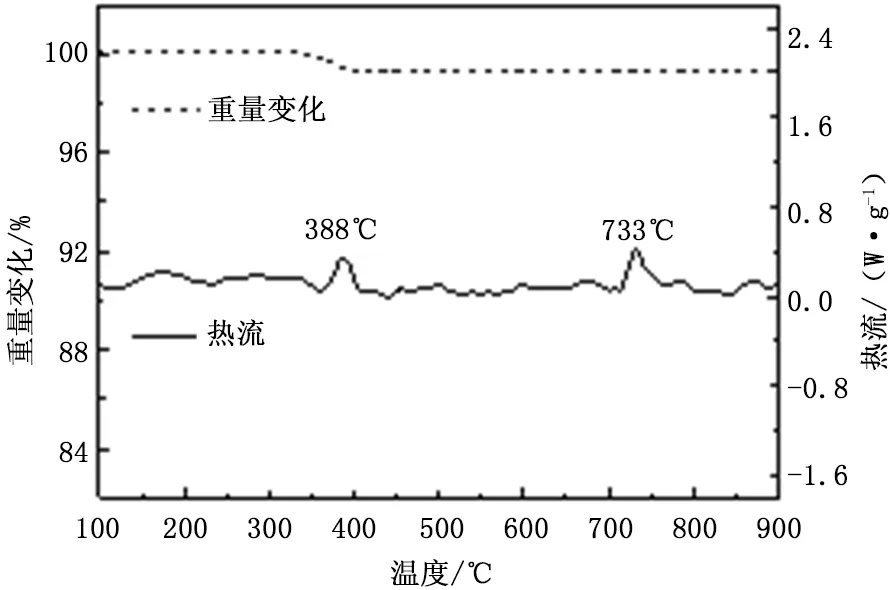
圖4 4mol%NaCl調質吸收劑的TG/DSC曲線
2.2 NaCl調質對乏吸收劑脫硫性能的影響
在脫硫反應過程中,產物層的出現會堵塞孔隙入口,造成了有效反應接觸表面積減小和擴散阻力增大,使反應進入擴散控制階段,在擴散控制階段中Ca2+以固態離子擴散的方式通過CaSO4產物層與SO2和 O2反應生成CaSO4[21],由于固態離子擴散速率極低,因此一旦產物層形成,反應速率及鈣利用率均會急劇下降[22-23]。本研究將NaCl添加到乏吸收劑中,以探究NaCl調質對硫酸化產物層的影響。若采用濕混合法添加NaCl,很難避免水合作用對實驗結果的干擾,因此在實驗中直接將一定量的亞微米級NaCl與乏吸收劑進行均勻混合。圖5展示了不同NaCl添加量下,乏吸收劑的鈣轉化率隨時間的變化曲線。可以看出,添加NaCl后,脫硫反應的化學反應控制階段顯著延長,且乏吸收劑的鈣轉化率有了較大提升。隨著NaCl添加量的增加,提升的效果越來越顯著,當NaCl的添加量分別為4mol%、8mol%時,脫硫吸收劑的鈣轉化率比未添加時分別增加了13.1%、20.7%。
圖6為有無NaCl調質時乏吸收劑再次脫硫1h后的表面形貌,由圖可以看出無NaCl調質時,乏吸收劑脫硫后表面變得致密光滑,吸收劑表面由微粒堆積而形成的大孔基本消失。而有NaCl調質時,乏吸收劑再次脫硫后表面出現了明顯的溶解、刻蝕現象,表面致密的產物層被破壞。
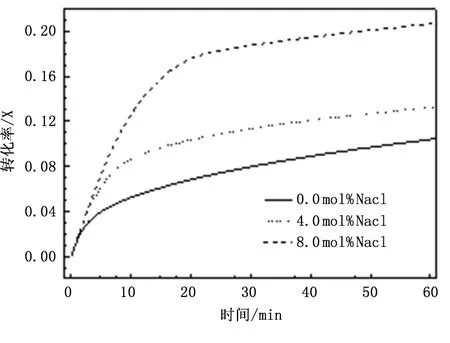
圖5 不同NaCl添加量下乏吸收劑的硫酸化特性曲線

圖6 乏吸收劑再次脫硫1h后的表面SEM圖
圖7為NaCl與CaSO4混合物的相圖,從圖中可以看出,當溫度高于725℃時,NaCl-CaSO4體系即可發生低溫共熔。因此在脫硫實驗的溫度下(850℃),NaCl可與產物層(CaSO4)發生低溫共熔,表面液膜的存在改變了反應物離子的擴散方式,由產物層中的固態離子擴散,轉變為了液相擴散,使擴散速率大大增加,乏吸收劑的鈣轉化率得到了顯著提高。
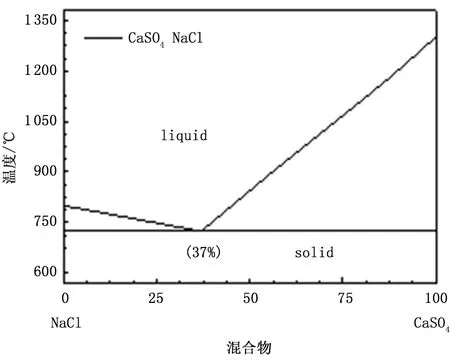
圖7 NaCl與CaSO4混合物的相圖
2.3 NaCl調質對吸收劑脫硫性能的影響機理
為了考察NaCl添加劑對吸收劑鈣利用率的影響規律,利用7種不同配比的調質液調質石灰石,調制石灰石在一維管式爐中煅燒成CaO后放入固定床實驗裝置中進行脫硫實驗。脫硫1h后,不同NaCl添加量下吸收劑的鈣轉化率如圖8所示。
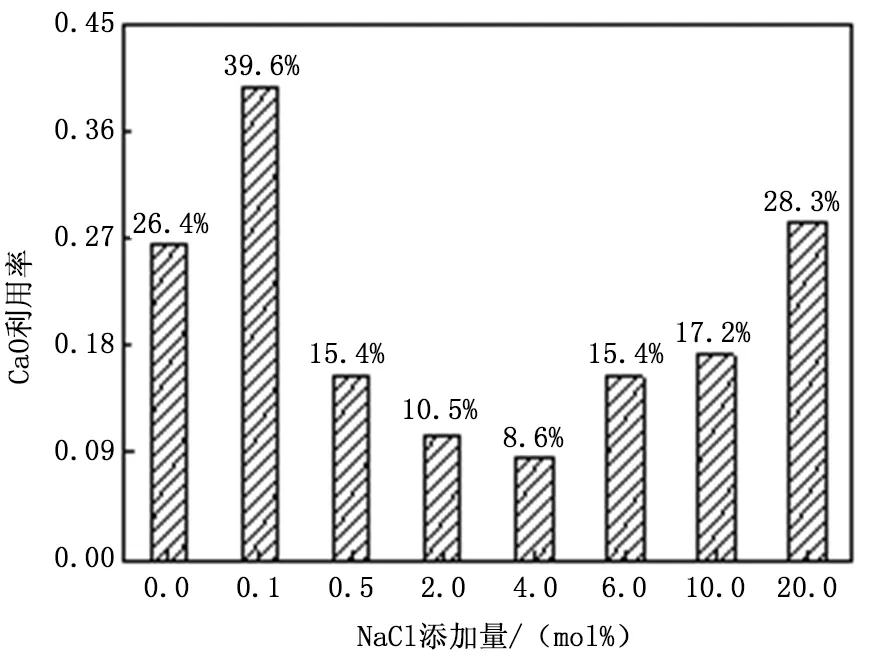
圖8 NaCl添加量對吸收劑鈣利用率的影響
如圖8所示,隨著NaCl添加量的增加,吸收劑利用率呈現先升高后降低再升高的趨勢。當NaCl添加量為0.1mol%時,吸收劑利用率為39.6%,是實驗工況中的最大值,相比于無添加劑時提高了13.2%。同時,從表2和圖2可知,當NaCl添加量為0.1mol%時,雖然表面積及比孔容有所降低,但介孔相比于無NaCl添加時顯著增加,此范圍內的孔隙對脫硫反應具有較大的貢獻,因此最終吸收劑的鈣利用率有所增加。而隨著NaCl添加量的進一步增加,液相燒結加劇,吸收劑表面積迅速降低,平均孔徑向更大孔徑方向移動,導致吸收劑的鈣利用率逐漸降低,當NaCl添加量為4.0mol%時,吸收劑鈣利用率達到實驗工況中的最低值8.6%。令人意外的是,當NaCl添加量高于4.0mol%時,吸收劑的利用率又呈現出了升高的趨勢,NaCl添加量增加到20.0mol%時,吸收劑的鈣利用率達到28.3%,高于無添加劑時吸收劑的利用率。
圖9給出了NaCl添加量為0.5mol%和6mol%時吸收劑的SO2吸收速率隨時間的變化,從圖中可以看出,雖然在這兩種添加量下吸收劑的鈣轉化率幾乎相同,但吸收劑的脫硫特性卻存在著很大的差別。NaCl添加量為6.0mol%時,脫硫反應能更長時間的維持在化學反應控制階段,但在擴散控制階段其脫硫速率則相對較低。從表2可知,0.5mol%NaCl調質吸收劑的表面積為1.40m2/g,6.0mol% NaCl調質吸收劑的表面積則僅為0.75m2/g,因此0.5mol%NaCl調質吸收劑表面含有更多新鮮未反應的固相組分,單純考慮孔隙結構對吸收劑脫硫的影響,其化學反應控制階段應維持更長的時間,但實驗結果恰恰相反。
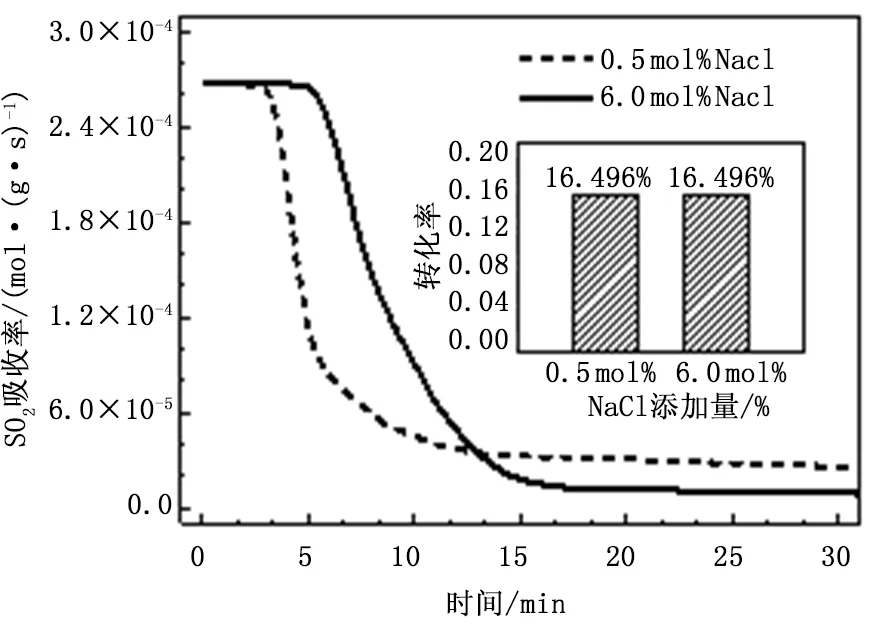
圖9 0.5mol%和6.0mol%NaCl調質吸收劑的脫硫速率曲線
由之前分析可知,NaCl可與硫酸化產物CaSO4發生低溫共熔,表面液膜的存在改變了反應物離子的擴散方式,使其由產物層中的固態離子擴散轉變為液相擴散,擴散速率大大增加。因此,較大含量的NaCl可以起到強化傳質的作用,使反應維持在化學反應控制階段,但當化學反應控制階段結束后,由于表面積極低,吸收劑近乎“燒死”,因此擴散控制階段的反應速率幾乎為零。隨著NaCl添加量的進一步增加,NaCl可溶解更多的CaSO4,使反應更長時間的維持在化學反應控制階段,因此當NaCl添加量大于4.0mol%時,隨著NaCl添加量的增加,吸收劑的鈣轉化率會逐漸增加。
綜上所述,NaCl添加量對吸收劑的鈣轉化率有顯著影響。當NaCl添加量較少時,NaCl與吸收劑的共熔作用對吸收劑鈣利用率的影響占主導地位。共熔產生的液膜可加速吸收劑的液相燒結,使吸收劑的表面積下降,平均孔徑增大。這種效應對表面積和孔徑分布的綜合作用決定了吸收劑的鈣轉化率。隨著NaCl添加量的增加,NaCl與硫酸化產物層的共熔作用對吸收劑鈣利用率的影響變得越來越重要。共熔液膜使產物層中的固態離子擴散轉變為液相擴散,擴散速率大大增加,有效提高了吸收劑的鈣轉化率。
3 結論
(1)NaCl調質可以改變石灰石煅燒產物的孔隙結構。其原因在于NaCl與吸收劑可發生低溫共熔,在吸收劑表面形成了一層由NaCl和CaO混合物組成的液膜,表面液膜加速了液相燒結,使吸收劑表面積下降,大孔數量增加。
(2)NaCl調質乏吸收劑可以改變再脫硫反應中的離子擴散方式。其原因在于NaCl與硫酸化產物層可以發生低溫共熔,表面熔融的NaCl會溶解初步脫硫吸收劑表面的CaSO4,進而破壞表面致密的產物層,使反應物的擴散方式由固態離子擴散轉變為液相擴散。
(3)NaCl添加量對脫硫反應中吸收劑的鈣轉化率有顯著影響,隨著NaCl添加量的增加,吸收劑鈣轉化率呈先升高后降低再升高的趨勢。當NaCl添加量較少時,NaCl與吸收劑的共熔作用對吸收劑鈣利用率的影響占主導地位,隨著NaCl添加量的增加,NaCl與硫酸化產物層的共熔作用對吸收劑鈣利用率的影響變得越來越重要。

