88例重疊肌炎的臨床及免疫學特征
肖云抒,朱馮赟智,羅 瀾,邢曉燕,李玉慧△,張學武,沈丹華
(1.北京大學人民醫院病理科,北京 100044;2.北京大學人民醫院風濕免疫科,北京 100044)
特發性炎性肌病(idiopathic inflammatory myopathies,IIMs)是一組以特征性皮疹及四肢近端肌無力為主要表現的異質性自身免疫病,主要包括皮肌炎(dermatomyositis,DM)、多發性肌炎(polymyositis,PM)、免疫介導壞死性肌病(immune-mediated necrotizing myopathy,IMNM)等。IIMs可累及多系統,肺、心臟受累多見。重疊肌炎(overlap myositis,OM)為IIMs與一種及以上的其他結締組織病(connective tissue disease,CTD)同時或先后出現,包括系統性紅斑狼瘡(systemic lupus erythematosus,SLE)、干燥綜合征(Sj?gren’s syndrome,SS)、類風濕關節炎(rheumatoid arthritis,RA)、系統性硬化癥(systemic sclerosis,SSc)。OM兼有兩種及以上CTD特征,肌肉外受累多見[1-2],雖然OM在IIMs中并不少見,但目前對其臨床及免疫學特征研究少[2-3],本文重點對其臨床及免疫學特征進行分析以提高對疾病的診治水平。
1 資料與方法
1.1 研究對象
共納入2004年1月至2020年8月于北京大學人民醫院住院的368例IIMs患者,均符合2017年歐洲抗風濕病聯盟(European League Against Rheumatism, EULAR)/美國風濕病學會(American College of Rheumatology,ACR)建議的IIMs分類標準[4]。OM患者符合IIMs和其他CTD的診斷[5],SSc患者符合2013年EULAR/ACR硬皮病分類標準[6],RA患者符合2010年EULAR/ACR分類標準[7],SS患者符合2002年歐美專家共識組(American-European Consensus Group,AECG)分類標準[8],SLE患者符合2019年ACR分類診斷標準[9]。抗合成酶綜合征(anti-synthetase syndrome,ASS)患者符合2011年Sothemier標準[10],PM、IMNM、DM患者符合2017年國際肌病協作組建議的IIMs分類標準[4],排除腫瘤相關肌炎、包涵體肌炎和起病年齡<18歲的患者。
1.2 臨床及實驗室資料
臨床資料包括患者人口學特征和臨床表現(發熱、Gottron征/疹、向陽疹、披肩征、V型疹、皮膚破潰、技工手、甲周紅斑、皮膚鈣質沉著、肌痛、肌無力、關節炎、雷諾現象、吞咽困難、間質性肺炎、心臟受累、肺動脈高壓),間質性肺炎通過胸部高分辨CT確診,肺動脈高壓通過超聲心動圖估算靜息狀態下收縮期肺動脈壓>30 mmHg確診。實驗室指標包括丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天門冬氨酸氨基轉移酶(aspartate amino transferase,AST)、乳酸脫氫酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、紅細胞沉降率(erythrocyte sedimentation rate,ESR)、C反應蛋白(C-reactive protein,CRP)和自身抗體。自身抗體包括抗核抗體(antinuclear antibodies,ANA)、類風濕因子(rheumatoid factors,RF)、肌炎相關性抗體(myositis-associated autoantibodies,MAAs)和肌炎特異性抗體(myositis-specific autoantibodies,MSAs)。MAAs包括抗Ku抗體、抗多肌炎/硬皮病(polymyositis/systemic scleroderma,PM/Scl)75/100抗體、抗Ro-52抗體。MSAs包括抗Mi-2、抗轉錄中介因子-1γ(transcription intermediary factor-1γ,TIF-1γ)抗體、抗黑色素瘤分化相關基因5(melanoma differentiation associated gene 5,MDA5)抗體、抗核基質蛋白2(nuclear matrix protein 2,NXP2)抗體、抗小泛素樣修飾物活化酶(small ubiquitin-like modifier activation enzyme,SAE)抗體、抗SRP抗體和抗酰胺tRNA合成酶抗體(anti-aminoacyl-tRNA synthetase antibody,抗ARS抗體)。抗ARS抗體包括抗Jo-1抗體、抗蘇氨酰tRNA合成酶(threonyl tRNA synthetase,PL-7)抗體、抗丙氨酰tRNA合成酶(alanyl tRNA synthetase,PL-12)抗體、抗甘氨酰tRNA合成酶(glycyl tRNA synthetase,EJ)抗體、抗異亮氨酰tRNA合成酶(isoleucyl tRNA synthetase,OJ)抗體。
1.3 統計學分析

2 結果
2.1 OM患者的臨床特征
在納入研究的368例IIMs患者中,23.9%(88/368)為OM患者,其中女性75例(85.2%),發病年齡(50.3±14.4)歲。OM患者和非OM患者相比,女性比例高(85.2%vs.72.1%,P=0.016),病程長[13.5(4.5,48.0)個月vs.4.0(2.0,12.0)個月,P<0.001)]。臨床表現上,OM患者比非OM患者V型疹(25.0%vs.44.6%,P=0.001)、甲周紅斑(8.0%vs.19.6%,P=0.013)發生率低,雷諾現象(14.8%vs.1.8%,P<0.001)、間質性肺炎(88.6%vs.72.1%,P=0.001)、肺動脈高壓(22.7%vs.7.5%,P<0.001)、心臟受累(18.2%vs.9.3%,P=0.033)發生率高(表1)。
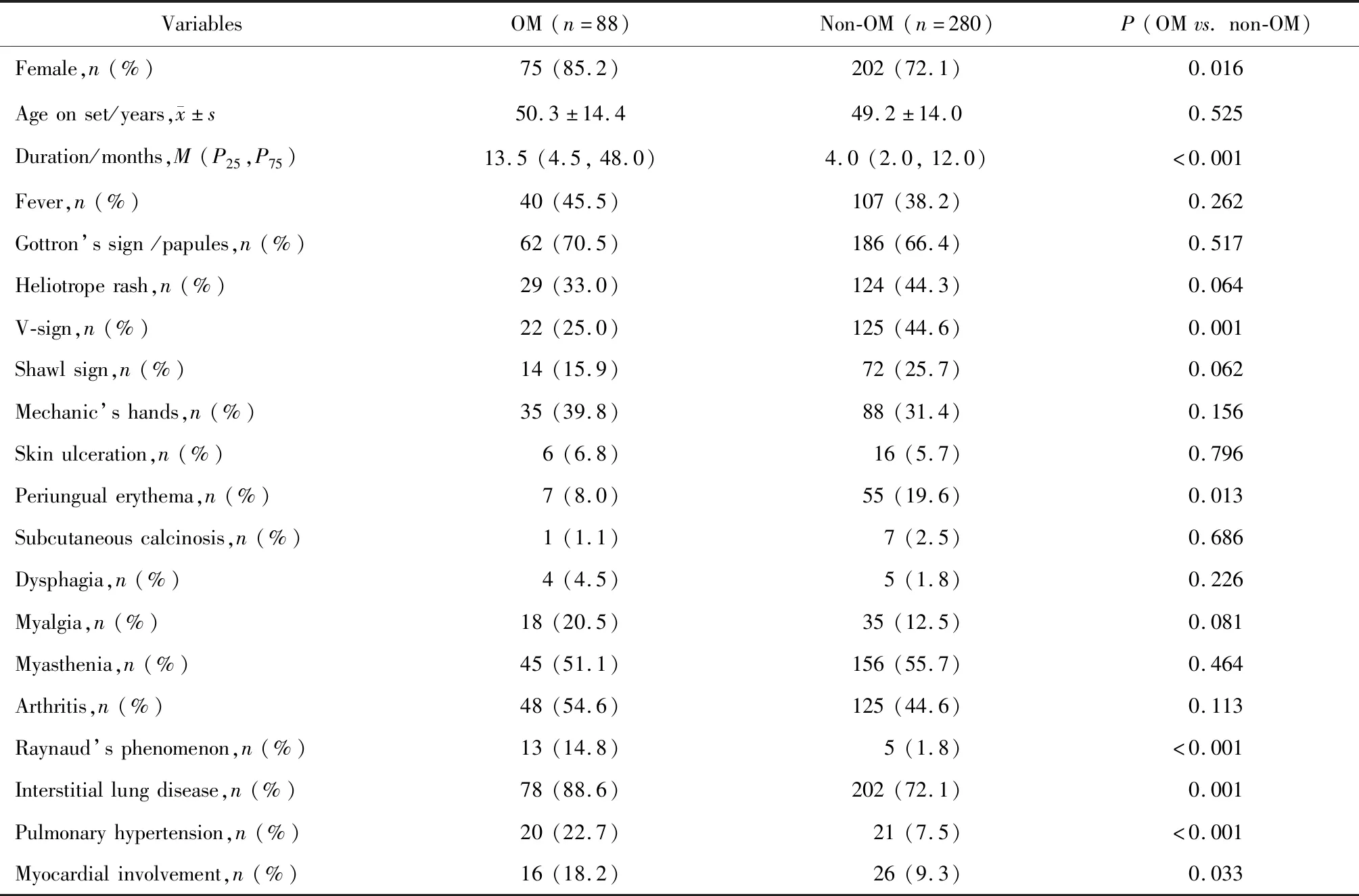
表1 OM患者臨床特征Table 1 Clinical characteristics of patients with overlap myositis
2.2 OM患者免疫學特征
OM患者和非OM患者相比,AST升高少見(31.8%vs.45.0%,P=0.035),CRP升高多見(58.0%vs.44.6%,P=0.037)。OM患者和非OM患者相比,ANA(85.1%vs.63.4%,P=0.001)、RF(40.2%vs.17.8%,P<0.001)、抗Ro-52抗體(71.6%vs.56.1%,P=0.038)陽性率高(表2)。

表2 OM患者的免疫學特征Table 2 Immunological characteristics of patients with overlap myositis
2.3 OM患者中肌炎及重疊結締組織病分布情況
88例OM患者中肌炎亞型分布情況如下:60.2%(53/88)為CTD合并DM,34.1%(30/88)為CTD合并ASS,3.4%(3/88)為CTD合并PM,2.3%(2/88)為CTD合并IMNM。OM患者中合并2種及以上CTD的占17.0%(15/88),包括5例IIMs +SSc+SS,3例IIMs+SLE+SS,3例IIMs+RA+SS,2例IIMs+SSc+RA,1例IIMs+SLE+RA+SS,1例IIMs +SLE+SSc+SS;合并1種CTD的占83.0%(73/88),其中46.6%(34/73)合并SS,20.6%(15/73)合并RA,19.2%(14/73)合并SLE,13.7%(10/73)合并SSc。
2.4 OM患者生存狀態分析
368例IIMs患者隨訪了340例(包括死亡31例),失訪28例,隨訪時間0.3~16.0年,中位隨訪時間3.9(1.8,7.6)年。IIMs患者病死率為9.1%(31/340),其中OM、非OM患者病死率分別為4.6%(4/87)和10.7%(27/253)。OM與非OM患者的1年生存率和5年生存率差異無統計學意義(圖1)。
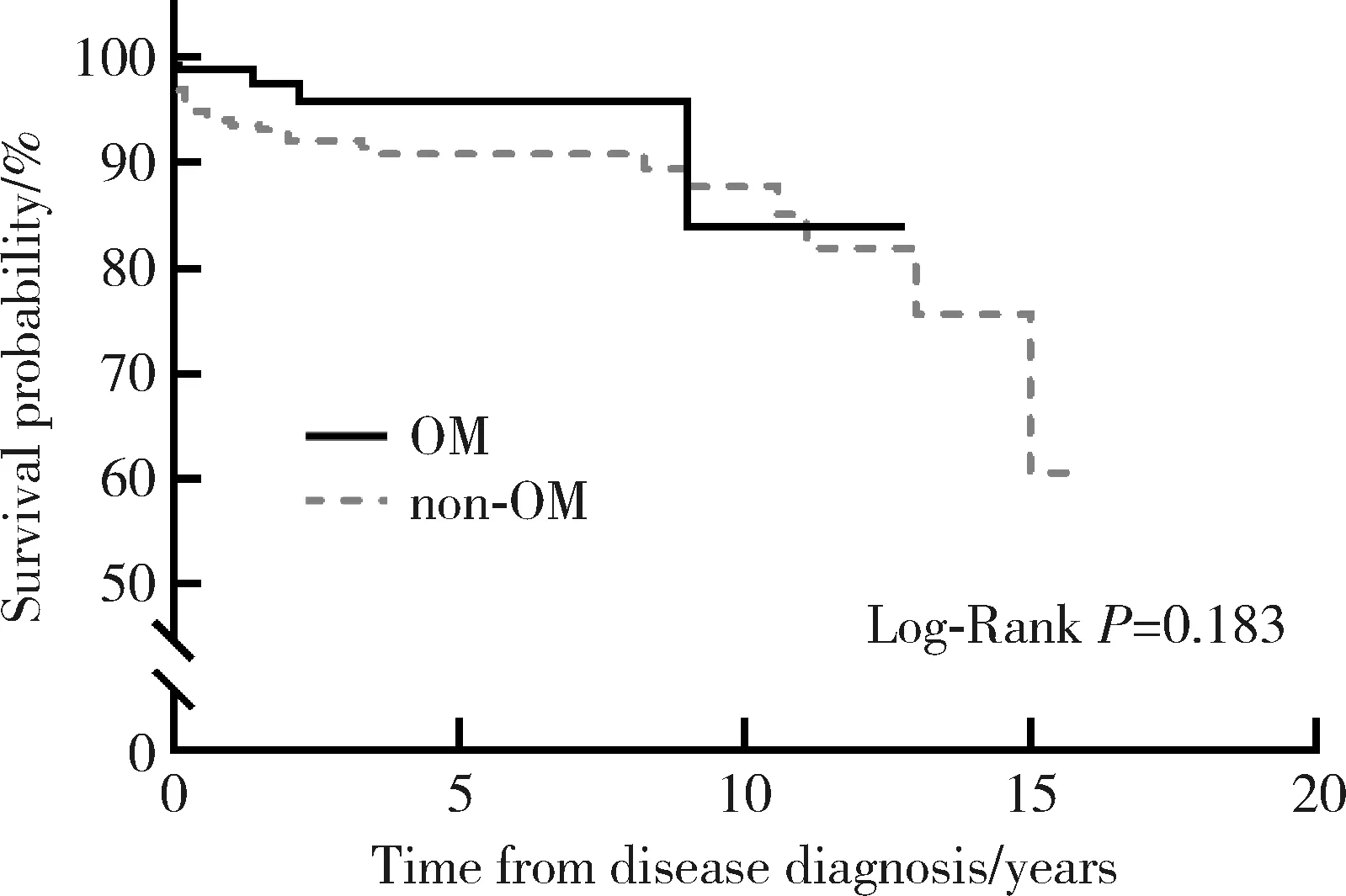
OM,overlap myositis.圖1 OM患者及非OM患者的Kaplan-Meier生存曲線分析Figure 1 Kaplan-Meier survival analysis of OM and non-OM patients
3 討論
OM是較少研究的IIMs亞型,本研究中OM患者占IIMs的23.9%,與既往文獻報道OM占IIMs的13.1%[1]~39.4%[11]大致相符。Troyanov等[12]對100例IIMs患者進行平均8.7年隨訪發現OM患者的比例從24%上升至31%,對于IIMs患者,重疊CTD可以發生在診斷IIMs之后數月乃至數年,因此隨訪時間對OM的發病率有一定影響。
文獻報道OM患者女性占79%~94.9%[2-4],本研究OM患者女性占85.2%,高于非OM患者,與文獻報道[2-4]一致,說明女性IIMs患者更容易重疊CTD。Lilleker等[1]報道的OM患者中位病程11個月,長于其他亞型的IIMs患者,本研究的病程與其基本一致,提示臨床上對于患有IIMs的女性,在隨診中應警惕重疊其他CTD的風險。
文獻報道[2-4,11-12]與其他亞型的IIMs患者相比,OM患者的肌肉外受累發生率增加,包括關節炎(11.7%~66.0%)、雷諾現象(16.8%~65.3%)、間質性肺炎(32.0%~48.0%)、肺動脈高壓(15.3%)、心臟受累(12.0%~26.5%),其中一些經常在重疊的CTD中發現,本研究發現OM患者較非OM患者雷諾現象、間質性肺炎、肺動脈高壓、心臟受累發生率高,與上述報道[2-4,11-12]一致,提示臨床上面對有明顯肌肉外受累的IIMs患者應高度警惕是否合并其他CTD。
間質性肺炎是IIMs常見的肺部表現,其發生率約20%~78%[13],本研究結果與文獻 [13]一致。抗ARS抗體、抗MDA5抗體、抗Ro-52抗體陽性與IIMs患者的間質性肺炎的發生相關[14],也間接證明了該研究結果。間質性肺炎在OM患者中比較常見且被認為是IIMs患者預后不良的因素[3],其診斷依賴于胸部高分辨CT,該研究結果提示OM患者隨診中應注意復查胸部高分辨CT,早期識別間質性肺炎,給予相應治療。
IIMs患者肺動脈高壓的發病情況和預后影響尚未被充分研究,特別是OM患者合并肺動脈高壓的情況。Nuo-Nuo等[3]報道OM患者肺動脈高壓的發生率為15.3%。在CTD合并肺動脈高壓的研究中發現使用超聲心動圖評估肺動脈高壓會高估其發生率[15-16],本研究評估肺動脈高壓的方法是超聲心動圖,因此可能高估了IIMs患者肺動脈高壓的發生率。文獻報道[17-18]合并肺動脈高壓的IIMs患者均合并間質性肺炎,本研究的結果與其一致,這提示IIMs患者發生肺動脈高壓和間質性肺炎可能有較強的相關性。有研究報道[19-20]SLE、SSc患者合并肺動脈高壓的比例高于DM/PM,肺動脈高壓可能是IIMs患者重疊CTD的結果。Albrecht等[21]報道肺動脈高壓是IIMs患者在整體健康狀況方面預后不良的指征;Ruiz-Cano等[22]報道CTD相關肺動脈高壓的預后差,其5年生存率僅42%,這提示對于合并肺動脈高壓的OM患者,隨診中應注意關注其心肺功能,警惕呼吸循環功能障礙。
文獻報道OM患者發生心臟受累的比例為12.0%~26.5%[3,12,23-24],發生比例高于無重疊CTD的IIMs患者[3-4],本研究的結果與其相似。心臟受累在IIMs中并不少見并且已被證明是IIMs預后不良的因素[25],但大多數心臟受累是亞臨床表現,早期癥狀不明顯,容易被忽視[26]。據報道,心臟受累的亞臨床表現有心肌炎、心律失常、傳導阻滯等[27],其中ST-T變化和傳導阻滯最常見,發生率分別為12.5%~56.7%和25.0%~38.5%[27],主要致死的表現是充血性心力衰竭、心肌梗死、完全性傳導阻滯[26],提示對于OM患者,應注意復查心電圖。
文獻報道[28]IIMs患者出現ANA陽性和RF陽性時重疊CTD的可能性提高,本研究結果與其基本一致。MSAs/MAAs在OM患者中的分布情況有較少的報道:Betteridge等[29]報道IIMs患者重疊CTD與抗PM-Scl抗體、抗Ku抗體相關;Rigolet等[30]報道抗Ku抗體陽性的IIMs患者重疊SSc的比例達45.5%;Maundrell等[31]報道抗PM-Scl抗體、抗Ro-52抗體陽性率在重疊SSc的IIM患者中升高。但本研究中除了抗Ro-52抗體以外的MSAs/MAAs,OM患者與非OM患者陽性率無明顯差異,可能由于本研究是單中心回顧性研究,存在樣本量不足、選擇偏倚的問題。
據報道,OM患者重疊的CTD常見的是SSc、SLE,重疊RA、SS情況比較少[30],但也有研究發現IIMs患者隨訪過程中SS是最常見的合并自身免疫病[32],本研究中OM患者重疊的CTD最多見的是SS,造成OM患者重疊的CTD分布不同的原因可能是隨訪時間差異、人群差異、選擇偏倚。
Danieli等[25]報道OM患者的預后較無重疊CTD的IIMs差,五年生存率(63.6%)和中位生存期(診斷后50個月)都較PM和DM患者顯著降低,但尚未在一些長期隨訪研究中得到相似結論[33-34];Ng等[32]和Amaral等[34]報道IIMs患者癌癥、心臟受累、肺受累和感染是主要死亡原因。本研究未發現OM患者較非OM患者預后之間的明顯差異。可能的原因是排除了腫瘤相關肌炎的患者、住院率偏倚和隨訪時間不足。對于OM患者的長期生存情況仍需擴大樣本和長期跟蹤隨訪研究以充分明確。
本研究描述了OM以及非OM患者的免疫學特征和預后情況的差異,樣本量較大,確定了OM患者病程長、肌肉外受累多見,包括肺動脈高壓、心臟受累。本研究存在局限性,首先是回顧性研究,容易產生信息偏倚,并且部分患者的免疫學檢查數據不完整,其次本研究為單中心研究,選擇偏倚可能使入院的患者病情比一般患者更加復雜嚴重。未來有待進一步開展多中心大樣本研究以更明確重疊肌炎患者的臨床及免疫學特征。

