轉基因玉米NK603轉化體/zSSIIb內標基因二重微滴數字PCR方法的建立及應用
肖芳,李俊,王顥潛,翟杉杉,陳子言,高鴻飛,李允靜,吳剛,張秀杰,武玉花
轉基因玉米NK603轉化體/內標基因二重微滴數字PCR方法的建立及應用
肖芳1,李俊1,王顥潛2,翟杉杉1,陳子言2,高鴻飛1,李允靜1,吳剛1,張秀杰2,武玉花1
1中國農業科學院油料作物研究所/農業農村部油料作物生物學與遺傳育種重點實驗室,武漢 430062;2農業農村部科技發展中心,北京 100025
【目的】批準進口的轉基因玉米NK603是中國轉基因生物安全監管的主要對象。轉基因安全監管需要標準物質和標準檢測方法,建立轉基因玉米NK603的數字PCR(dPCR)方法將為轉基因玉米NK603的定量檢測和標準物質研制提供精準測量技術。【方法】采用人工合成技術構建標準質粒分子pUC57-NK603;將NK603轉化體與不同的玉米內標基因引物/探針一一組合,遴選與NK603轉化體特異性PCR具有相同擴增能力的玉米內標基因PCR方法;設置二重微滴數字PCR(ddPCR)的退火溫度梯度和引物/探針濃度梯度,優化二重ddPCR的反應體系和反應條件;用梯度稀釋的標準質粒溶液作模板,考察二重ddPCR的檢測極限、定量極限和動力學范圍;將轉基因玉米NK603種子粉末和非轉基因玉米種子粉末混合,配制質量分數分別為100%、10%和6%的盲樣,考察二重ddPCR的定量準確性。【結果】用標準質粒分子pUC57-NK603作為二重ddPCR的質控對照,通過考察二重ddPCR反應熱圖的微滴信號強度、陽性微滴與陰性微滴分辨率、雨滴數量、NK603轉化體與內標基因拷貝數比值測量值與預期值的一致性,確定將NK603轉化體特異性PCR方法與內標基因PCR方法組合,建立NK603/二重ddPCR方法。二重ddPCR反應體系中NK603轉化體和內標基因的引物/探針濃度相同,均為400 nmol·L-1/200 nmol·L-1,在60℃退火延伸。NK603/二重ddPCR的檢測極限是2 copies DNA模板,定量極限是48 copies DNA模板,動力學范圍是10—60 000 copies DNA。應用NK603/二重ddPCR方法可準確定量玉米盲樣中的NK603轉化體含量,定值結果變異系數小于25%;dPCR定量結果與熒光定量PCR(qPCR)定量結果無顯著差異,且具有更高的精確性。【結論】內標基因的選擇會影響dPCR定量結果的準確性,在建立dPCR方法的過程中,要用具有準確量值的樣品作為質控對照,評估內標準基因的適用性。以人工合成的標準質粒分子pUC57-NK603為質控對照,建立了NK603/二重ddPCR方法。應用建立的二重ddPCR定值方法進行標準物質的研制和定值,已成功研制出轉基因玉米NK603有證標準物質。
轉基因玉米NK603;二重數字PCR;標準質粒分子;內標基因;定量
0 引言
【研究意義】轉基因檢測是轉基因生物安全監管和轉基因標識制度實施的技術基礎,需要標準化的檢測方法和標準物質。目前,熒光定量PCR(qPCR)被認為是轉基因定量檢測的金標方法,國際標準化組織(international organization for standardization,ISO)及歐盟等發布的轉基因產品定量檢測標準都是基于qPCR技術[1]。研制轉基因檢測標準物質需要一種參考方法對標準物質進行定值,若用qPCR方法為標準物質進行定值,則會令定值過程陷入用依賴標準物質的方法為標準物質進行定值的悖論[2]。數字PCR(dPCR)是近幾年發展起來的核酸精確定量技術,與實時熒光定量PCR技術相比,dPCR可不依賴標準物質和標準曲線對PCR反應中初始DNA模板進行絕對定量,是進行標準物質定值的潛在基準方法[3-4]。前期研究表明,在同一PCR管中同時進行外源基因和內標基因的二重PCR擴增,可消外源基因和內標基因的取樣誤差,與單重dPCR相比,二重dPCR的測量結果具有更高的準確性和重復性[5-6]。因此,建立和優化二重dPCR方法對轉基因產品的定量檢測和標準物質定值具有重要意義。【前人研究進展】dPCR技術已廣泛應用于轉基因檢測、標準物質定值、臨床診斷、法醫科學、基因表達檢測、拷貝數變異分析等領域[7-11]。為保證dPCR測量結果的準確性,需對dPCR操作進行嚴格的質量控制。2013年Huggett等[12]發表了dPCR MIQE指南,列出了發表dPCR研究應包含的最少信息,旨在促進dPCR試驗程序的標準化。Yoo等[13]為了驗證用dPCR定量核酸分子的準確性,同時使用流式細胞儀和dPCR儀測量質粒拷貝數濃度,2種方法的測量結果具有良好的一致性,表明dPCR可成為測量核酸拷貝數濃度的潛在參考方法。dPCR基于泊松分布原理對初始DNA模板進行定量,其定量結果主要受3個因素的影響,分別是陽性微滴與陰性微滴的準確識別、反應單元的體積和DNA模板的稀釋倍數[14-15]。一些研究已經證實總反應單元數、陽性反應單元比率和反應單元的體積影響dPCR測量結果的準確性[16-17]。Corbisier等[16]用光學顯微鏡測定了QX100生成微滴的體積,發現測量體積比數據分析軟件默認的體積小8%,反應單元體積的錯估會直接影響測量結果。分析以上3個因素引入的測量不確定度并合成,有望將ddPCR結果溯源至國際單位(système international d'unités,SI)[14,18]。以dPCR作為定值技術,美國國家標準與技術研究所(national institute of standard and technology,NIST)研制出了用于巨細胞病毒檢測(SRM 2366)、亨廷頓病檢測(SRM 2393)等用途的核酸標準物質[19]。歐盟標準物質與測量研究所(institute of reference materials and measurement,IRMM)研制出了用于慢性骨髓性白血病檢測的核酸標準物質(編號ERM-AD623)[20]。在轉基因檢測領域,dPCR已成功用于轉基因產品定量檢測和標準物質定值,如dPCR已用于轉基因玉米DAS1507、NK603,轉基因大豆MON87769、MON87708、MON87705、FG72、GTS40-3-2等的定量檢測[21-23];在前期,中國也成功將dPCR技術用于轉基因水稻TT51-1、G6H1、科豐6號、克螟稻[24-27],轉基因玉米T25、MIR604,以及轉基因大豆MON89788標準物質特性量值的測定[28-29],成功發布了多個有證標準物質。【本研究切入點】NIST研究認為,實現影響dPCR準確測量的3個要素的溯源,可將dPCR測量結果溯源到SI單位[14]。而準確識別陽性微滴和陰性微滴是影響定量結果準確性的關鍵因素,在讀取反應單元信號時,若中等信號強度單元(下雨現象)太多會影響陽性反應單元和陰性反應單元的準確識別,進而影響定量結果的準確性。因此,在實際測量中,dPCR測量結果的準確性還依賴于引物/探針組合、反應體系、反應條件、操作程序等因素。轉基因玉米NK603是中國批準進口的轉基因品種,是中國生物安全監管的重要對象,急需研制NK603標準物質,為轉基因玉米NK603的安全監管提供物質基礎。雖然歐盟已經建立了NK603轉化體特異性qPCR方法,但由于qPCR和dPCR的反應試劑不同,不能直接將qPCR方法平移到dPCR平臺上,需對dPCR反應體系和反應條件等進行優化。【擬解決的關鍵問題】本研究擬以轉基因玉米NK603為材料,將NK603轉化體特異性引物/探針與不同的玉米內標基因引物/探針進行組合,比較測量結果,遴選出與NK603轉化體特異性PCR方法組合的最適內標基因PCR方法,并對二重微滴數字PCR(ddPCR)的反應體系和反應條件進行優化,建立NK603轉化體與內標基因的二重ddPCR,為轉基因玉米NK603定量檢測和標準物質定值提供準確的測量方法。
1 材料與方法
1.1 材料
轉基因玉米NK603是美國孟山都公司研發的抗草銨膦轉基因玉米,轉基因玉米NK603及其受體對照種子由農業農村部科技發展中心提供。將轉基因玉米NK603種子及其受體玉米種子研磨成粉末,用校準的天平按照質量比分別稱量NK603玉米粉末和相應的受體粉末,混合均勻,配制成轉基因玉米NK603質量分數為10%、6%的樣品,用于二重ddPCR方法的測試。
1.2 引物及探針
NK603轉化體特異性引物/探針來源于歐盟發布的標準[30],玉米內標基因、、、、的引物/探針來源于發表的文獻或國家標準[31],其中,和是同一內標基因的2個方法。在NK603轉化體特異性探針603-QP的5’端標記激發熒光染料6-FAM、3’端標記淬滅熒光染料BHQ1;在內標基因探針的5’端標記激發熒光染料HEX、3’端標記BHQ1。NK603轉化體和玉米內標基因的引物/探針均由生工生物工程(上海)股份有限公司合成,序列信息詳見表1。
1.3 基因組DNA的提取與純化
稱取質量分數分別為100%、10%和6%的NK603樣品100—200 mg,用QIAGEN試劑盒DNeasy Plant Mini Kit(貨號69106)提取純化基因組DNA,用微量紫外可見分光光度計NanoDrop one測定DNA的濃度,用0.1×TE緩沖液將DNA濃度調整到約100 ng·μL-1備用。試驗于2020年4月在轉基因檢測中心DNA提取室開展。
1.4 重組質粒的構建與酶切
將NK603轉化體特異性片段和玉米內標基因(Accession No. X07535)、(Accession No. X07535)、(Accession No. AJ131373)、(Accession No. NC_024462)和(Accession No. X04050)的PCR擴增片段依次拼接,拼接出一個融合片段。委托北京擎科生物科技有限公司(武漢分公司)人工合成NK603轉化體和玉米內標基因的融合序列,并克隆至載體pUC57中,構建標準質粒分子pUC57-NK603。用質粒提取試劑盒提取純化重組質粒pUC57-NK603。用環形質粒分子作ddPCR的模板,會引發嚴重的下雨現象,導致難以準確區分陽性微滴和陰性微滴[15],需將質粒分子線性化。用限制性內切酶Ⅰ對質粒pUC57-NK603進行單酶切,酶切反應體系為Ⅰ 2 μL、質粒1 μg、10×buffer 5 μL,加ddH2O至50 μL;反應條件為37℃30 min;65℃20 min,反應終止。線性化的質粒pUC57-NK603保存于-20℃,用于二重ddPCR方法的建立。試驗于2020年2月—3月在轉基因檢測中心分子生物學實驗室開展。
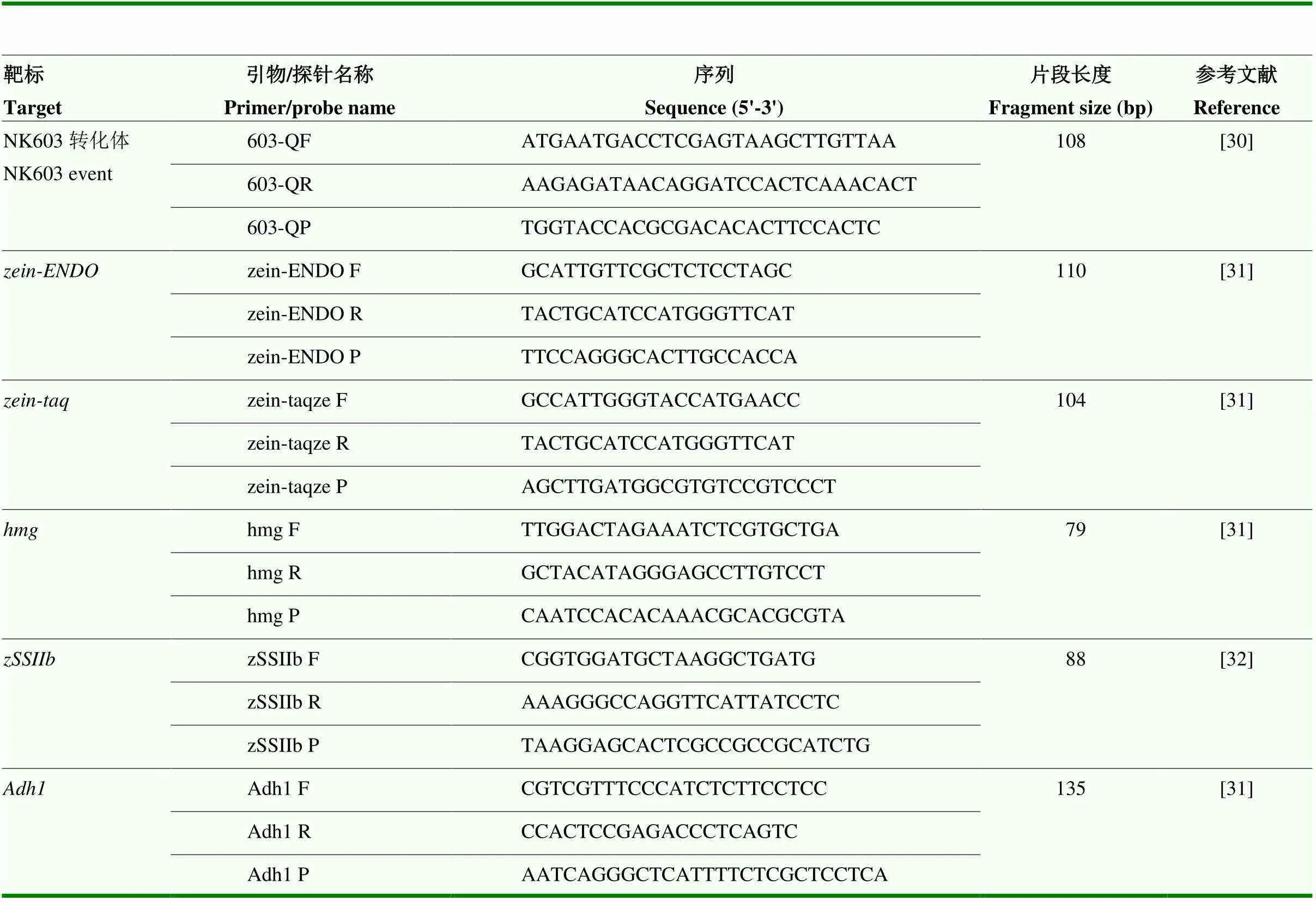
表1 PCR引物/探針信息
1.5 實時熒光定量PCR方法
在CFX96熒光定量PCR儀上進行qPCR,反應體系為1×Premix Ex Taq?、上、下游引物終濃度400 nmol·L-1、探針終濃度200 nmol·L-1、DNA模板濃度為100—1 000 000 copies·μL-1。反應程序為95℃1 min;95℃ 15 s,60℃60 s,40個循環。在退火延伸(60℃)時收集熒光信號。反應結束后用軟件Bio-Rad CFX Manager 3.1分析數據。試驗設置3個重復。以梯度稀釋的標準質粒pUC57-NK603為校準樣品進行NK603轉化體和玉米內標基因的實時熒光PCR擴增,根據校準樣品模板拷貝數的對數與Ct值之間的線性關系,分別繪制NK603轉化體PCR和玉米內標基因PCR的標準曲線。將測試樣品中NK603轉化體和內標基因的Ct值分別代入標準曲線,計算測試樣品中NK603轉化體和內標基因的拷貝數。測試樣品中轉基因玉米NK603含量=NK603轉化體拷貝數/內標基因拷貝數×100%。試驗于2020年7月在轉基因檢測中心PCR準備室和PCR擴增室開展。
1.6 二重ddPCR方法
用QX200微滴數字PCR系統進行二重ddPCR反應,反應體系為20 μL,反應體系中各組分的濃度同qPCR。將配制的20 μL反應液轉移至微滴生成卡中,然后加入70 μL微滴生成油,蓋上膠墊,放入微滴生成儀(Bio-Rad,美國)中生成微滴,將40 μL微滴小心緩慢地轉移至96孔板中,蓋上鋁膜,用熱封儀封膜,在普通PCR儀C1000中進行擴增。反應結束后將96孔板放入微滴讀取儀(Bio-Rad,美國)中讀取微滴信號,用軟件QuantaSoft Version 1.7.4.0917分析數據。試驗設置3個重復。轉基因玉米NK603含量=NK603轉化體拷貝數/內標基因拷貝數×100%。
引物/探針濃度優化,反應體系包括10 μL 1× ddPCR Supermix、1 μL DNA模板、上下游引物、探針(NK603轉化體和內標基因),加水至20 μL。設置4個引物/探針濃度梯度,終濃度依次為100/50、200/100、400/200和800 nmol·L-1/400 nmol·L-1。反應程序退火溫度優化,為95℃10 min;94℃30 s,退火60 s(溫度梯度設置為52℃、52.7℃、54℃、55.9℃、58.4℃、60.3℃、61.4℃和62℃),40個循環;98℃10 min,4℃保溫。根據ddPCR反應熱圖確定二重ddPCR的最適引物/探針濃度和退火溫度。
以測試樣品的基因組DNA為模板進行二重ddPCR定量檢測,通過軟件QuantaSoft Version 1.7.4.0917直接讀取測試樣品單位體積DNA中NK603轉化體和內標基因的拷貝數。測試樣品中轉基因玉米NK603含量的計算,同qPCR方法。試驗于2020年4月—7月在轉基因檢測中心PCR準備室和PCR擴增室完成。
2 結果
2.1 構建標準質粒分子
將NK603轉化體和玉米內標基因的PCR擴增序列依次拼接,拼接時在轉化體特異性序列與內標基因之間插入一段20 bp的間隔序列,拼接出一個611 bp的核苷酸片段(圖1-A),人工合成并克隆至載體pUC57中,構建了攜帶NK603轉化體序列和4個玉米內標基因的標準質粒分子pUC57-NK603(圖1-B)。經重測序驗證,標準質粒分子pUC57-NK603攜帶一個拷貝的NK603轉化體和各內標基因的靶標序列,NK603轉化體和各玉米內標基因的拷貝數比值為1.0(轉基因含量100%)。
2.2 玉米內標基因的比較
將NK603轉化體引物/探針與不同的玉米內標基因、、、和引物/探針分別組合,以標準質粒分子pUC57-NK603為模板,進行二重ddPCR擴增。每個二重ddPCR組合設置了8個退火溫度梯度(52℃、52.7℃、54℃、55.9℃、58.4℃、60.3℃、61.4℃和62℃)。二重ddPCR一維熱圖顯示,NK603轉化體引物/探針與不同的玉米內標基因引物/探針組合,NK603轉化體陽性微滴的信號強度相似;在不同退火溫度下NK603轉化體陽性微滴的信號強度相近,但隨著退火溫度的降低,中等信號強度微滴數增加(下雨現象加重)(圖2-A—E)。NK603/、NK603/二重ddPCR中,在任何退火溫度下都不能清晰地區分和的陰性微滴和陽性微滴(圖2-A和圖2-B);NK603/二重ddPCR中,雖能區分的陽性微滴和陰性微滴,但“下雨”現象相對嚴重(圖2-C);NK603/、NK603/二重ddPCR中,在所有溫度下都能清晰地區分和的陽性微滴和陰性微滴,微滴的信號強度也比較穩定,但與相比,在8個不同退火溫度下,的陽性微滴和陰性微滴的區分度更高、信號更強、中等信號強度的雨滴相對更少(圖2-D和圖2-E)。因此,初步選擇作為二重ddPCR的候選內標基因。
在不同退火溫度下,統計NK603/、NK603/和NK603/二重ddPCR測量的NK603轉化體與內標基因的拷貝數比值。NK603/二重ddPCR測量的拷貝數比值為0.92—0.94,低于理論值1.0;NK603/二重ddPCR測量的拷貝數比值為1.00—1.01,接近理論值1.0;NK603/二重ddPCR測量的拷貝數比值為1.04—1.06,高于理論值1.0(圖3)。比較3個二重ddPCR組合,NK603/二重ddPCR的拷貝數測量值最接近理論值1.0,表明玉米內標基因與NK603轉化體在PCR反應中具有相似的擴增能力,因此,確定用作為NK603轉化體定量檢測的內標基因,并與NK603轉化體組合,建立NK603/二重ddPCR方法。NK603/二重ddPCR的NK603轉化體和內標基因引物/探針均對退火溫度不敏感,在不同的退火溫度下,拷貝數比值測量值接近,但NK603轉化體引物/探針在退火溫度低于55.9℃時,中等信號強度微滴明顯增多(圖2-D)。58.4℃—62℃均是NK603/二重ddPCR的適宜退火溫度,選擇60℃作為NK603/二重ddPCR的最適退火溫度。在60.3℃退火溫度下,NK603/二重ddPCR的二維熱圖中有4個清晰的微滴群,對應陰性微滴、FAM熒光微滴、HEX熒光微滴和雙熒光微滴(圖2-F)。通過考察NK603轉化體和內標基因的微滴信號強度、陽性微滴與陰性微滴的分辨率、中等信號強度雨滴數量、以及NK603轉化體與內標基因拷貝數的比值,確定能與NK603轉化體組合進行二重ddPCR擴增的最適內標基因為,NK603/二重ddPCR的最適退火溫度為60℃。
2.3 NK603/zSSIIb二重ddPCR引物探針濃度優化
引物/探針濃度會影響ddPCR微滴信號強度、雨滴數量及測量值的準確性,通過設置引物/探針濃度梯度,遴選出最佳的引物/探針濃度。設計了2種模式的引物/探針濃度,第一種模式中NK603轉化體和內標基因的引物/探針濃度相同,設置了4個濃度梯度,分別為100/50、200/100、400/200和800 nmol·L-1/ 400 nmol·L-1;第二種模式中轉化體和內標基因的引物/探針濃度不同,轉化體和內標基因的引物/探針濃度分別為400/200、200 nmol·L-1/100 nmol·L-1,200/100、400 nmol·L-1/200 nmol·L-1,400/200、800 nmol·L-1/400 nmol·L-1,800/400、400 nmol·L-1/200 nmol·L-1。二重ddPCR一維熱圖如圖4所示,2種模式都可以根據擴增熱圖清晰的區分NK603轉化體和內標基因的陽性微滴和陰性微滴,NK603轉化體和內標基因的微滴信號強度都隨著引物/探針濃度的升高而升高,但當引物/探針濃度升至800 nmol·L-1/400 nmol·L-1,陽性微滴的信號強度波動區間變大,且雨滴增多(圖5-A4、圖5-A8、圖5-B4和圖5-B7)。統計不同的引物探針濃度下NK603轉化體與內標基因的拷貝數比值,發現拷貝數比值的測量值在0.98—1.04范圍內波動,均接近理論值(圖4-C)。當NK603轉化體和內標基因的引物/探針濃度均為400 nmol·L-1/200 nmol·L-1,或分別為200/100、400 nmol·L-1/200 nmol·L-1時,測得的NK603轉化體與內標基因的拷貝數比值更接近理論值1.0(圖4-C)。為方便反應體系配置,選擇400 nmol·L-1/200 nmol·L-1作為NK603/雙重ddPCR的引物探針濃度,NK603轉化體和內標基因的引物/探針濃度相同,且與qPCR反應體系一致。
2.4 NK603/zSSIIb二重ddPCR方法檢測限及線性范圍
用ddH2O梯度稀釋線性化的質粒pUC57-NK603到3×105、6×104、3×104、6×103、1.2×103、2.4×102、48、10和2 copies·μL-1,測試NK603/雙重ddPCR的線性動力學范圍及檢測極限。結果顯示,在空白對照中NK603轉化體和均未產生陽性微滴;當模板拷貝數濃度為3×105copies·μL-1時,NK603轉化體和全部微滴均為陽性,超過了ddPCR的最高檢測極限;當模板拷貝數濃度低至2 copies·μL-1時,所有反應中均有NK603轉化體和的陽性信號,但拷貝數濃度的測量值顯著偏離預期值,變異系數(relative standard deviation,RSD)大于25%,測量偏差(Bias)超過±25%,確定NK603/雙重ddPCR的檢測限為2 copies DNA;當模板濃度為48 copies·μL-1時,測量值的變異系數小于25%,測量偏差在±25%范圍內,確定NK603/雙重ddPCR的定量限為48 copies DNA。根據質粒模板預期濃度和測量濃度間的對應關系繪制NK603轉化體和的回歸曲線,NK603轉化體回歸曲線的決定系數2為0.999,內標基因回歸曲線的決定系數2為0.9989,在模板濃度為10—60 000 copies·μL-1的范圍內NK603/二重ddPCR測量的模板拷貝數與理論拷貝數間具有良好的線性關系(圖5)。
2.5 NK603/zSSIIb二重ddPCR方法應用
用NK603/二重ddPCR定量檢測轉基因玉米NK603粉末質量分數分別為100%(S1)、10%(S2)和6%(S3)的盲樣。3個盲樣轉基因含量的測量平均值分別為51.05%、4.82%和3.07%,定量結果的變異系數分別為1.91%、2.28%和0.50%(表2),都小于25%,符合歐盟規定的轉基因產品定量方法的性能要求。3個盲樣的實測轉基因DNA含量約為預期質量分數的一半,定量結果進一步表明轉基因玉米NK603種子為雜合體。
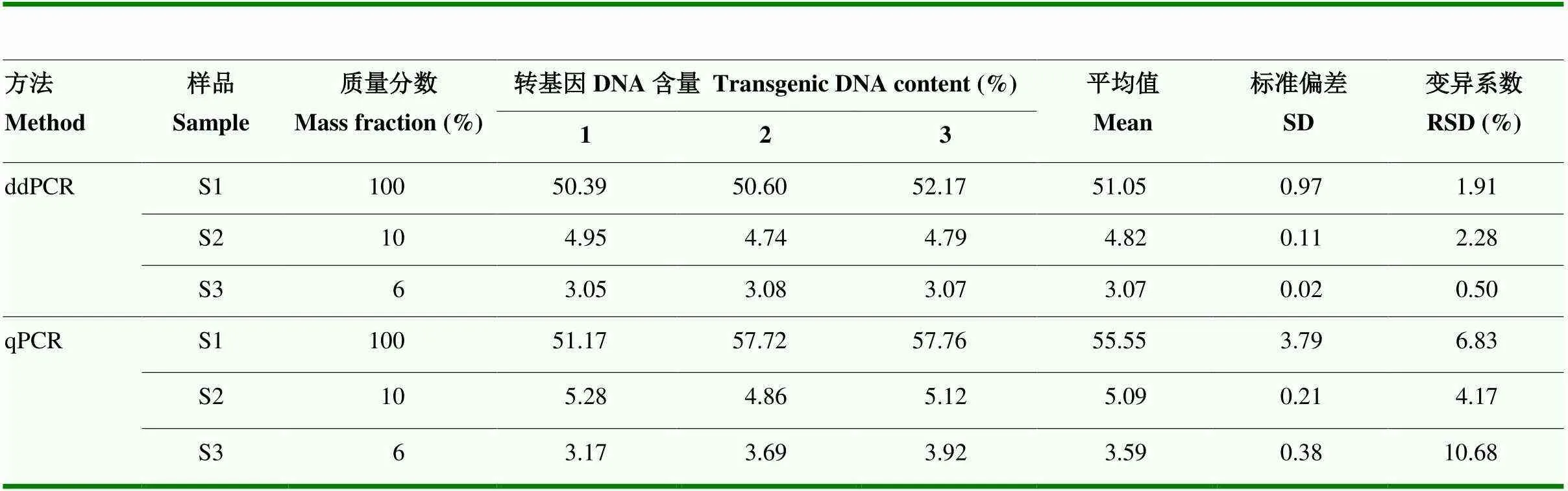
表2 二重ddPCR和qPCR檢測盲樣的轉基因含量
用梯度稀釋的標準質粒pUC57-NK603為標準樣品分別繪制NK603轉化體和內標基因的標準曲線,采用qPCR定量盲樣S1、S2和S3的轉基因含量。3個盲樣轉基因含量的測量平均值分別為55.55%、5.09%和3.59%,定量結果的變異系數分別為6.83%、4.17%和10.68%,均小于25%(表2)。比較二重ddPCR和qPCR的定量結果,3個盲樣2組測量結果的值均大于0.05,表明這兩種定量方法的定量結果間無顯著差異。定量同一個盲樣,二重ddPCR定量結果的變異系數小于qPCR,表明二重ddPCR定量結果具有更好的準確性。
3 討論
在轉基因檢測領域,dPCR已成功用于轉基因產品的定量檢測和標準物質定值[3],與qPCR相比,dPCR不需要用標準物質繪制標準曲線,但這并不意味著dPCR檢測不需要設置質控對照[12]。轉基因含量通常表征為轉基因DNA量與總DNA量的比值,轉基因DNA量通過測量外源基因或轉化體特異性序列拷貝數確定,總DNA量通過測量內標基因拷貝數確定。若要準確的測量樣品中的轉基因含量,在dPCR方法的建立和應用過程中,必須確保外源基因和內標基因具有相同的擴增能力,因此,dPCR雖然不依賴標準物質進行定量,但在dPCR反應時,必須設置至少1個有準確量值的樣品為質控對照,而理論轉基因含量為100%的純合體DNA是質控對照的最佳選擇。
玉米種子由種皮、胚和胚乳組成,種皮為二倍體,DNA全部來源于母本;胚乳占種子重量的80%—85%,為三倍體,2/3 DNA來源于母本,1/3來源于父本;胚為二倍體,一半DNA來源于母本,一半DNA來源于父本[33]。轉基因玉米種子的轉基因DNA含量與其基因型相關,純合種子的轉基因DNA含量理論上為100%,雜合種子的轉基因含量則受到轉基因親本來源、組織倍性等因素的影響,其轉基因含量不確定,理論值為33.3%—66.6%[34]。鑒定轉基因玉米NK603種子的基因型,發現研發者提供的NK603種子均為雜交種(數據未給出)。本研究在建立轉基因玉米NK603二重ddPCR方法過程中,必須要保證NK603轉化體具有與玉米內標基因相同的擴增能力,由于轉基因玉米NK603種子均為雜交種,其基因組DNA沒有確定的轉基因含量理論值,致使方法建立過程中缺少有準確量值的質控對照。為了獲取到有準確轉基因DNA含量的質控樣品,本研究通過人工合成的方式,構建了攜帶NK603轉化體和4個玉米內標基因擴增序列的標準質粒分子pUC57-NK603,轉化體序列與內標基因的拷貝數比值是1.0。試驗結果證明,質粒分子pUC57-NK603是一個合格的質控對照樣品,這意味著在后續建立dPCR方法過程中,若缺乏合適的質控對照,可通過人工合成的方式快速構建質粒分子作為質控對照。
采用dPCR技術進行轉基因成分定量檢測,內標基因的選擇會影響定量結果的準確性,要優先選擇單拷貝內標基因,應用多拷貝內標基因會導致轉基因含量的低估[35]。目前用于轉基因檢測的玉米內標基因有4個,涉及5種方法,分別為、、、、[29-30]。為評估各內標基因PCR方法的適用性,將NK603轉化體與各內標基因PCR方法一一組合,以標準質粒分子pUC57-NK603為DNA模板進行二重ddPCR擴增,根據擴增熱圖,發現難以區分和的陽性微滴和陰性微滴,和的PCR擴增能力與NK603轉化體PCR不一致,NK603/二重ddPCR會低估樣品中NK603轉化體含量,而NK603/二重ddPCR則會高估樣品中NK603轉化體含量,最終選擇與NK603組合,建立NK603/二重ddPCR方法。研究結果進一步證實,作物內標基因的選擇會影響轉基因定量結果的準確性。
4 結論
以人工合成的標準質粒分子pUC57-NK603為質控對照,成功建立了NK603/二重ddPCR方法,其定量結果比qPCR具有更高的精確性。應用NK603/二重ddPCR方法為標準物質定值,中國已成功研制出轉基因玉米NK603有證標準物質(有證標準物質編號GBW(E)100684、GBW(E)100685、GBW(E)100686)。
[1] Laura B, Marc H V d B, Marco M, Enrico B, Alexandre P. GMOMETHODS: the European Union database of reference methods for GMO analysis. Journal of AOAC International, 2012, 95(6): 1713-1719.
[2] Wu Y H, Li J, Li X Y, Zhai S S, Gao H F, Li Y J, Zhang X J, Wu G. Development and strategy of reference materials for the DNA-based detection of genetically modified organisms. Analytical and Bioanalytical Chemistry, 2019, 411(9): 1729-1744.
[3] Quan P L, Sauzade M, Brouzes E. dPCR: A technology review. Sensors, 2018, 18(4): 1271.
[4] Bhat S, Curach N, Mostyn T, Bains G S, Griffiths K R, Emslie K R. Comparison of methods for accurate quantification of DNA mass concentration with traceability to the international system of units. Analytical chemistry, 2010, 82(17): 7185-7192.
[5] Bogo?alec Ko?ir A, Dem?ar T, ?tebih D, ?el J, Milavec M. Digital PCR as an effective tool for GMO quantification in complex matrices. Food Chemistry, 2019, 294(1): 73-78.
[6] Whale A S, Cowen S, Foy C A, Huggett J F. Methods for applying accurate digital PCR analysis on low copy DNA samples. PLoS One, 2013, 8(3): e58177.
[7] Cottenet G, Blancpain C, Chuah P F. Performance assessment of digital PCR for the quantification of GM-maize and GM-soya events. Analytical and Bioanalytical Chemistry, 2019, 411: 2461-2469.
[8] K?ppel R, Bucher T, Frei A, Waiblinger H U. Droplet digital PCR versus multiplex real-time PCR method for the detection and quantification of DNA from the four transgenic soy traits MON87769, MON87708, MON87705 and FG72, and lectin. European Food Research and Technology, 2015, 241(4): 521-527.
[9] Cao Y, Raith M R, Griffith J F. Droplet digital PCR for simultaneous quantification of general and human-associated fecal indicators for water quality assessment. Water research, 2015, 70: 337-349.
[10] Devonshire A S, Honeyborne I, Gutteridge A, Whale A S, Nixon G, Wilson P, Jones G, McHugh T D, Foy C A, Huggett J F. Highly reproducible absolute quantification of Mycobacterium tuberculosis complex by digital PCR. Analytical chemistry, 2015, 87(7): 3706-3713.
[11] White H, Deprez L, Corbisier P, Hall V, Lin F, Mazoua S, Trapmann S, Aggerholm A, Andrikovics H, Akiki S, Barbany G, Boeckx N, Bench A, Catherwood M, Cayuela J-M, Chudleigh S, Clench T, Colomer D, Daraio F, Dulucq S, Farrugia J, Fletcher L, Foroni L, Ganderton R, Gerrard G, Gineikien? E, Hayette S, El Housni H, Izzo B, Jansson M, Johnels P, Jurcek T, Kairisto V, Kizilors A, Kim D-W, Lange T, Lion T, Polakova K M, Martinelli G, McCarron S, Merle P A, Milner B, Mitterbauer-Hohendanner G, Nagar M, Nickless G. A certified plasmid reference material for the standardisation of BCR-ABL1 mRNA quantification by real-time quantitative PCR. Leukemia, 2015, 29(2): 369-376.
[12] Huggett J F, Foy C A, Benes V, Emslie K, Garson J A, Haynes R, Hellemans J, Kubista M, Mueller R D, Nolan T, Pfaffl M W, Shipley G L, Vandesompele J, Wittwer C T, Bustin S A. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical chemistry, 2013, 59(6): 892-902.
[13] Yoo H B, Park S R, Dong L H, Wang J, Sui Z W, Pav?i? J, Milavec M, Akgoz M, Mozio?lu E, Corbisier P, Janka M, Cosme B, de V Cavalcante J J, Flatshart R B, Burke D, Forbes-Smith M, McLaughlin J, Emslie K, Whale A S, Huggett J F, Parkes H, Kline M C, Harenza J L, Vallone P M. International comparison of enumeration-based quantification of DNA copy-concentration using flow cytometric counting and digital polymerase chain reaction. Analytical chemistry, 2016, 88(24): 12169-12176.
[14] Kline M C, Duewer D L. Evaluating droplet digital polymerase chain reaction for the quantification of human genomic DNA: Lifting the traceability fog. Analytical chemistry, 2017, 89(8): 4648-4654.
[15] Demeke T, Dobnik D. Critical assessment of digital PCR for the detection and quantification of genetically modified organisms. Analytical and Bioanalytical Chemistry, 2018, 410(17): 4039-4050.
[16] Corbisier P, Pinheiro L, Mazoua S, Kortekaas A M, Chung P Y J, Gerganova T, Roebben G, Emons H, Emslie K. DNA copy number concentration measured by digital and droplet digital quantitative PCR using certified reference materials. Analytical and bioanalytical chemistry, 2015, 407(7): 1831-1840.
[17] Dong L H, Meng Y, Sui Z W, Wang J, Wu L Q, Fu B Q. Comparison of four digital PCR platforms for accurate quantification of DNA copy number of a certified plasmid DNA reference material. Scientific reports, 2015, 5: 13174.
[18] Duewer D L, Kline M C, Romsos E L, Toman B. Evaluating droplet digital PCR for the quantification of human genomic DNA: converting copies per nanoliter to nanograms nuclear DNA per microliter. Analytical and bioanalytical chemistry, 2018, 410(12): 2879-2887.
[19] Haynes R J, Kline M C, Toman B, Scott C, Wallace P, Butler J M, Holden M J. Standard reference material 2366 for measurement of human cytomegalovirus DNA. The Journal of Molecular Diagnostics, 2013, 15(2): 177-185.
[20] Deprez L, Mazoua S, Corbisier P, Trapmann S, Schimmel H, White H, Cross N, Emons H. The certification of the copy number concentration of solutions of plasmid DNA containing a BCR-ABL b3a2 transcript fragment, Certified Reference Materials: ERM?-AD623a, ERM?-AD623b, ERM?-AD623c, ERM?-AD623d, ERM?-AD623e, ERM?-AD623f. Publications Office of the European Union, 2012, ISSN: 1831-9424.
[21] Dobnik D, Spilsberg B, Bogo?alec K A, Holst-Jensen A, ?el J. Multiplex quantification of 12 European Union authorized genetically modified maize lines with droplet digital polymerase chain reaction. Analytical chemistry, 2015, 87(16): 8218-8226.
[22] Wan J R, Song L, Wu, Y L, Brzoska P, Keys D, Chen C F, Valliyodan B B, Shannon J G, Nguyen H T. Application of digital PCR in the analysis of transgenic soybean plants. Advances in Bioscience and Biotechnology, 2016, 7(10): 403-417.
[23] Ko?ir A B, Spilsberg B, Holst-Jensen A, ?el J, Dobnik D. Development and inter-laboratory assessment of droplet digital PCR assays for multiplex quantification of 15 genetically modified soybean lines. Scientific reports, 2017, 7(1): 8601.
[24] Jiang Y, Yang H, Quan S, Liu Y N, Shen P, Yang L T.Development of certified matrix-based reference material of genetically modified rice event TT51-1 for real-time PCR quantification. Analytical and bioanalytical chemistry, 2015, 407(22): 6731-6739.
[25] Yang Y, Li L, Yang H, Li X Y, Zhang X J, Xu J F, Zhang D B, Jin W J, Yang L T. Development of certified matrix-based reference material as a calibrator for genetically modified rice G6H1 analysis. Journal of agricultural and food chemistry, 2018, 66(14): 3708-3715.
[26] Li J, Li L, Zhang L, Zhang X J, Li X Y, Zhai S S, Gao H F, Li Y J, Wu G, Wu Y H. Development of a certified genomic DNA reference material for detection and quantification of genetically modified rice KMD. Analytical and bioanalytical chemistry, 2020, 412(25): 7007-7016.
[27] Li J, Zhang L, Li L, Li X Y, Zhang X J, Zhai S S, Gao H F, Li Y J, Wu G, Wu Y H. Development of genomic DNA certified reference materials for genetically modified rice Kefeng 6. ACS omega, 2020, 5(34): 21602-21609.
[28] 李俊, 李夏瑩, 李亮, 宋貴文, 沈平, 張麗, 翟杉杉, 柳方方, 吳剛, 張秀杰, 武玉花. 轉基因大豆MON89788 純品粉末標準物質的研制及定值. 農業生物技術學報, 2020, 28(6): 1084-1095.
LI J, LI X Y, LI L, SONG G W, SHEN P, ZHANG L, ZHAI S S, LIU F F, WU G, ZHANG X J, WU Y H. Development and characterization of pure matrix reference materials for detection of transgenic soybean () MON89788. Journal of Agricultural Biotechnology, 2020, 28(6): 1084-1095. (in Chinese)
[29] 李俊, 李夏瑩, 李亮, 宋貴文, 沈平, 張麗, 翟杉杉, 柳方方, 吳剛, 張秀杰, 武玉花. 轉基因玉米MIR604 基體標準物質研制. 作物學報, 2020, 46(4): 473-483.
LI J, LI X Y, LI L, SONG G W, SHEN P, ZHANG L, ZHAI S S, LIU F F, WU G, ZHANG X J, WU Y H. Development of genetically modified maize MIR604 matrix reference materials. Acta Agronomica Sinica, 2020, 46(4): 473-483. (in Chinese)
[30] Nielsen C R, Berdal K G, Holst-Jensen A. Characterization of the integration site and development of an event-specific real-time PCR assay for NK603 maize from a low starting copy number. European Food Research and Technology, 2004, 219(4): 421-427.
[31] Papazova N, Zhang D, Gruden K, Vojvoda J, Yang L T, Ga?pari? M B, Blejec A, Fouilloux S, Loose M, Taverniers I. Evaluation of the reliability of maize reference assays for GMO quantification. Analytical and Bioanalytical Chemistry, 2010, 396(6): 2189-2201.
[32] 楊立桃, 劉信, 張大兵, 沈平, 郭金超, 金蕪軍. 農業部1861號公告-3-2012 轉基因植物及其產品成分檢測玉米內標準基因定性PCR方法.北京: 中國農業出版社, 2012.
YANG L T, LIU X, ZHANG D B, SHEN P, GUO J C, JIN W J. Announcement by the Ministry of Agriculture No.1861-3-2012 Detection of genetically modified plants and derived products Target-taxon-specific qualitative PCR method for Maize. Beijing: China Agriculture Press, 2012. (in Chinese)
[33] Chaouachi M, Bérard A, Sa?d K. Relative quantification in seed GMO analysis: state of art and bottlenecks. Transgenic Research, 2013, 22(3): 461-476.
[34] Holst-Jensen A, De Loose M, Van den Eede G. Coherence between legal requirements and approaches for detection of genetically modified organisms (GMO) and their derived products. Journal of agricultural and food chemistry, 2006, 54(8): 2799-2809.
[35] Demeke T, Eng M. Effect of endogenous reference genes on digital PCR assessment of genetically engineered canola events. Biomolecular Detection and Quantification, 2018, 15: 24-29.
Establishment and application of a duplex ddPCR method to quantify the NK603/copy number ratio in transgenic maize NK603
XIAO Fang1, LI Jun1, WANG Haoqian2, ZHAI Shanshan1, CHEN Ziyan2, GAO Hongfei1, LI Yunjing1, WU Gang1, ZHANG Xiujie2, WU Yuhua1
1Oil Crops Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement Oil Crops Ministry of Agriculture and Rural Affairs, Wuhan 430062;2Development Center of Science and Technology, Ministry of Agriculture and Rural Affairs of People’s Republic of China, Beijing 100025
【Objective】Transgenic maize NK603 approved for import is an important target of genetically modified organism (GMO) regulation in China. The implementation of GMO regulation requires reference materials (RMs) and standardized detection methods. Establishment of a duplex droplet digital PCR (ddPCR) would provide accurate measurement technology for quantification of NK603 event and development of NK603 RMs. 【Method】 A standard plasmid molecule pUC57-NK603 was constructed by DNA synthetic technique; the primer/probe set of NK603 event was combined with different maize reference genes one by one to select reference gene PCR assay with identical amplification ability to NK603 event-specific PCR assay; main reaction parameters, such as annealing temperature and primer/probe concentration,were optimized in the course of establishing duplex ddPCR; the standard plasmid solution was serially diluted to investigate the limit of detection (LOD), limit of quantification (LOQ) and dynamic range of the duplex ddPCR assay; blinded samples with mass fractions of 100%, 10% and 6% were prepared by mixing NK603 powder with non-GM counterpart, to evaluate the accuracy of quantitative results of the duplex ddPCR. 【Result】The reference genewas determined to combine with NK603 event to establish the NK603/duplex ddPCR method with the standard plasmid molecule pUC57-NK603 as a quality control after analyzing the fluorescence amplitude of positive droplets, separation between positive and negative droplets, raindrop number, and consistency between measured copy number ratio and expected copy number ratio of NK603 event to reference gene. The primer/probe concentration was optimized to be 400 nmol·L-1/200 nmol·L-1for both NK603 event andgene, and the annealing temperature was determined to be 60°C. The LOD of NK603/duplex ddPCR was estimated to be 2 copies of DNA template, the LOQ was 48 copies of DNA template, both NK603 assay andassay showed good linearity between measured values and theoretical values over the dynamic range from 10 to 60 000 copies of DNA template. The NK603/duplex ddPCR achieved accurate quantitative results of NK603 content in blind maize samples with less than 25% of coefficient of variation; the quantitative results of ddPCR were not significantly different from those of real-time quantitative PCR (qPCR), moreover, the duplex ddPCR showed an advantage over qPCR in term of precision. 【Conclusion】 The selection of reference genes affects the accuracy of quantitative results by ddPCR. Establishment of ddPCR methods should use samples with accurate GMO content as quality controls to evaluate the applicability of reference genes. The NK603/duplex ddPCR method was successfully established using the synthetic standard plasmid molecule pUC57-NK603 as a quality control. NK603 certified reference materials (CRMs) have been successfully developed in China by applying the established NK603/duplex ddPCR assay to characterize the property values.
transgenic maize NK603; duplex droplet digital PCR; reference plasmid molecule; reference gene; quantification
2021-04-28;
2021-06-16
轉基因生物新品種培育專項(2016ZX08012003)
肖芳,E-mail:xf_hzau@163.com。通信作者張秀杰,E-mail:zhxj7410@sina.com。通信作者武玉花,E-mail:wuyuhua@oilcrops.cn
(責任編輯 李莉)

