葡萄無核基因分子標記的通用性鑒定
陳豆豆,關利平,賀亮亮,宋銀花,章鵬,劉三軍
葡萄無核基因分子標記的通用性鑒定
陳豆豆,關利平,賀亮亮,宋銀花,章鵬,劉三軍
中國農業科學院鄭州果樹研究所,鄭州 450009
【目的】無核是鮮食葡萄的重要農藝性狀,無核基因分子標記的準確性將影響無核葡萄早期選擇的效果。本研究對前人開發的5個葡萄無核基因分子標記在183份葡萄材料中進行通用性鑒定,旨在明確各個分子標記的適用范圍,為利用分子標記輔助無核葡萄育種提供參考依據。【方法】以96個葡萄品種(其中無核63個,有核33個)及‘紅地球’ב黎明無核’87個F1單株(其中無核61株,有核26株)的葉片DNA為模板,利用已報道的5個葡萄無核基因分子標記(SCF27-2000、GSLP1-569、VMC7f2、p3_VvAGL11和5U_VviAGL11)的引物進行PCR擴增,采用1.5%瓊脂糖凝膠電泳、毛細管電泳和8%聚丙烯酰胺凝膠電泳技術檢測PCR產物,分析各個樣品的無核特異條帶,鑒定5個分子標記的準確率。【結果】SCAR標記GSLP1-569對96個葡萄品種的檢測準確率為40.6%,無核檢測率為63.6%。SCAR標記SCF27-2000對96個葡萄品種及87個F1雜交單株的檢測準確率分別為71.9%和76.54%,無核檢測率分別為70.5%和78.5%。SSR標記VMC7f2在96個葡萄品種中鑒定出8個等位基因,經卡方檢驗,189-bp等位基因與葡萄無核性狀顯著關聯,其檢測準確率為85.4%,無核檢測率為85.5%。SSR標記p3_VvAGL11在96個葡萄品種中鑒定出7個等位基因,經卡方檢驗,187-bp等位基因與葡萄無核性狀顯著關聯,其檢測準確率為89.6%,無核檢測率為90.7%,在F1雜交單株中其鑒定準確率為87.65%,無核檢測率為91.1%,假陽性率為6.17%,假陰性率為6.17%。SSR標記5U_VviAGL11在96個葡萄品種中鑒定出17個等位基因,經卡方檢驗,306-bp等位基因與葡萄無核性狀顯著關聯,其鑒定準確率為88.5%,無核檢測率為90.6%,在F1雜交單株中檢測準確率為88.89%,無核檢測率為92.7%,假陽性率為4.94%,假陰性率為6.17%。【結論】SSR標記p3_VvAGL11和5U_VviAGL11在葡萄種質及遺傳群體中無核分型的準確性及無核檢測的效率較高,適用范圍較廣,在無核基因分子標記輔助選擇中可以考慮優先使用。
葡萄;無核性;分子標記;通用性;鑒定
0 引言
【研究意義】無核葡萄是全世界葡萄育種的主要目標之一。由于葡萄童期較長,而無核表型只能在成年葡萄植株中篩選,且無核遺傳機制尚不清楚,造成無核葡萄的育種進程很慢[1]。DNA標記技術為植物育種提供了廣闊的應用前景,通過標記輔助選擇(marker assisted-selection,MAS)可以提高植物育種的效率和精度[2],因此,篩選準確性高、通用性廣的無核基因分子標記對于無核葡萄育種具有重要的意義。【前人研究進展】關于葡萄無核性狀遺傳規律,前人先后提出了多種假說[3-7]。目前普遍認為,種子敗育無核性遺傳主要由顯性位點(seed development inhibitor,種子發育抑制)調控,位于18號染色體,調控3個獨立互補的隱性基因[7-9]。Mejía等[1]提出與位點接近的基因()是葡萄無核的主要功能候選基因,它屬于D類MADS-box基因,參與胚珠的發育。這一點在ROYO等[10]的研究中得到證實,即種子形態調節基因中,導致Arg-197-Leu替代的點突變與種子敗育完全相關。目前,基于葡萄無核主要位點尤其是無核基因開發了一系列分子標記,主要包括序列特征擴增區(sequence characterized amplified region,SCAR)[9,11-12]及簡單重復序列(simple sequence repeats,SSR)兩種標記類型[1,8,13-16]。SCAR標記是用特異引物進行擴增,操作簡單,成本較低,結果穩定性好。前人通過集群分離分析法(bulk segregant analysis,BSA)開發了與位點連鎖不平衡(linkage disequilibrium,LD)的SCAR標記SCC8-1080[9]、SCF27-2000[11]和GSLP1-569[12]。SCF27-2000與無核×無核(‘Ruby Seedless’בSultanina’)后代的無核性狀高度相關(81%)[11],GSLP1-569標記也已被廣泛用于分析無核性狀[17-19]。但相關研究表明,GSLP1-569適合于對‘無核白’及其親緣關系較近的無核品種的分子檢測[17-18]。這些標記可以幫助預測無核后代,但也會因偶然出現的零等位基因或標記與位點之間的不完全連鎖影響其預測能力[20]。SSR標記是以特異引物PCR為基礎的分子標記技術,是一類由幾個核苷酸為重復單位組成的串聯重復序列,因其具有高多態性、多等位基因、共顯性遺傳等優勢而被廣泛應用[21]。SSR標記VMC7f2和p3_VvAGL11被認為是無核性狀早期選擇的良好候選標記[1,22]。VMC7f2標記位于所預測的ORF上游463 bp[1],QTL(quantitative trait locus)關聯分析表明VMC7f2標記的198-bp等位基因與無核性狀顯著關聯,可作為選擇無核基因型的潛在標記[13,22]。但在不同遺傳背景下對VMC7f2進行驗證,其有效性會發生顯著變化[1,15,23-24]。p3_VvAGL11是位于基因啟動子區的特異性標記[1]。對p3_VvAGL11在不同遺傳背景下的測試結果表明,僅出現極低的假陽性率(1.68%)且沒有出現假陰性[2]。BENNICI等[25]的研究也表明最有效的標記是VMC7f2和p3_VvAGL11。OCAREZ等[16]在簡單重復序列p3_VvAGL11的同一區域開發出新的SSR標記5U_VviAGL11,信息更豐富,更可靠。VMC7f2、p3_VvAGL11和5U_VviAGL11與位點的高度連鎖不平衡,使它們成為無核標記輔助選擇的主要候選標記,但也需要在其他遺傳背景中進行驗證。【本研究切入點】基于遺傳圖譜和BSA等方法開發的這5個無核基因分子標記,在不同遺傳背景的鑒定效率尚不明晰,因此,需要對它們的通用性做進一步的鑒定。【擬解決的關鍵問題】本研究基于前人已開發的準確性較高的5個無核基因分子標記,通過在183份葡萄材料中進行通用性鑒定,旨在理清它們的適用范圍及準確性,從中篩選出鑒定準確率高且檢測方法簡單的分子標記,為分子標記輔助無核葡萄育種提供技術支持。
1 材料與方法
試驗于2019—2020年在中國農業科學院鄭州果樹研究所進行。
1.1 材料
試驗材料共183份,包括96個葡萄品種(其中無核63個,有核33個,電子附表1),保存于中國農業科學院鄭州果樹研究所國家葡萄種質資源圃,87個F1(‘紅地球’ב黎明無核’)雜交單株(表1)保存于中國農業科學院鄭州果樹研究所尉氏基地。
1.2 葡萄DNA提取
取183份葡萄材料的健康幼嫩葉片,液氮研磨,采用CTAB植物基因組DNA快速提取試劑盒(北京艾德萊生物科技有限公司)提取葉片基因組DNA。利用1%瓊脂糖凝膠電泳和NanoDrop 1000 spectrophotometer(Themo Scientific)紫外分光光度計檢測DNA濃度和純度,然后將DNA濃度稀釋到工作液濃度(約10 ng·μL-1),保存于-20℃,用于后續的PCR擴增。
1.3 選擇的無核分子標記及PCR擴增條件
選用5個已報道的與葡萄無核性狀相關的分子標記(表2),對183份試材進行標記驗證。引物由生工生物工程(上海)股份有限公司合成,含有FAM和HEX兩種熒光探針的SSR引物由北京閱微基因技術有限公司合成。
本試驗在參考文獻的基礎上,對PCR反應體系進行優化。SCAR標記SCF27-2000及GSLP1-569的PCR反應體系20 μL:2×Taq Master Mix 10 μL,正、反向引物各1 μL(10 μmol·L-1),2 μL DNA模板(10 ng·μL-1),ddH2O補至20 μL。反應程序:94℃預變性5 min;94℃變性30 s,適宜Tm值退火30 s,72℃延伸2 min,35個循環;72℃延伸5 min,擴增產物4℃保存。
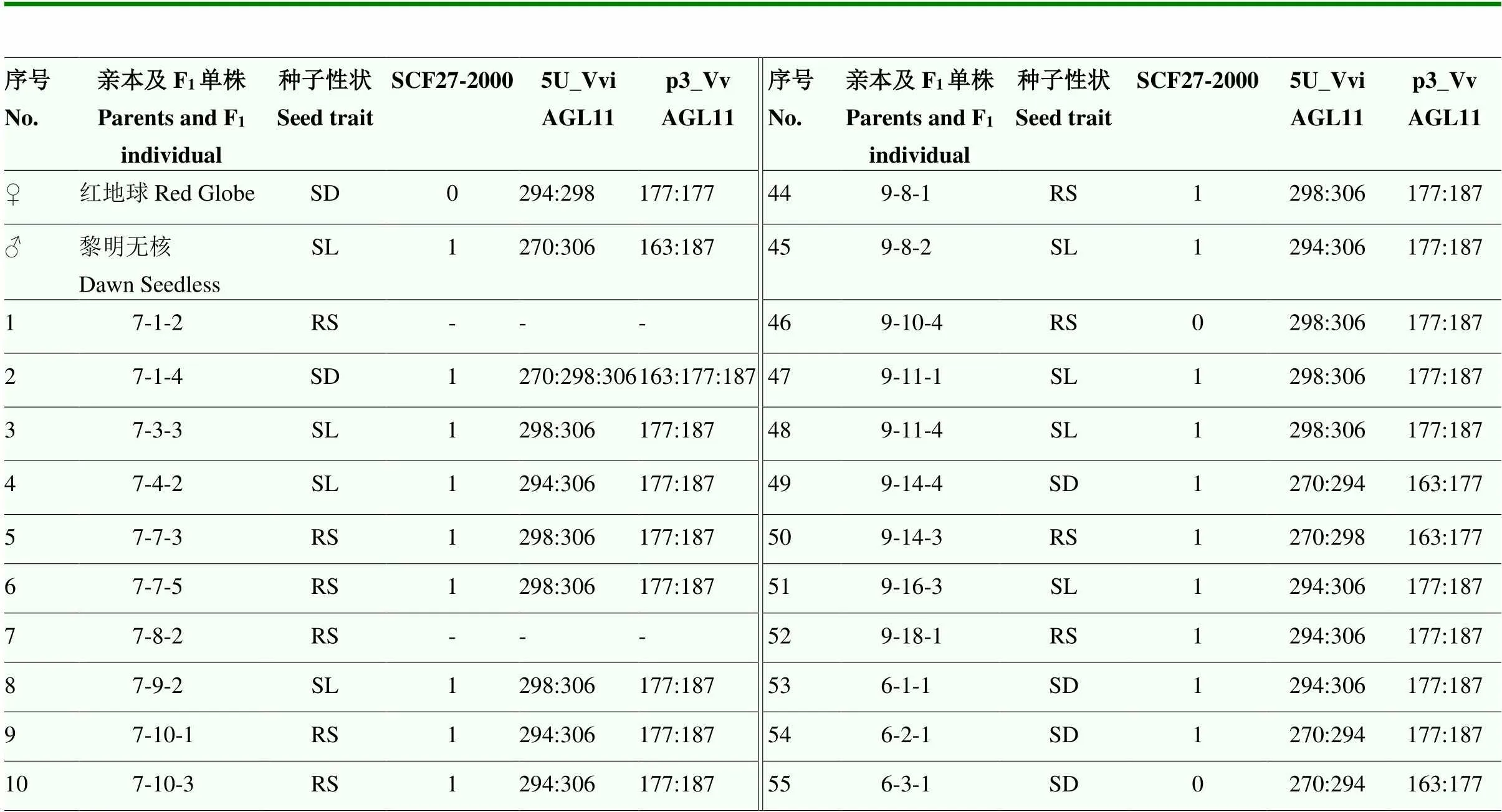
表1 ‘紅地球’ב黎明無核’F1代雜交單株的表型鑒定
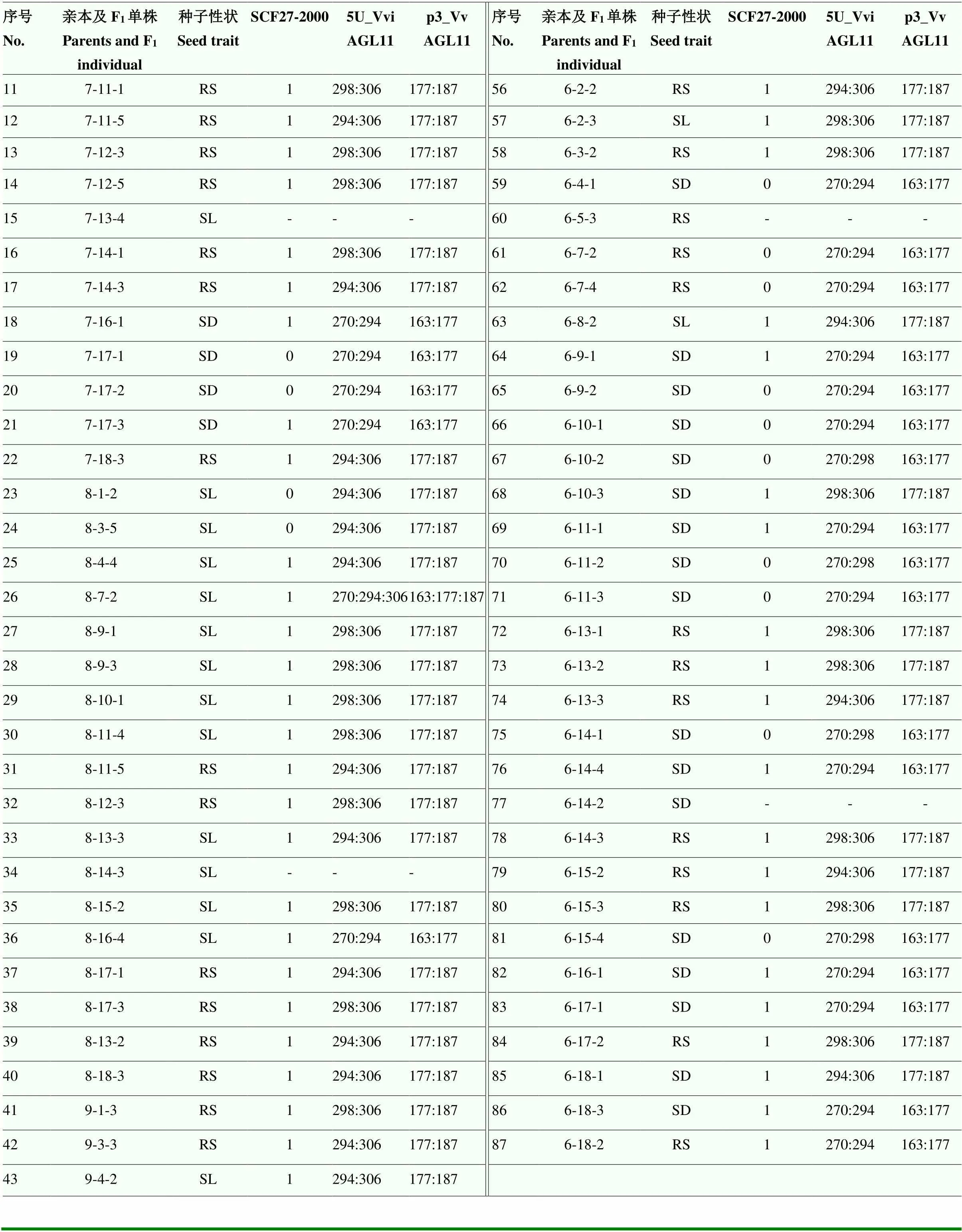
續表1 Continued table 1
SL:無核,即成熟漿果中無種子或僅有不明顯的種痕;RS:殘核,即成熟漿果中殘核較明顯,但種皮未木質化;SD:有核,即成熟漿果中的種子完全發育。其中6個子代因樣品質量不佳無擴增條帶,不予計數
SL: Seedless , there are no seeds or only imperceptible trace; RS: Rudimental seed, there are perceptible seed traces in the ripe berries, but seed coat is not lignified; SD: Seeded, the seeds in the ripe berries are fully developed. Six of the hybrids were not counted due to the poor quality of samples resulting in no amplification bands

表2 分子標記對應引物名稱及信息
SSR標記的PCR反應體系10 μL:2×Taq Master Mix for PAGE 5 μL,正、反向引物各0.5 μL(10 μmol·L-1),2 μL DNA模板(10 ng·μL-1),ddH2O補至10 μL。反應程序:94℃預變性3 min;94℃變性30 s,適宜Tm值退火30 s,72℃延伸40 s,29個循環;72℃延伸5 min,擴增產物4℃保存。具體退火溫度根據引物設計進行篩選。
1.4 PCR產物檢測
SCAR標記SCF27-2000及GSLP1-569的PCR產物采用1.5%瓊脂糖凝膠電泳25—30 min(恒壓150 V),使用UV凝膠成像儀拍照記錄。SSR標記的擴增產物采用熒光毛細管電泳及8%聚丙烯酰胺凝膠(PAGE)電泳進行雙驗證。
1.5 數據處理
根據VIHINEN[26]和BALDI等[27]計算5項指標:真陽性(true positive,TP)、真陰性(true negative,TN)、假陽性(false positive,FP)、假陰性(false negative,FN)、準確率(accuracy)。再根據馬亞茹等[15]的方法計算無核檢測率。假陽性即樣本攜帶無核等位基因,不表達無核表型;而假陰性即不攜帶無核等位基因,但表達無核表型。準確率=(TP+TN)/(TP+FP+TN+FN),無核檢測率=TP/(TP+FP)。為評估表型與分子數據之間的關聯,利用軟件SPSS 23.0對表型與SSR標記的等位基因及基因型之間進行卡方(χ2)獨立性檢驗(<0.05)。
2 結果
2.1 SSR標記的PCR體系優化
利用4個無核葡萄品種(‘紅寶石無核’‘黎明無核’‘瑞峰無核’‘中葡萄18號’)和4個有核葡萄品種(‘摩爾多瓦’‘紅地球’‘玫瑰香’‘先鋒’),對SSR標記(p3_VvAGL11、VMC7f2、5U_VviAGL11)進行PCR反應體系優化。如圖1-A所示,標記p3_VvAGL11的最適退火溫度在58℃時,不同品種的擴增產物表現多態性;如圖1-B所示,標記5U_VviAGL11的退火溫度在60℃時,得到清晰的多態性條帶;如圖1-C,標記VMC7f2的最適退火溫度為61℃,擴增產物表現出清晰的多態性條帶。
2.2 分子標記在96個葡萄品種中的通用性驗證
2.2.1 SCAR標記GSLP1-569和SCF27-2000的通用性 在96個葡萄品種(其中無核63個,有核33個)中驗證無核標記GSLP1-569和SCF27-2000的通用性。結果顯示,GSLP1-569分別在14個無核品種與8個有核品種中擴增出569 bp的無核特異片段,而SCF27-2000分別在62個無核品種與26個有核品種中擴增出2 000 bp的無核特異片段。經統計,分子標記GSLP1-569和SCF27-2000在96個葡萄品種間的鑒定準確率分別為40.6%和71.9%,無核檢測率分別為63.6%和70.5%(圖2、圖3)。由GSLP1-569無核標記檢測出的14個無核品種包括‘鞏義無核白’‘白無核’‘布朗無核’‘長穗無核白’‘火焰無核’‘美麗無核’‘寧夏無核白’‘無核白-阿富汗’‘早無核白’‘無核白’‘夏日陽光’‘鄭艷無核’‘黑愛默無核’‘波爾萊特’,其中11個由‘無核白’衍生而來(附表1、圖2)。除體細胞變異品種‘瑞鋒無核’外,SCF27-2000可以準確鑒定98.4%的無核品種,表明其在無核×無核的適用范圍更廣(圖3)。
2.2.2 SSR標記的鑒定結果 在96個葡萄品種中驗證3個SSR標記的通用性。結果表明,分子標記p3_VvAGL11檢測到8個等位基因,分別為163、165、173、177、179、181、185、187;VMC7f2標記檢測到7個等位基因,分別為187、189、191、193、195、197、201;5U_VviAGL11標記檢測到17個等位基因,分別為260、262、266、270、272、278、280、282、288、294、296、298、302、304、306、308、312(表3)。在p3_VvAGL11標記檢測到的等位基因中,187-bp(χ2=65.333,=6.32E-16)和177-bp(χ2=8.637,=0.003)與種子表型顯著關聯,在63個無核(-)品種中,存在187-bp且表現為無核表型的個體有93.7%,存在187-bp的個體中90.7%表現為無核表型,表明187-bp與無核性狀最相關;在33個有核(+)品種中,存在177-bp且表現為有核的個體占87.9%,表明177-bp與有核性狀關聯(表3)。分子標記p3_VvAGL11檢測到13種基因型,其中177/187(χ2=46.061,=1.15E-11)、187/187(χ2=7.265,=0.007)和177/177(χ2=9.872,=0.002)與種子表型之間存在顯著關聯。基因型177/187在91.8%的無核和8.2%的有核個體中被檢測到;187/187在100%的無核個體中被檢測到,且在有核個體中缺失;177/177在84.2%有核和15.8%的無核植株中被檢測到(表4)。由此可知,基因型177/187和187/187與無核性狀顯著相關,而177/177與有核性狀顯著相關。總體上,在具有分子標記p3_VvAGL11的強連鎖不平衡中,等位基因187-bp的存在導致了無核表型,在96個葡萄品種中的鑒定準確率達89.6%,無核檢測率為90.7%。

A:p3_VvAGL11標記在退火溫度58℃;B:5U_VviAGL11標記在退火溫度60℃;C:VMC7f2標記在退火溫度61℃
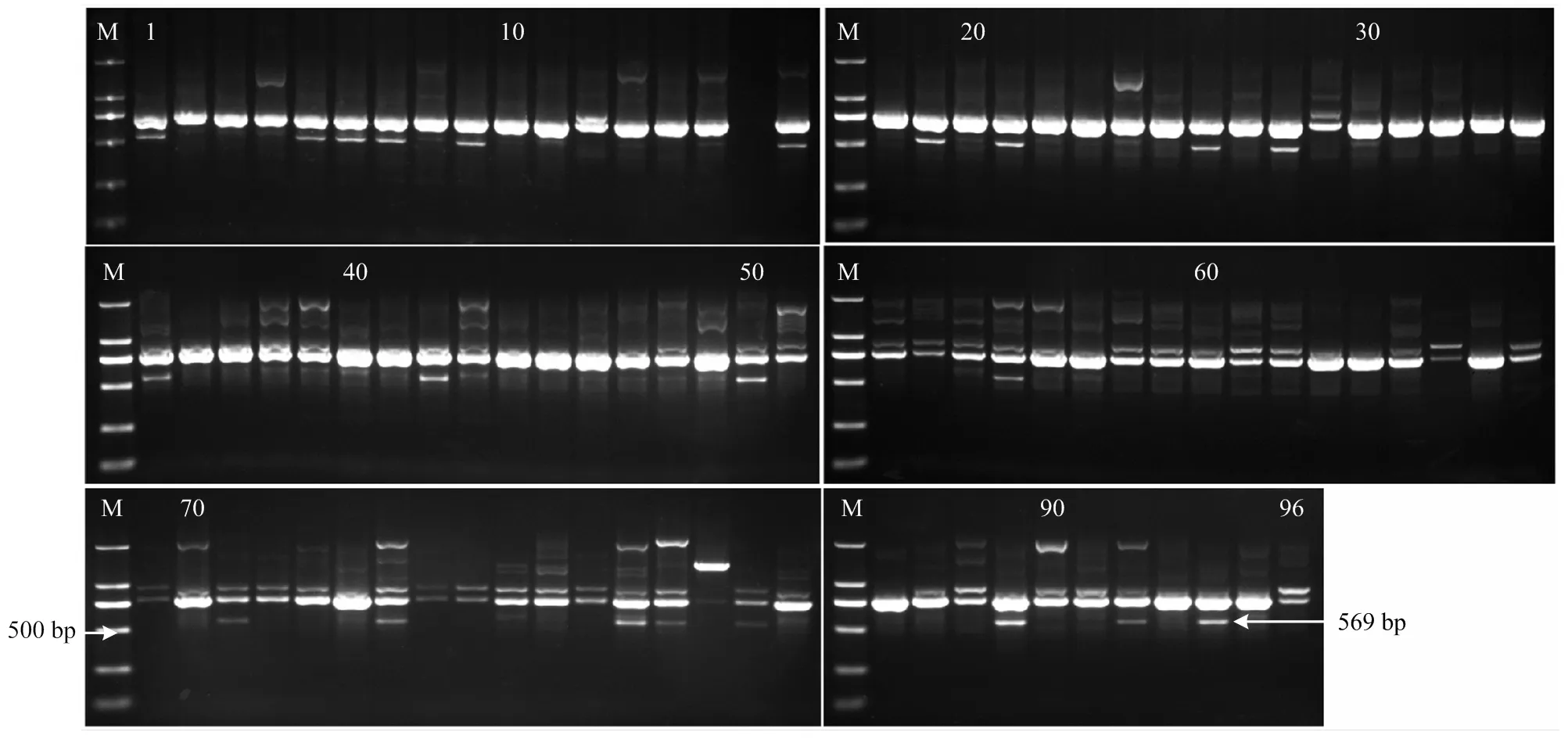
圖2 SCAR標記GSLP1-569對96個葡萄品種的驗證
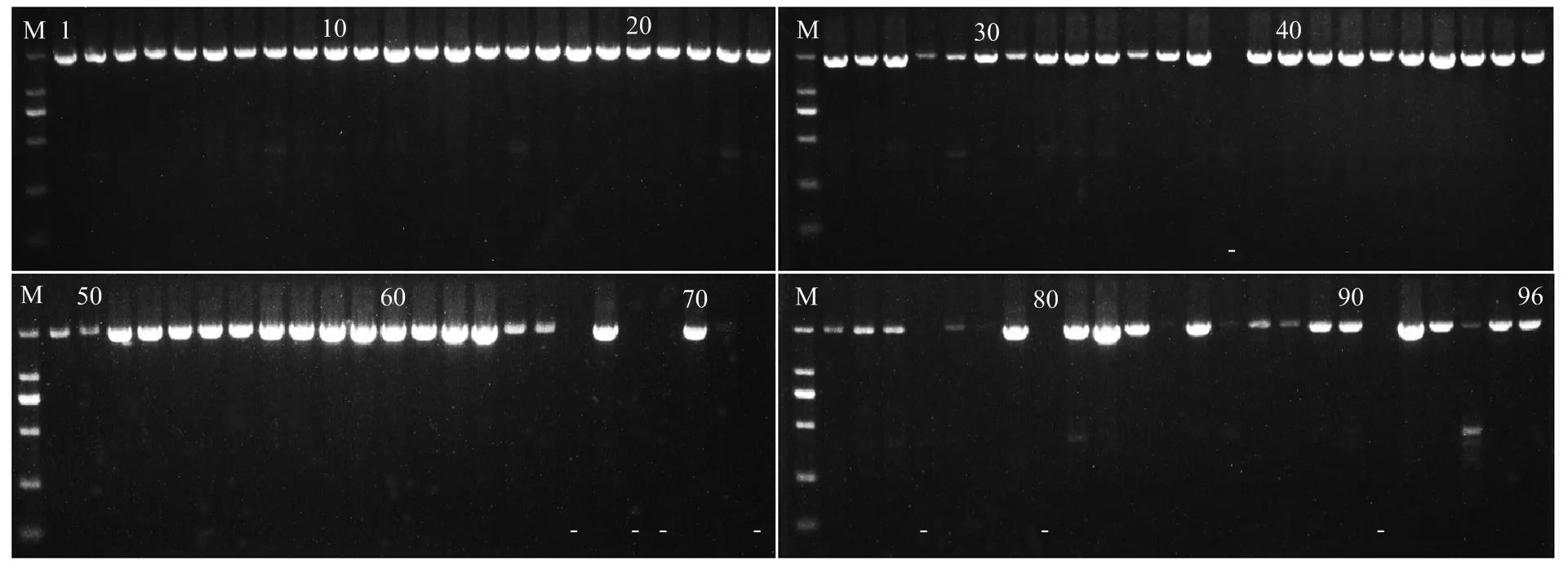
圖3 SCAR標記SCF27-2000對96個葡萄品種的驗證
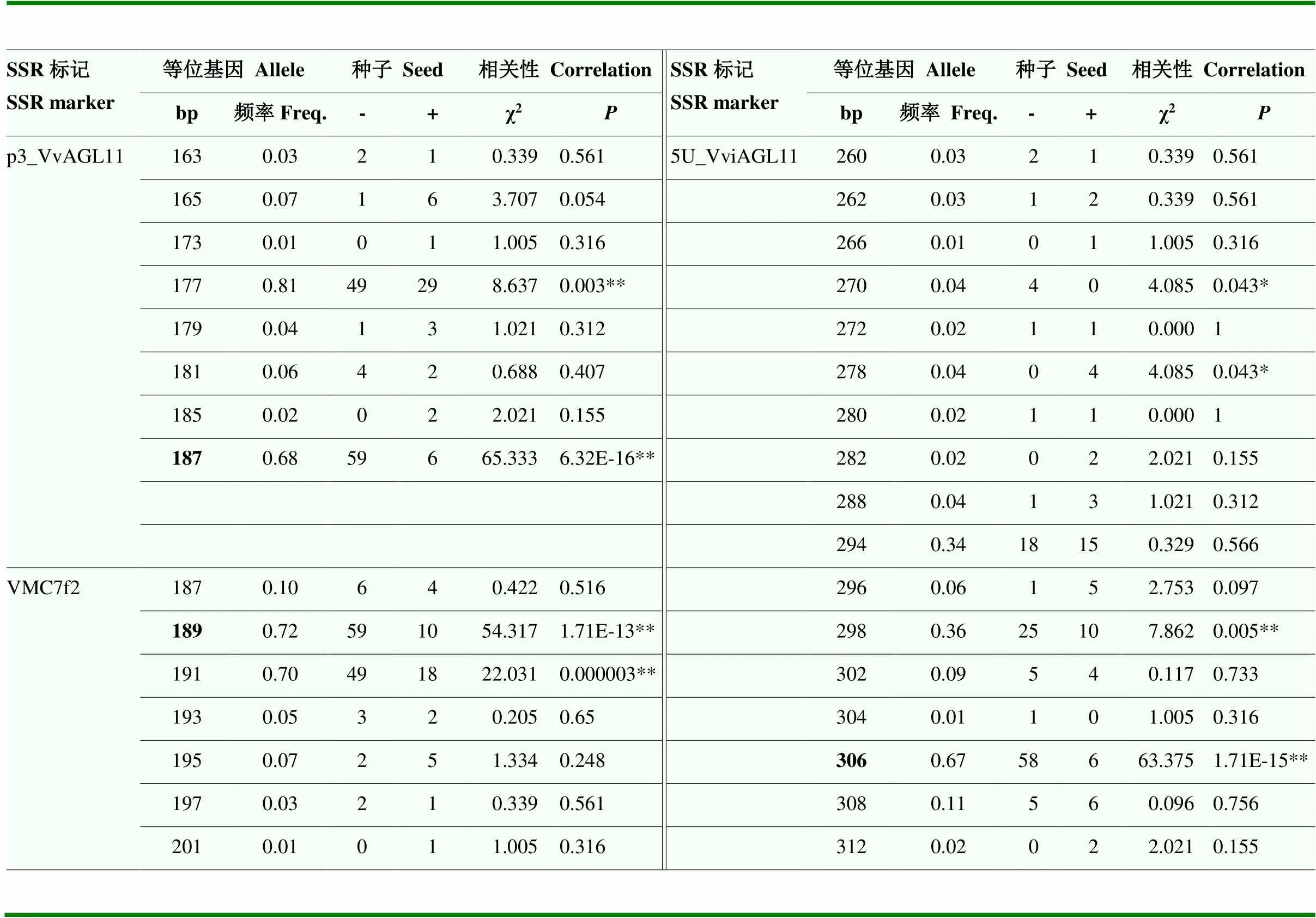
表3 微衛星等位基因分布與所收集葡萄品種中無核的相關性
與無核等位基因關聯的微衛星等位基因用粗體表示。*顯著相關(<0.05),**極顯著相關(<0.01)。下同
Microsatellite alleles linked to the seedlessallele in cultivar Sultanina are indicated in bold. *Significant correlation (<0.05), ** Extremely significant correlation (<0.01). The same as below
在VMC7f2標記的等位基因中,189-bp(χ2= 54.317,=1.71E-13)和191-bp(χ2=22.031,=0.0000)與種子表型顯著關聯,存在189-bp且表現為無核表型的個體占無核品種的93.7%,存在189-bp的個體中85.5%為無核品種,表明189-bp與無核性狀關聯最顯著(表3)。分子標記VMC7f2檢測到14種基因型,其中基因型187/189(χ2=4.085,=0.043)、189/191(χ2=52.092,=5.30E-13)、191/191(χ2=9.984,=0.0016)和195/195(χ2=4.085,=0.043)與種子表型顯著關聯(表4)。187/189在100%無核個體中被檢測到,在有核品種中缺失;189/191在95.7%的無核個體和4.3%的有核個體中被檢測到;191/191在92.3%的有核個體和7.7%的無核個體中被檢測到;195/195在100%的有核個體中被檢測到,但等位基因195-bp中與種子表型無相關性(表3、表4)。由此可知,基因型187/189和189/191與無核性狀顯著相關,而191/191與有核性狀顯著相關。總體上,在具有分子標記VMC7f2的強連鎖不平衡中,等位基因189-bp的存在導致了無核表型,而191-bp可能與有核性狀相關,在96個葡萄品種中其鑒定準確率為85.4%,無核檢測率為85.5%。

表4 微衛星基因型分布與所收集品種中無核的相關性
在5U_VviAGL11標記檢測的等位基因中,270-bp(χ2=4.085,=0.043)、278-bp(χ2=4.085,=0.043)、298-bp(χ2=7.005,=0.008)和306-bp(χ2=63.375,=1.71E-15)與種子表型顯著相關(表3)。雖然等位基因270-bp和298-bp與無核性狀關聯,但由于只存在于少數無核品種中,不是最相關的無核等位基因;存在278-bp的個體100%為有核品種,表明其與有核性狀關聯;存在306-bp且表現為無核表型的個體占無核品種的92.1%,存在306-bp的個體中有90.6%為無核品種,表明等位基因306-bp與無核性狀關聯最顯著。分子標記5U_VviAGL11檢測到35種基因型,其中基因型294/306(χ2=14.521,=0.0001)、298/306(χ2=23.048,=0.000002)、270/306(χ2=4.085,=0.043)和306/308(χ2=4.085,=0.043)與種子表型顯著關聯。基因型294/306存在于94.1%的無核個體中;298/306存在于95.8%的無核個體中;270/306和306/308也存在于全部無核個體中(表4),由此可知,這4種基因型均與無核性狀關聯,其中基因型294/306和298/306與無核性狀關聯極顯著。總體上,在具有分子標記5U_VviAGL11的強連鎖不平衡中,等位基因306-bp的存在導致了無核表型,在96個葡萄品種中其鑒定準確率為88.5%,無核檢測率為90.6%。
綜上所述,分子標記p3_VvAGL11、VMC7f2和5U_VviAGL11可以分別利用其無核等位基因187-bp、189-bp和306-bp的存在與否對雜交群體進行分子標記輔助育種。
2.3 F1代的驗證分析
通過分析上述5個分子標記在96個葡萄品種中的通用性和準確率,進一步利用SCAR標記SCF27-2000及SSR標記p3_VvAGL11、5U_VviAGL11對‘紅地球’ב黎明無核’的F1雜交單株進行鑒定。F1代中有效的無核表型(SL)21個,殘核表型(RS)35個,有核表型(SD)25個(表1)。
SCF27-2000對F1代的鑒定結果(表5)顯示,在90.48%的SL和91.43%的RS單株中檢測到該標記,而在SD個體中擴增的相對頻率(假陽性)下降到17.28%。存在2000-bp且表現為RS或SL表型的單株有78.5%(χ2=13.419,=0.0012),在F1雜交單株中,該標記的鑒定準確率為76.54%,假陰性率為6.17%。
SSR標記p3_VvAGL11在F1代的鑒定結果(表6)表明,等位基因187-bp與SL性狀顯著關聯(χ2= 41.188,=1.14E-9),177-bp與SD性狀有關,是從‘紅地球’遺傳的。無核等位基因187-bp在95.24%的SL和88.57%的RS植株中被檢測到。存在187-bp且表現為RS或SL表型的雜交單株占91.1%。在F1雜交單株中,該標記的鑒定準確率為87.65%,假陽性、假陰性率分別為6.17%、6.17%。F1代中形成3種基因型,其中基因型163:177中有80%為SD性狀,177:187和163:177:187中有91.1%為RS或SL性狀,由此可知,無核等位基因187-bp為顯性基因,符合位點的顯性遺傳模型。
SSR標記5U_VviAGL11對F1代的鑒定結果(表7)表明,等位基因306-bp與無核性狀顯著關聯(χ2=44.959,=1.73E-10),306-bp分別存在于95.24%的SL和88.57%的RS植株中。存在306-bp且表現為RS或SL表型的雜交單株占92.7%。該標記的準確率為88.89%,假陽性、假陰性率分別為4.94%、6.17%。
此外,3個標記對No.61(RS)、No.62(RS)的鑒定結果一致,兩個樣品均不存在無核標記。綜上,利用3個分子標記對‘紅地球’ב黎明無核’的F1雜交單株鑒定時,5U_VviAGL11與p3_VvAGL11的準確率及無核檢測率較高,且都有較低的假陽性和假陰性率,鑒定結果基本一致,因此均可用于無核葡萄育種的分子標記輔助育種。
3 討論
葡萄是一種基因型高度雜合的多年生果樹,童期較長,育種速度慢。尤其對于無核表型的篩選,通過傳統手段只能等到植株成年才能進行選育,而利用分子標記對幼苗進行早期驗證可以提高育種效率,加快育種進程。其中,選擇適用且準確率高的分子標記是有效進行分子標記輔助育種的關鍵。前人利用BSA、基因組測序、QTL關聯分析等方法先后開發了與無核主要位點連鎖的分子標記[1,8,9,11-16,22,28-29]。由于每個分子標記開發的遺傳背景不同,其鑒定準確率及通用性無法進行比較,且可操作性有差異,因此本試驗選擇其中5個與位點連鎖緊密的分子標記在183份材料中進行鑒定。
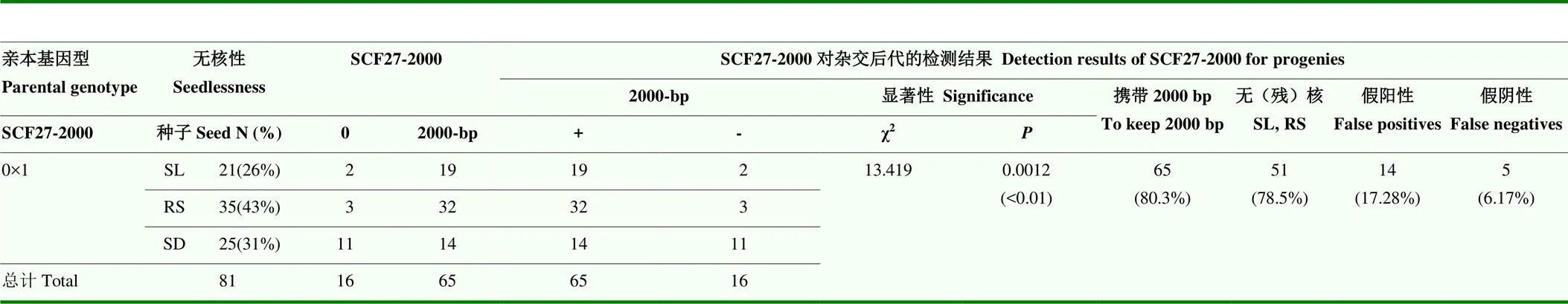
表5 SCAR標記SCF27-2000對‘紅地球’ב黎明無核’雜交后代的檢測結果

表6 SSR標記p3_VvAGL11對‘紅地球’ב黎明無核’雜交后代的檢測結果
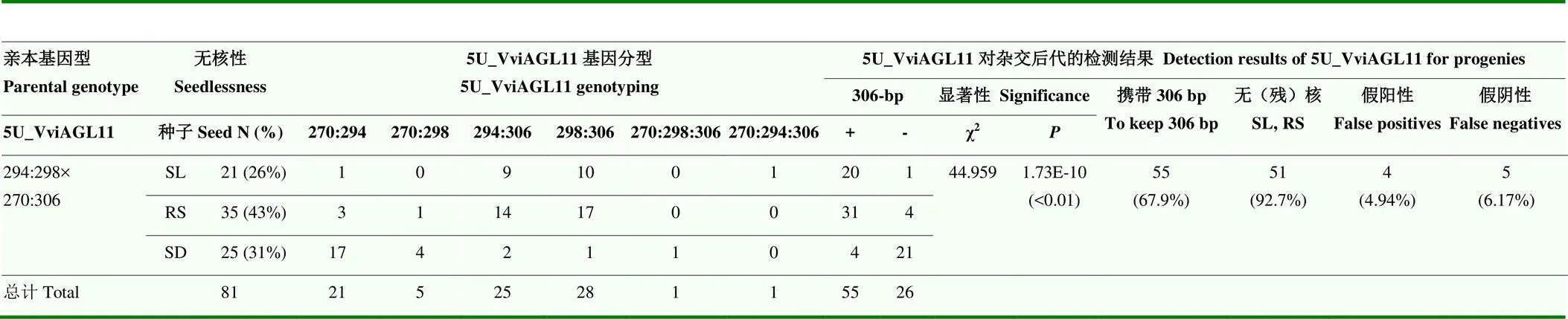
表7 SSR標記5U_VviAGL11對‘紅地球’ב黎明無核’雜交后代的檢測結果
圖4 SSR標記p3_VvAGL11對‘紅地球’ב黎明無核’雜交后代的檢測
Fig. 4 Detection of SSR marker p3_Vv for the progenies of Red Globe × Dawn Seedless
3.1 分子標記在葡萄品種中的鑒定
屈田田等[30]和LI等[17]研究發現,SCAR標記GSLP1-569在檢測‘無核白’的后代時顯示出更高的準確性。本研究中,GSLP1-569檢測出的14個無核品種中有11個品種均由‘無核白’衍生而來,表明GSLP1-569更適合對‘無核白’及其親緣關系較近的無核品種進行無核鑒定,這與前人研究結果類似。對于SCAR標記SCF27-2000,AKKURT等[24]研究發現該標記更適于無核×無核雜交后代中的無核性狀鑒定,LI等[17]的研究證實了這一點。在本研究中,SCF27-2000在無核品種中的鑒定準確率高達98.4%,進一步印證了前人的觀點。CABEZAS等[22]利用QTL定位到與葡萄無核性狀緊密連鎖的SSR標記VMC7f2,且檢測到198-bp等位點與無核表型顯著關聯,與MEJIA等[31]的研究結果相似。BENNICI等[25]的研究也表明,VMC7f2的198-bp與無核性相關,200-bp等位點與有核表型相關。本研究中,用VMC7f2在96個品種中檢測到189-bp與無核性狀顯著關聯,191-bp與有核表型相關,但與前人擴增片段長度有所偏差,因此在后期結果比對時需要加上標準樣品,以避免儀器誤差。分子標記座位與目標基因座位之間的遺傳距離決定了分子標記輔助選擇的準確率。前人研究[8,22,31]表明SSR標記VMC7f2為最接近位點的分子標記。本研究中,與SCAR標記GSLP1-569和SCF27-2000相比,VMC7f2在96個品種間鑒定的準確率(85.4%)及無核檢測率(85.5%)均較高,說明VMC7f2更接近位點。在基因的啟動子區域開發了與位點高度連鎖不平衡的分子標記p3_VvAGL11,該標記鑒定的表型—基因型間有很高的一致性[2],使它成為無核分子標記輔助育種的主要候選標記之一。OCAREZ等[16]研究發現p3_VvAGL11的等位點194-bp與無核表型顯著關聯。本研究中,檢測到187-bp與無核性狀顯著相關,且其鑒定的準確率(89.6%)及無核檢測率(90.7%)較高。另有研究表明[25],p3_VvAGL11對于‘Melissa’‘Crimson Seedless’‘Sugraeighteen’‘Early Gold’‘Sugrathirteen’及‘Pink Muscat’均表現出較好的預測能力。本研究用p3_VvAGL11對葡萄材料的檢測準確率為89.6%,這與前人的結果相一致,也表明了p3_VvAGL11的通用性強。與p3_VvAGL11相似,5U_VviAGL11標記也位于基因的啟動子區域,其等位點306-bp與無核性狀極顯著相關,雖然本研究中也觀察到270-bp和298-bp與無核相關,但這可能是假基因型效應,由于攜帶270-bp的4個無核品種,也都攜帶無核等位點306-bp;攜帶298-bp的25個無核品種有23個均攜帶306-bp。OCAREZ等[16]在209個葡萄品種中進行分子標記5U_VviAGL11的驗證,發現其準確性為0.953,陽性預測值為0.836,陰性預測值為1.0,表現出較低的假陽性。同樣,在本研究中,5U_VviAGL11在96個葡萄品種的無核鑒定中準確率為88.5%,無核檢測率為90.6%,也表明該標記的通用性強。綜上,標記p3_VvAGL11和5U_VviAGL11位于基因的啟動子區域,推薦為首選的無核性鑒定標記。分子標記p3_VvAGL11和5U_VviAGL11在96個葡萄品種檢測中具有有效性,證實了無核性狀與之間密切關聯,這2個標記在無核育種中有潛在的應用價值。另外,對于體細胞突變品種—‘瑞峰無核’,5個無核分子標記均不能鑒定出來,這與KARAAGAC等[23]關于體細胞突變無核品種‘chasselas apyrene’的研究結果一致,推測體細胞突變導致的無核與‘無核白’的無核性機理可能不同,那么開發分子標記區分體細胞突變體與親本無性系也將是今后的一個研究方向。
3.2 分子標記在雜交后代中的鑒定
由于分子標記為遺傳標記,所以對雜交群體進行MAS時,要基于父母本的基因型,選擇適用的分子標記。本研究中,雜交組合的無核親本‘黎明無核’中不存在分子標記GSLP1-569,因此該標記不適于對供試的雜交組合F1代檢測。SSR標記VMC7f2在‘黎明無核’(189:197)中雖然有無核等位基因189-bp,且與‘紅地球’(191:191)間具有多態性,但等位基因189-bp和191-bp所對應的帶型相距太近,采用聚丙烯酰胺凝膠電泳時不易區分。所以本試驗利用分子標記SCF27-2000、p3_VvAGL11和5U_VviAGL11對F1雜交單株進行無核性狀檢測,重點評估其預測能力。
BENNICI等[25]的研究表明分子標記SCF27-2000表現出較高的假陽性(17.4%),在本研究中,SCF27-2000也顯示出較高的假陽性率(17.28%),與前人研究結果類似。有研究發現[21],SCF27-2000分子標記在無核性鑒定中表現出較低的準確率,是由于在供試樣品中出現零等位基因,且該分子標記與位點之間不完全連鎖。另外,本研究利用F1雜交單株進一步證實p3_VvAGL11的187-bp和5U_VviAGL11的306-bp等位基因與無核性狀顯著關聯。本研究中,p3_VvAGL11在F1雜交群體的無核性鑒定表現出較低的假陽性率(6.17%),這與OCAREZ等[16]在571個F1代和BERGAMINI等[2]在475個基因型進行無核性鑒定的結果一致。BENNICI等[25]在97個F1基因型的鑒定結果表明,分子標記p3_VvAGL11的無核性預測能力最強,是最有效的無核分子標記。本研究利用p3_VvAGL11進行無核性鑒定時,出現的假陽性率較低,鑒定的準確率及無核檢測率高,說明p3_VvAGL11是良好的無核基因候選標記。此外,利用5U_VviAGL11對F1雜交單株進行無核性鑒定,該標記的準確率為88.89%,與p3_VvAGL11標記基本一致,前者的假陽性率略低于后者。總體而言,通過對雜交群體的無核性鑒定,發現分子標記p3_VvAGL11和5U_VviAGL11的無核鑒定準確率較高,且采用傳統的電泳方法即可實現對這兩個標記的檢測,便于操作,成本低,是可靠的無核基因分子標記。
4 結論
SSR標記p3_VvAGL11的187-bp、5U_VviAGL11的306-bp以及VMC7f2的189-bp與無核性狀顯 著相關。以p3_VvAGL11和5U_VviAGL11的準確率和無核檢測率高,假陽/假陰性率低,且應用成本低,是可靠的無核分子標記,可應用于無核葡萄育種。
附表1 96個葡萄品種的信息
Supplementary Table 1 The information of 96 grape cultivars
續附表1 Continued supplementary table 1
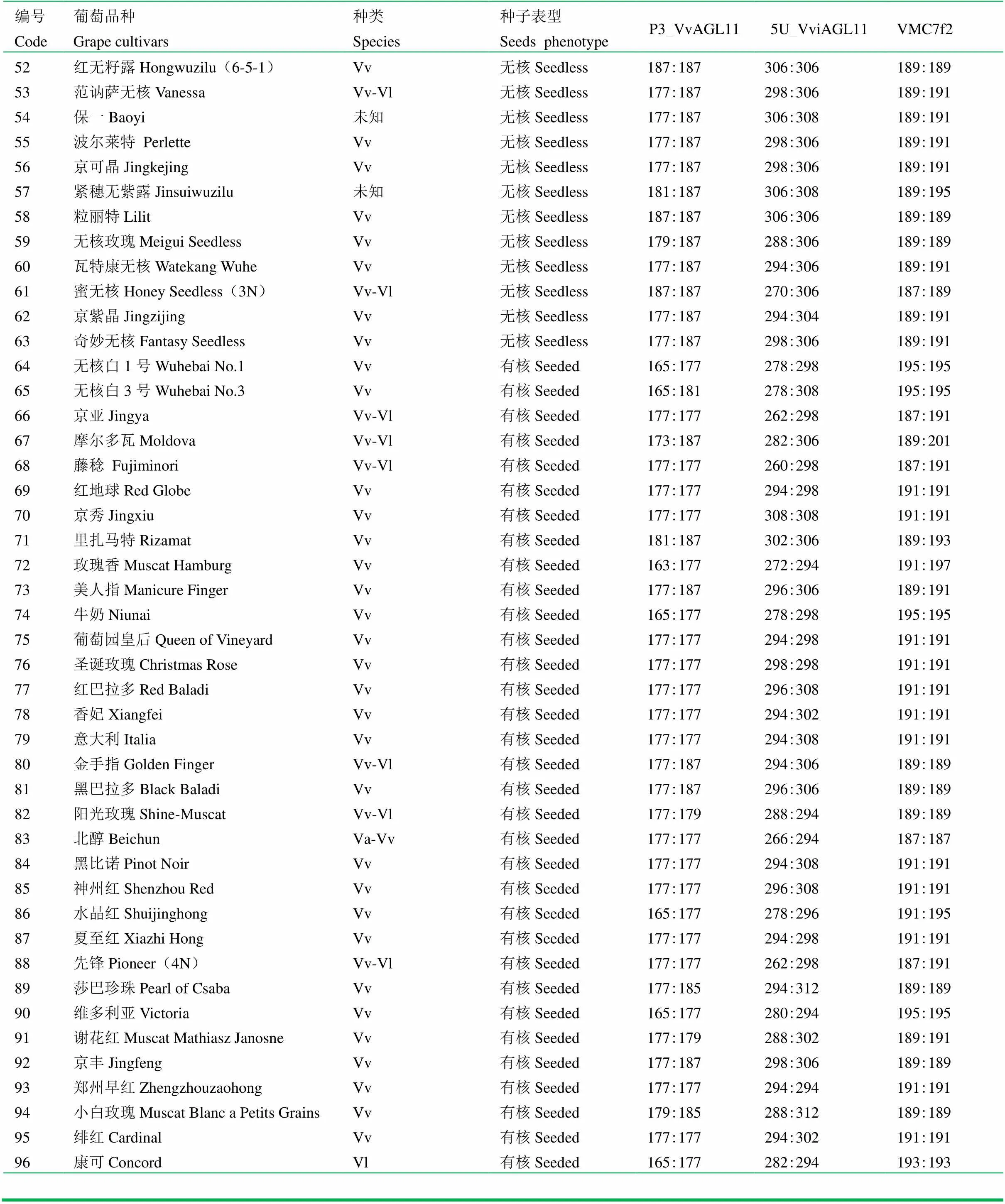
編號 Code葡萄品種Grape cultivars種類Species種子表型SeedsphenotypeP3_VvAGL115U_VviAGL11VMC7f2 52紅無籽露Hongwuzilu(6-5-1)Vv無核Seedless187:187306:306189:189 53范訥薩無核VanessaVv-Vl無核Seedless177:187298:306189:191 54保一Baoyi未知無核Seedless177:187306:308189:191 55波爾萊特 PerletteVv無核Seedless177:187298:306189:191 56京可晶JingkejingVv無核Seedless177:187298:306189:191 57緊穗無紫露Jinsuiwuzilu未知無核Seedless181:187306:308189:195 58粒麗特LilitVv無核Seedless187:187306:306189:189 59無核玫瑰Meigui SeedlessVv無核Seedless179:187288:306189:189 60瓦特康無核Watekang WuheVv無核Seedless177:187294:306189:191 61蜜無核Honey Seedless(3N)Vv-Vl無核Seedless187:187270:306187:189 62京紫晶JingzijingVv無核Seedless177:187294:304189:191 63奇妙無核Fantasy SeedlessVv無核Seedless177:187298:306189:191 64無核白1號Wuhebai No.1Vv有核Seeded165:177278:298195:195 65無核白3號Wuhebai No.3Vv有核Seeded165:181278:308195:195 66京亞JingyaVv-Vl有核Seeded177:177262:298187:191 67摩爾多瓦MoldovaVv-Vl有核Seeded173:187282:306189:201 68藤稔 FujiminoriVv-Vl有核Seeded177:177260:298187:191 69紅地球Red GlobeVv有核Seeded177:177294:298191:191 70京秀JingxiuVv有核Seeded177:177308:308191:191 71里扎馬特RizamatVv有核Seeded181:187302:306189:193 72玫瑰香Muscat HamburgVv有核Seeded163:177272:294191:197 73美人指Manicure FingerVv有核Seeded177:187296:306189:191 74牛奶NiunaiVv有核Seeded165:177278:298195:195 75葡萄園皇后Queen of VineyardVv有核Seeded177:177294:298191:191 76圣誕玫瑰Christmas RoseVv有核Seeded177:177298:298191:191 77紅巴拉多Red BaladiVv有核Seeded177:177296:308191:191 78香妃XiangfeiVv有核Seeded177:177294:302191:191 79意大利ItaliaVv有核Seeded177:177294:308191:191 80金手指Golden FingerVv-Vl有核Seeded177:187294:306189:189 81黑巴拉多Black BaladiVv有核Seeded177:187296:306189:189 82陽光玫瑰Shine-MuscatVv-Vl有核Seeded177:179288:294189:189 83北醇BeichunVa-Vv有核Seeded177:177266:294187:187 84黑比諾Pinot NoirVv有核Seeded177:177294:308191:191 85神州紅Shenzhou RedVv有核Seeded177:177296:308191:191 86水晶紅ShuijinghongVv有核Seeded165:177278:296191:195 87夏至紅Xiazhi Hong Vv有核Seeded177:177294:298191:191 88先鋒Pioneer(4N)Vv-Vl有核Seeded177:177262:298187:191 89莎巴珍珠Pearl of CsabaVv有核Seeded177:185294:312189:189 90維多利亞VictoriaVv有核Seeded165:177280:294195:195 91謝花紅Muscat Mathiasz JanosneVv有核Seeded177:179288:302189:191 92京豐JingfengVv有核Seeded177:187298:306189:189 93鄭州早紅ZhengzhouzaohongVv有核Seeded177:177294:294191:191 94小白玫瑰Muscat Blanc a Petits GrainsVv有核Seeded179:185288:312189:189 95緋紅CardinalVv有核Seeded177:177294:302191:191 96康可ConcordVl有核Seeded165:177282:294193:193
表格中所指無核即漿果成熟時只留下不明顯的種痕或者種皮未木質化的殘核。Vv:歐亞種;Vv-Vl:歐美雜種;Vl:美洲種;Va-Vv:山歐雜種。
The seedlessness in the table is that there are only imperceptible seed traces or rudimental seed without lignified seed coat.Vv:,Vv-Vl means, Vl means, Va-Vv means.
[1] MEJíA N, SOTO B, GUERRERO M, CASANUEVA X, HOUEL C, MICCONO M D L á, RAMOS R, LE CUNFF L, BOURSIQUOT J M, HINRICHSEN P, ADAM-BLONDON A F. Molecular, genetic and transcriptional evidence for a role of VvAGL11 in stenospermocarpic seedlessness in grapevine. BMC Plant Biology, 2011, 11: 57.
[2] BERGAMINI C, CARDONE M F, ANACLERIO A, PERNIOLA R, PICHIERRI A, GENGHI R, ALBA V, FORLEO L R, CAPUTO A R, MONTEMURRO C, BLANCO A, ANTONACCI D. Validation assay of p3_VvAGL11 marker in a wide range of genetic background for early selection of stenospermocarpy inL. Molecular Biotechnology, 2013, 54(3): 1021-1030.
[3] LEDBETTER C A, BURGOS L. Inheritance of stenospermocarpic seedlessness inL. Journal of Heredity, 1994, 85(2): 157-160.
[4] STOUT A B. Progress in breeding for seedless grapes. Proceeding American Society for Horticultural Science, 1939, 37: 627-629.
[5] SANDHU A S, JAWANDA J S, UPPAL D K. Inheritance of seed characters in hybrid population of intercultivar crosses of grapes (L.). Journal of Research-Punjab Agricultural University, 1984, 21(1): 39-44.
[6] SATO A, YAMANE H, YAMADA M, YOSHINAGA K. Inheritance of seedlessness in grapes. Journal of the Japanese Society for Horticultural Science, 1994, 63(1): 1-7.
[7] BOUQUET A, DANGLOT Y. Inheritance of seedlessness in grapevine (L.). Vitis, 1996, 35(1): 35-42.
[8] COSTANTINI L, BATTILANA J, LAMAJ F, FANIZZA G, GRANDO M S. Berry and phenology-related traits in grapevine (L.): from quantitative trait loci to underlying genes. BMC Plant Biology, 2008, 8: 38.
[9] LAHOGUE F, THIS P, BOUQUET A. Identification of a codominant scar marker linked to the seedlessness character in grapevine. Theoretical and Applied Genetics, 1998, 97(5): 950-959.
[10] ROYO C, TORRES-PéREZ R, MAURI N, DIESTRO N, CABEZAS J A, MARCHAL C, LACOMBE T, IBá?EZ J, TORNEL M, CARRE?O J, MARTíNEZ-ZAPATER J M, CARBONELL-BEJERANO P. The major origin of seedless grapes is associated with a missense mutation in the MADS-box gene VviAGL11. Plant Physiology, 2018, 177(3): 1234-1253.
[11] MEJIA N, HINRICHSEN P. A new, highly assertive scar marker potentially useful to assist selection for seedlessness in table grape breeding. Acta Horticulturae, 2003, 603(603): 559-564.
[12] 王躍進, Lamikanra Olusola. 檢測葡萄無核基因DNA探針的合成與應用. 西北農林科技大學學報(自然科學版), 2002, 30(3): 42-46.
WANG Y J, OLUSOLA L. Application and synthesis on the DNA probe for detecting seedless genes in grapevine. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2002, 30(3): 42-46. (in Chinese)
[13] PELLERONE F I, EDWARDS K J, THOMAS M R. Grapevine microsatellite repeats: Isolation, characterisation and use for genotyping of grape germplasm from Southern Italy. Vitis Journal of Grapevine Research, 2001, 40(4):179-186.
[14] MERDINOGLU D, BUTTERLIN G, BEVILACQUA L, CHIQUET V, ADAM-BLONDON A F, DECROOCQ S. Development and characterization of a large set of microsatellite markers in grapevine (L.) suitable for multiplex PCR. Molecular Breeding, 2005, 15(4): 349-366.
[15] 馬亞茹, 馮建燦, 劉崇懷, 樊秀彩, 孫海生, 姜建福, 張穎. 葡萄無核性狀的SSR新分子標記開發及應用. 中國農業科學, 2018, 51(13): 2622-2630.
MA Y R, FENG J C, LIU C H, FAN X C, SUN H S, JIANG J F, ZHANG Y. Development and application of SSR new molecular marker for seedless traits in grape. Scientia Agricultura Sinica, 2018, 51(13): 2622-2630. (in Chinese)
[16] OCAREZ N, JIMENEZ N, NUNEZ R, PERNIOLA R, MARSICO A D, CARDONE M F, BERGAMINI C, MEJIA N. Unraveling the deep genetic architecture for seedlessness in grapevine and the development and validation of a new set of markers for-Based Gene-Assisted Selection. Genes, 2020, 11(2): 151.
[17] LI Z Q, LI T M, WANG Y J, XU Y. Breeding new seedless grapes using in ovulo embryo rescue and marker-assisted selection. In Vitro Cellular & Developmental Biology - Plant, 2015, 51(3): 241-248.
[18] LI T M, LI Z Q, YIN X, GUO Y R, WANG Y J, XU Y. Improved in vitroL. embryo development of F1progeny of 'Delight' × 'Ruby seedless' using putrescine and marker-assisted selection. In Vitro Cellular & Developmental Biology-Plant, 2018, 54(3): 291-301.
[19] LI S S, LI Z Y, ZHAO Y N, ZHAO J, LUO Q W, WANG Y J. New disease-resistant, seedless grapes are developed using embryo rescue and molecular markers. 3 Biotech, 2019, 10(1): 4.
[20] KORPAS A, BARáNEK M, PIDRA M, HRADLíK J. Behaviour of two SCAR markers for seedlessness within Central European varieties of grapevine. Vitis, 2009, 48(1): 33-42.
[21] KUBOTA S, LIU Q, KESSUWAN K, OKAMOTO N, SAKAMOTO T, NAKAMURA Y, SHIGENOBU Y, SUGAYA T, SANO M, UJI S, NOMURA K, OZAKI A. High-throughput simple sequence repeat (SSR) markers development for the kelp grouper () and cross-species amplifications for Epinephelinae species. Advances in Bioscience and Biotechnology, 2014, 5(2): 117-130.
[22] CABEZAS J A, CERVERA M T, RUIZ-GARCíA L, CARRE?O J, MARTíNEZ-ZAPATER J M. A genetic analysis of seed and berry weight in grapevine. Genome, 2006, 49(12): 1572-1585.
[23] KARAAGAC E, ALBA M. VARGAS, ANDRES M T D, CARRENO I, IBANEZ J, CARRENO J, MARTINEZ-ZAPATER J M, CABEZAS J A. Marker assisted selection for seedlessness in table grape breeding. Tree Genetics & Genomes, 2012, 8(5): 1003-1015.
[24] AKKURT M, ?AK?R A, SHIDFAR M, ?ELIKKOL B P, S?YLEMEZO?LU G. Using SCC8, SCF27 and VMC7f2 markers in grapevine breeding for seedlessness via marker assisted selection. Genetics and Molecular Research, 2012, 11(3): 2288-2294.
[25] BENNICI S, DI GUARDO M, DISTEFANO G, LA MALFA S, PUGLISI D, ARCIDIACONO F, FERLITO F, DENG Z N, GENTILE A, NICOLOSI E. Influence of the genetic background on the performance of molecular markers linked to seedlessness in table grapes. Scientia Horticulturae, 2019, 252: 316-323.
[26] VIHINEN M. How to evaluate performance of prediction methods? Measures and their interpretation in variation effect analysis. BMC Genomics, 2012, 13(4): S2.
[27] BALDI P, BRUNAK S, CHAUVIN Y, ANDERSEN C A F, NIELSEN H. Assessing the accuracy of prediction algorithms for classification: an overview. Bioinformatics, 2000, 16(5): 412-424.
[28] REVERS L F, WELTER L J, IRALA P B, Silva D, Garrido L R. Co-localization of QTLS for seedlessness and downy mildew resistance in grapevine. Acta Horticulturae, 2014, 1046: 449-456.
[29] GUO D L, ZHAO H L, LI Q, ZHANG G H, JIANG J F, LIU C H, YU Y H. Genome-wide association study of berry-related traits in grape [L.] based on genotyping-by-sequencing markers. Horticulture Research, 2019, 6: 11.
[30] 屈田田, 張劍俠, 駱強偉, 王躍進. 無核葡萄抗寒抗病胚挽救育種應用研究. 果樹學報, 2017, 34(2): 157-165.
QU T T, ZHANG J X, LUO Q W, WANG Y J. A study on the application of seedless grapevine breeding for cold-hardness and disease-resistance using embryo rescue. Journal of Fruit Science, 2017, 34(2): 157-165.(in Chinese)
[31] MEJIA N, GEBAUER M, MUNOZ L, HEWSTONE N, MUNOZ C, HINRICHSEN P. Identification of QTLs for seedlessness, berry size, and ripening date in a seedless x seedless table grape progeny. American Journal of Enology & Viticulture, 2007, 58(4): 499-507.
Commonality Identification of Molecular Markers Linked to Seedless Genes in Grape
CHEN DouDou, GUAN LiPing, HE LiangLiang, SONG YinHua, ZHANG Peng, LIU SanJun
Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009
【Objective】Seedlessness is an important agronomic trait in table grape breeding studies. The accuracy of molecular markers linked to seedless genes will substantially influence the early selection of seedless grapes. In this study, five previously reported seedless molecular markers against 183 genotypes were assessed to determine their efficacy for the selection of seedless plants and to provide alternative strategies for the breeding of seedless grapevines based on marker-assisted selection. 【Method】Leaf samples for DNA extraction were obtained from 96 grape cultivars (63 seedless and 33 seeded cultivars) and 87 F1hybrids (61 seedless and 26 seeded hybrids) from a cross between ‘Red Globe’ and ‘Dawn Seedless’. The previously reported primer pairs for five markers (SCF27-2000, GSLP1-569, VMC7f2, p3_VvAGL11, and 5U_VviAGL11) were used for PCR amplification. The presence of markers in cultivars and hybrid genotypes was detected by running the PCR products on 1.5% agarose gels, 8% polyacrylamide gels, or by fluorescence capillary electrophoresis. 【Result】The primer for the SCAR marker GSLP1-569 amplified a 569-bp segment in the 96 grape cultivars, which showed 40.6% accuracy and 63.6% efficiency in the detection of seedless cultivars. The primers for the SCAR marker SCF27-2000 amplified a 2000-bp segment in the 96 grape cultivars and 87 F1hybrids, with an accuracy of 71.9% and an efficiency of 76.54% for detection of the seedless trait in the 96 cultivars, and an accuracy of 70.5% and efficiency of 78.5% in the 87 F1hybrids.Among the 96 assessed cultivars, the SSR marker VMC7f2 identified eight alleles, a 189-bp allele of which was found to be most significantly associated with seedlessness based on a Chi-square (χ2) independence test, and detected seedless genotypes with an accuracy of 85.4% and an efficiency of 85.5%. Among the 96 cultivars, the SSR marker p3_VvAGL11 identified seven alleles, among which, a 187-bp allele was found to be most significantly associated with seedlessnessand detected seedless genotypes with an accuracy of 89.6% and efficiency of90.7%. Among the F1hybrids, the accuracy and efficiency of this marker were 87.65% and 91.1%, respectively, whereasit showed false-positive and false-negative rates of 6.17% and 6.17%, respectively. Among the 96 grape cultivars, the SSR marker 5U_VviAGL11 identified 17 alleles, of which, a 306-bp allele was found to be most significantly associated with the detection of seedlessness, identifying seedless genotypes with an accuracy of 88.5% and an efficiency of 90.6%. Among the F1hybrids, the accuracy and efficiency of 5U_VviAGL11 were 88.89% and 92.7%, respectively, with false-positive and false-negative rates of 4.94% and 6.17%, respectively. 【Conclusion】The SSR markers 5U_VviAGL11 and p3_VvAGL11showed higher accuracy and efficiency with respect to the detection of grape germplasm and genetic population. These markers should be given priority for future molecular marker-assisted selection based on seedless genes in the grapevine.
L.; seedlessness; molecular marker; commonality; identification
2021-01-25;
2021-04-08
河南省科技攻關項目(202102110196)、國家現代農業產業技術體系(CARS-30-17)、中國農業科學院創新工程“葡萄資源及育種”(CAAS-ASTIP-2020-ZFRI)
陳豆豆,E-mail:chendoudou21@163.com。通信作者劉三軍,E-mail:liusanjun@caas.cn
(責任編輯 趙伶俐)

