磷酸鹽分步沉淀不銹鋼酸洗污泥浸出液鉻鐵鎳
施春紅,張喜玲,楊春雪
(1 北京科技大學能源與環境工程學院,北京 100083;2 工業典型污染物資源化處理北京市重點實驗室,北京 100083)
不銹鋼是一種環境友好型材料,具有耐腐蝕性能強、維護成本低、使用壽命長、回收價值高等優勢,廣受人們青睞。2019 年全球不銹鋼粗產量約5221.8萬噸,中國不銹鋼粗鋼產量占全球不銹鋼總產量的56.3%,約2940 萬噸[1]。根據每噸不銹鋼產生3%~5%酸洗污泥估算[2],2019 年我國酸洗污泥產生量約117.6 萬噸。酸洗污泥含有大量酸和金屬化合物,具有較高毒性和腐蝕性[3],已被列入國家危險廢物名錄(HW17、HW22)[4]。我國酸洗污泥的堆存量隨著不銹鋼產量逐年上升,不銹鋼酸洗污泥資源化利用已經成為我國不銹鋼企業綠色發展的重要走向。
不銹鋼酸洗污泥主要含有鐵、鉻、鎳三種金屬,可資源化利用價值高,國內外不銹鋼酸洗污泥中金屬資源化利用研究可歸納為三類[5]:濕法回收技術[6]、火法還原技術[7]、固化/穩定化處理技術。火法還原技術的產物可作為原料直接用于高爐生產,實現酸洗污泥鐵鉻鎳金屬的資源化利用[8],但具有成本高、能耗大的缺點;固化/穩定化處理技術將不銹鋼酸洗污泥中有害的重金屬離子固定,做水泥添加料[9]、制磚[10]、陶粒[11]、微晶玻璃[12]等建筑材料。雖然可以消納大量的不銹鋼酸洗污泥,緩解了環境壓力,但不銹鋼酸洗污泥中的有價組分未得到有效的利用,且未能消除有害組分帶來的環境風險問題[13]。濕法技術研究較多的是萃取法和沉淀法。萃取法分離多組分、高酸度混合液金屬離子,分離效率低;沉淀法操作條件要求高,易造成其他金屬離子的損失[14],分離得到的金屬純度難以達到要求。
不銹鋼酸洗污泥浸出液中鐵含量較高,國內外學者多側重于優先去除鐵再回收鉻、鎳的研究[15],因鐵、鉻性質相似,存在共沉淀、吸附等現象,導致鉻的沉淀率較高。25℃時,CrPO4溶度積常數ksp=1.0×10-17;Fe3(PO4)2在pH 大于6 溶液中,其溶度積常數ksp=1.0×10-36,但在pH 小于3 的弱酸介質中易水解為溶解度較高的FeHPO4;FePO4溶度積常數ksp=1.0×10-22,在強酸介質中較為穩定;Ni3(PO4)2在酸性介質中幾乎不生成沉淀[16],理論上可以優先將Cr3+從Fe2+、Ni2+溶液中分離。因此,鑒于不銹鋼污泥的物化特性和CrPO4、Fe3(PO4)2、FePO4、Ni3(PO4)2在酸性條件下的溶度積常數的差異,本文提出優先分離回收鉻的新思路,采用磷酸鹽沉淀法分梯級回收不銹鋼酸洗污泥浸出液中鉻、鐵金屬,達到了不銹鋼酸洗污泥中金屬離子分步沉淀回收的目標。
1 材料和方法
1.1 材料
不銹鋼酸洗污泥來自江蘇某公司不銹鋼酸洗工藝,是基于硫酸平衡的酸洗廢酸資源化循環利用技術濃縮控制結晶產生,得到的不銹鋼酸洗污泥以硫酸亞鐵為主,如圖1所示。

圖1 不銹鋼酸洗污泥產生工藝流程
將不銹鋼酸洗污泥置于烘箱中105℃烘干4h,研磨過篩(200目)進行XRF分析,酸洗污泥主要金屬元素質量分數見表1。不銹鋼酸洗污泥化學成分復雜,約38.26%金屬元素,其中鐵、鎳、鉻質量分數分別為24.16%、3.29%、2.07%。X 射線衍射儀和掃描電子顯微鏡分析結果如圖2 和圖3 所示,由圖2可見,不銹鋼酸洗污泥的主要結晶相為硫酸亞鐵、硫酸鉻和硫酸鎳。由圖3可見,不銹鋼酸洗污泥微觀結構呈顆粒狀,金屬元素相互摻雜,其主要化學元素是S、Fe、Cr、Ni、Mn。酸洗污泥中Co、Cu、Al、Mo 等其他金屬離子濃度過低,回收價值低。因此,主要研究Fe、Cr、Ni 三種金屬離子的分步沉淀回收情況。

圖2 不銹鋼酸洗污泥XRD圖譜

圖3 酸洗污泥SEM-EDS圖譜

表1 不銹鋼酸洗污泥主要金屬元素質量分數
1.2 試劑及儀器
無水磷酸三鈉(分析純);亞硫酸鈉(分析純);氫氧化鈉(分析純);硫酸(98%);雙氧水(35%)。
HJ-3數顯恒溫磁力攪拌器;電熱鼓風干燥箱;循環水式多用真空泵;原子吸收分光光度儀(AA-6300C);pH計(pHS-25cw);電子天平(AL204);X 射線衍射儀(Rigaku);掃描電子顯微鏡及取向分析系(LEO1450)。
1.3 研究方法
1.3.1 鉻沉淀實驗
稱量100.0000g(105℃,4h)不銹鋼酸洗污泥于燒杯中,加入去離子水溶解定容1L,pH為0.89。通過原子吸收分光光度儀測定浸出液中Fe2+、Cr3+、Ni2+濃度分別為0.43mol/L、0.04mol/L、0.056mol/L。加入亞硫酸鈉保持溶液中Fe2+價態,調整浸出液初始pH,滴加與Cr3+等物質的量濃度的Na3PO4溶液,400r/min 轉速攪拌一段時間后抽濾,pH 為0.80 硫酸洗滌定容,測定溶液中Fe2+、Cr3+、Ni2+濃度,根據式(1)計算Fe2+、Cr3+、Ni2+沉淀率,以研究Fe2+、Cr3+、Ni2+離子分離最佳條件。

式中,η為金屬離子沉淀率,%;wi為濾液中金屬離子濃度,g/L;w0為浸出液中金屬離子的濃度,g/L。
1.3.2 鐵沉淀實驗
將上述沉淀溶液通過真空抽濾機進行過濾酸洗,濾液調節pH 為2.00 左右,H2O2將Fe2+氧化為Fe3+,調節溶液pH,加入一定量40g/L Na3PO4溶液,不同溫度下攪拌一段時間后抽濾洗滌定容,測定溶液中Fe3+、Ni2+質量濃度,計算Fe3+、Ni2+沉淀率,確定最佳沉淀條件,達到Fe3+、Ni2+離子最佳分離效果。
2 結果與討論
2.1 鉻沉淀條件優化
2.1.1 Na3PO4對Fe2+、Cr3+、Ni2+分離效果的影響
在初始pH=0.89、反應溫度為80℃、攪拌時間60min 的條件下,以0.04mol/L 磷酸三鈉為沉淀劑,考察了Na3PO4/Cr3+不同摩爾比對Fe2+、Cr3+、Ni2+沉淀效果的影響,結果如圖4 所示。Cr3+的沉淀率與Na3PO4量成正比,Fe2+的沉淀率也隨之升高,Ni2+沉淀率相對穩定,在Na3PO4/Cr3+摩爾比1.00 時,Cr3+沉淀率為91.12%,Fe2+、Ni2+沉淀率分別為0.82%、1.50%。
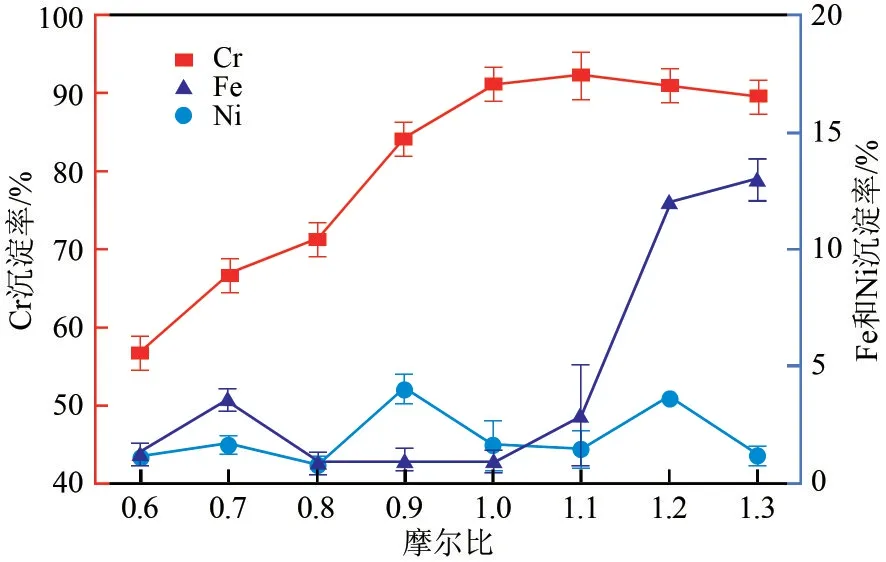
圖4 Na3PO4對Fe2+、Cr3+、Ni2+分離效果的影響
2.1.2 初始pH對Fe2+、Cr3+、Ni2+分離效果的影響
加入Na3PO4會影響溶液的pH、在Na3PO4/Cr3+摩爾比為1.00、反應溫度為80℃、攪拌時間60min的條件下,考察了不同初始pH 對Fe2+、Cr3+、Ni2+沉淀效果的影響,如圖5 所示。Fe2+、Cr3+、Ni2+的沉淀率隨著溶液pH 升高有遞增趨勢,pH 在0.50~1.00 之間,Fe2+和Ni2+的沉淀率較小,因為溶液中H+對PO43-水解產生HPO42-產生了抑制作用,促進PO43-和Cr3+沉淀。當溶液初始pH 大于1.00 時,Fe2+、Ni2+的沉淀率明顯增加,是因為Na3PO4加入導致溶液pH 升高,促進了金屬離子水解[15]。在初始溶液pH 為1.00,此時Cr3+沉淀率為90.36%,Fe2+、Ni2+沉淀率分別為1.76%、0.75%。

圖5 初始pH對Fe2+、Cr3+、Ni2+分離效果的影響
2.1.3 溫度對Fe2+、Cr3+、Ni2+分離效果的影響
Cr3+與PO43-生成的CrPO4為膠體物質[14],受溫度影響大。在初始Na3PO4/Cr3+摩爾比為1.0,初始pH為1.00,攪拌時間60min的條件下,考察了不同溫度下Fe2+、Cr3+、Ni2+沉淀效果,結果如圖6 所示。Cr3+沉淀率隨著溫度的升高而增大,Fe2+、Ni2+沉淀率基本不受溫度的影響,反應最佳溫度為90℃,此時Cr3+沉淀率為91.53%,Fe2+、Ni2+沉淀率分別為0.84%、0.53%。
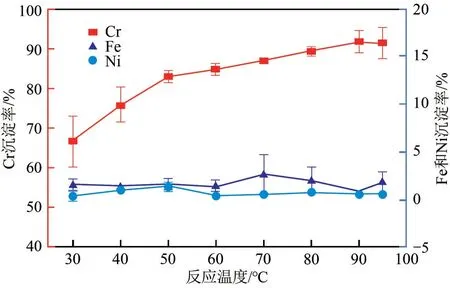
圖6 反應溫度對Fe2+、Cr3+、Ni2+分離效果的影響
2.1.4 時間對Fe2+、Cr3+、Ni2+分離效果的影響
在初始Na3PO4/Cr3+摩爾比為1.00、初始pH 為1.00、溫度為90℃的條件下,考察攪拌時間對Fe2+、Cr3+、Ni2+沉淀效果影響,如圖7所示。加熱時間對Fe2+、Cr3+、Ni2+沉淀率影響不大,但加熱時間為50 min以上時,Fe2+、Cr3+、Ni2+沉淀實驗效果不穩定,誤差值相對較高。綜合考慮,選擇加熱時間為70min,此時Cr3+沉淀率最高為94.37%,Fe2+、Ni2+最低沉淀率分別為0.18%、0.55%。

圖7 反應時間對Fe2+、Cr3+、Ni2+分離效果的影響
2.1.5 鉻沉淀物表征
在最優條件下,即Na3PO4/Cr3+摩爾比為1.00,初始pH為1.00,反應溫度為90℃,反應時間70min,開展三組平行實驗,結果見表2。Cr3+平均沉淀率為94.47%,Fe2+、Ni2+平均沉淀率為0.88%、0.78%,實現了優先分離鉻的目標。

表2 綜合條件實驗結果
Cr3+沉淀物XRD 和SEM-EDS 定量分析結果如圖8 所示。由圖8(a)可見,XRD 圖譜峰呈彌散橋狀,說明生成的Cr3+沉淀物為非晶體粉末,為膠體顆粒[14]。對Cr3+沉淀物進行SEM-EDS定量分析,結果如圖8(b),Cr3+沉淀物為CrPO4,純度大于78%,CrPO4含量達到了染料、陶瓷生產工業原料標準,也可以進一步提純生產Cr(OH)3、Cr2O3。含有少量的Fe 和Ni、Mn,說明不銹鋼酸洗污泥浸出液中Fe2+、Ni2+對Cr3+沉淀效果影響較小,可以實現Cr3+優先分離。

圖8 鉻沉淀物料XRD圖譜和SEM-EDS分析結果
2.2 鐵沉淀條件優化
2.2.1 Na3PO4對Fe3+、Ni2+分離效果的影響
在初始pH=1.00、反應溫度為60℃、攪拌時間60min 的條件下,以40g/L Na3PO4為沉淀劑,通過控制Na3PO4/Fe3+不同體積比對Fe3+、Ni2+沉淀分離效果的影響,如圖9 所示。隨著Na3PO4增多,Fe3+和Ni2+沉淀率逐漸增加。當Na3PO4/Fe3+體積比大于0.80時,Fe3+沉淀率趨于穩定,鎳的沉淀率也有所增加,因為Na3PO4加入提高溶液中pH,促使部分Fe3+水解產生氫氧化鐵膠體,吸附Ni2+造成損失[13]。在Na3PO4/Fe3+體積比為0.80時,Fe3+沉淀率為97.80%,Ni2+沉淀率穩定在1.45%。

圖9 磷酸鈉用量對Fe3+、Ni2+分離效果的影響
2.2.2 初始pH對Fe3+、Ni2+分離效果的影響
研究了不同初始pH對浸出液中Fe3+、Ni2+沉淀分離效果的影響,Fe3+和Ni2+沉淀率如圖10 所示。初始pH由0.50增加至2.00,Fe3+沉淀率先增加后降低,而Ni2+沉淀率呈現增長趨勢。pH 增大,Fe3+發生水解,OH-和PO43-產生了配位競爭,部分Fe3+轉化為氫氧化鐵膠體,吸附Ni2+,膠體顆粒較小,難以通過濾紙分離[18],導致Ni2+沉淀率升高的現象。在初始pH 為1.00,Fe3+沉淀率最高為97.68%,Ni2+沉淀率最低為1.95%,實驗誤差值小。

圖10 初始pH對Fe3+、Ni2+分離效果的影響
2.2.3 溫度對Fe3+、Ni2+分離效果的影響
研究了不同反應溫度對浸出液中Fe3+、Ni2+沉淀分離效果的影響,Fe3+和Ni2+沉淀率如圖11所示。溫度在20~60℃范圍內,Fe3+和Ni2+沉淀率基本不變,但當溫度大于80℃時,Fe3+沉淀率誤差較大,這是因為高溫促進FePO4水解[19],降低了實驗的穩定性。考慮實驗能耗,實驗選擇反應溫度為40℃,此時Fe3+沉淀率最高為99.32%,Ni2+沉淀率穩定在0.98%。
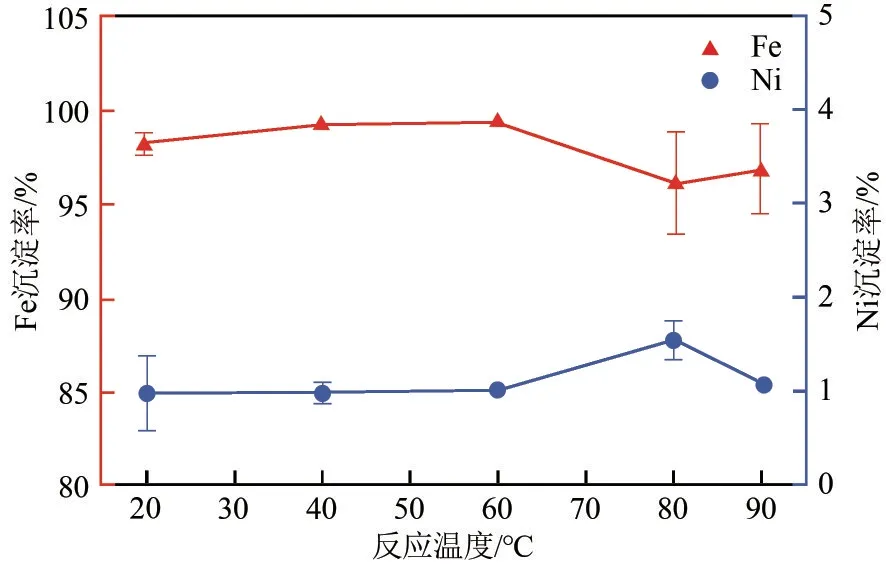
圖11 反應溫度對Fe3+、Ni2+分離效果的影響
2.2.4 時間對Fe3+、Ni2+分離效果的影響
研究了不同反應時間對浸出液中Fe3+和Ni2+沉淀效果的影響,Fe3+和Ni2+沉淀率如圖12 所示。反應時間增加對Fe3+和Ni2+沉淀率影響較小,實驗攪拌混合15min,Fe3+基本完全沉淀,但Ni2+沉淀率誤差較大,穩定性較差。綜合考慮Fe3+、Ni2+沉淀率,選擇反應時間為60min,此時Fe3+沉淀率最高為99.83%,Ni2+沉淀率穩定在0.51%,實驗效果穩定。

圖12 反應時間對Fe3+、Ni2+分離效果的影響
2.2.5 鐵沉淀物表征
根據上述實驗結果,在最佳工藝條件(Na3PO4/Fe3+體積比0.80,初始pH為1.00,反應溫度為45℃,攪拌時間為60min)下,對Fe3+沉淀物進行SEM-EDS定量分析,結果如圖13 所示。Fe3+沉淀物中P、Fe為主要元素,含有少量的Ni,幾乎不含Cr,沉淀物主要成分是FePO4,純度大于90%,說明不銹鋼酸洗污泥浸出液中Fe3+沉淀效果較好,Ni 沉淀率低,被保留在溶液中。證明了磷酸鹽沉淀法可以實現不銹鋼酸洗污泥浸出液中Fe、Cr、Ni分離回收。
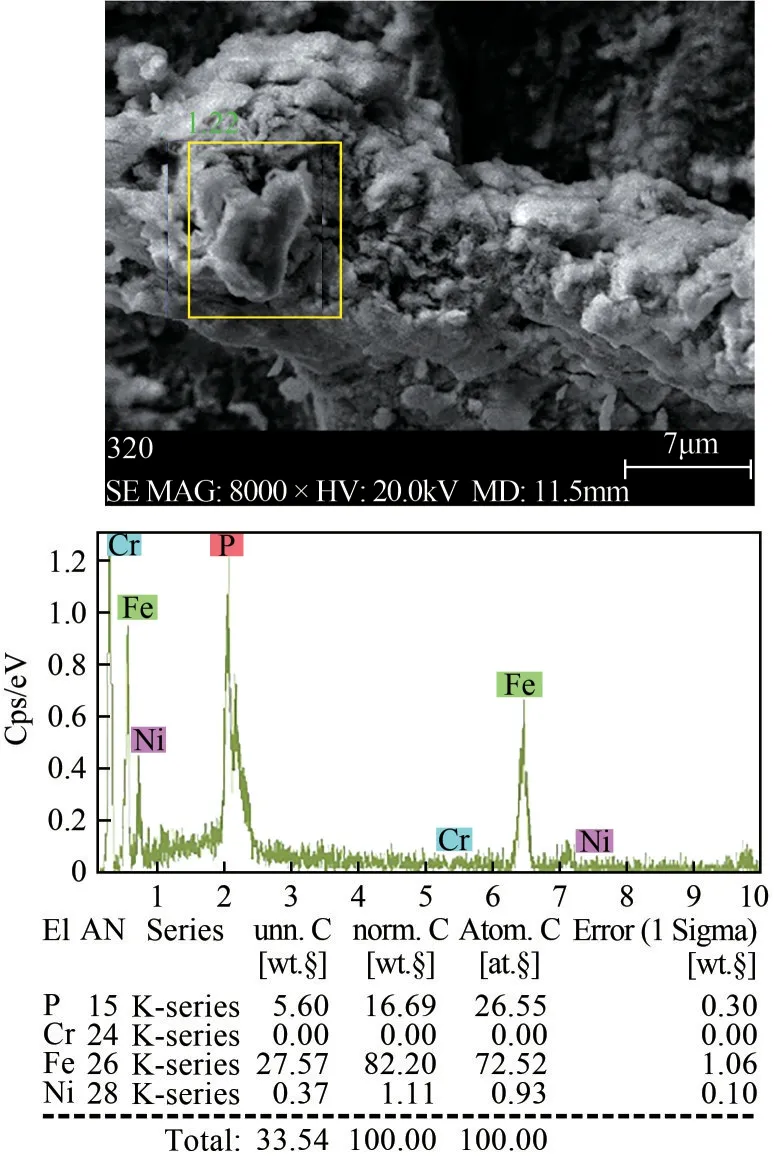
圖13 鐵沉淀物SEM-EDS分析結果
3 結論
(1)不銹鋼酸洗污泥主要含有硫酸亞鐵、硫酸鉻和硫酸鎳,酸洗液pH 為0.89,酸性較大。鐵、鉻、鎳金屬以Fe2+、Cr3+、Ni2+金屬離子存在于浸出液中,根據三種金屬離子磷酸鹽的特性,可以實現分步沉淀。
(2)在Na3PO4/Cr3+摩爾比為1.00、初始pH 為1.00、溫度為90℃、反應時間70min的優化條件下,Cr3+沉淀率為94.47%,Fe2+、Ni2+平均沉淀率為0.88%、0.79%,沉淀物主要成分為CrPO4,純度達到78%,CrPO4含量達到了染料、陶瓷生產工業原料標準,實現了優先沉淀鉻的目的。
(3)濾液被H2O2氧化后,在最佳工藝條件下,即Na3PO4/Fe3+體積比0.80、初始pH為1.00、反應溫度為45℃、攪拌時間為60min,Fe3+沉淀率最高為99.81%、Ni2+沉淀率穩定在0.68%,沉淀物FePO4純度大于90%,證明磷酸鹽可以優先沉淀鉻,再分步沉淀鐵,實現不銹鋼酸洗污泥浸出液金屬離子分步沉淀回收的目的。

