3D pCASL及Rapid灌注分析對腦動脈搭橋術后腦血流灌注的評價
顏立群,顏 瑾,侯亞平,董倩波,穆曉丹,李曉光
(1.河北醫科大學第二醫院醫學影像科,河北 石家莊 050000;2.天津醫科大學臨床醫學系,天津 300070;3.河北省血液中心成分科,河北 石家莊 050000)
單側大腦中動脈M1段狹窄在臨床上非常常見,對它的治療手段也比較多,但對于嚴重的狹窄或閉塞性病變,神經外科常常選擇顳淺動脈-大腦中動脈(superficial temporal artery-middle cerebral artery,STA-MCA)搭橋手術進行治療,但目前對STA-MCA手術的療效仍存在爭議,術前與術后的評估仍局限于臨床,醫學影像學對其腦血流動力學的量化研究目前多集中在動態磁敏感對比增強灌注成像(dynamic susceptibility contrast enhanced perfusion weighted imaging,DSC-PWI)[1-2],由于其無法進行全腦精確的血流動力學測量等缺點,仍無法較為精確地評估腦血流動力學的改變。近年來,隨著腦結構數字化研究的快速進展及其與醫學影像學的深入結合,由此衍生出多種醫學影像學成像方法及腦科學分析方法使得對腦部疾病的成像研究進入了新時代。本研究采用兩個雙標記后延遲時間(post labeling delay,PLD)的3D pCASL成像對大腦中動脈供血區的腦血流進行量化和分類,利用基于Matlab平臺的SPM軟件進行大腦中動脈供血區血流的測量,對腦動脈搭橋術后的腦血流進行分類評價。
1 資料與方法
1.1一般資料 回顧性分析2019—2020年就診于我院的28例單側大腦中動脈M1段狹窄患者的影像與臨床資料,入選患者均行STA-MCA搭橋手術,術前3 d內與術后1周以內均進行了MR掃描。患者納入標準: ①狹窄率>50%的單側大腦中動脈M1段狹窄,而無其他顱內動脈明顯狹窄者;②患者符合STA-MCA手術適應證;③此前未做過溶栓或血管內治療(如搭橋手術及支架植入等);④患者無腦出血發生;⑤患者手術無嚴重并發癥。
1.2影像學檢查
1.2.1影像學數據采集 所有患者的MR檢查均由GE公司1.5T Signa HDxt MR掃描機(8通道頭頸線圈)采集,掃描序列主要包括結構像(T1WI和T2 fliar),DWI序列,雙PLD(1 525 ms和2 525 ms)的3D pCASL序列,3D CEMRA序列及灌注掃描序列,每個患者采集時間大約為30 min(圖1)。各序列參數如下:彌散加權成像(diffusion-weighted imaging,DWI)序列由單次激發自旋回波序回波平面(echo planar imaging,EPI)序列采集,b值取0和1 000 s/mm2,重復時間(repetition time,TR)=6 500 ms,回波時間(echo time,TE)=81.8 ms,視野(field of view,FOV)=240 mm,矩陣(Matrix)=128×160,激發次數(number of excitations,NEX)=2,層厚=5 mm;T1WI由橫軸位的三維穩態毀損梯度回波(three-dimensional spoiled gradient recalled acquisition in steadystate,3D SPGR)序列采集而來,層數128層,FOV=240 mm,矩陣=240×240,層厚=1.2 mm,翻轉角=20,采集時間約5 min;T2WI由FSE序列采集,TR=8 500 ms,TE=150 ms,IR=2 100 ms,層厚=5 mm,帶寬=27.78 kHz,矩陣=256×224,采集時間約4 min。脂肪及背景抑制3D FSE序列獲得3D pCASL數據,TR=4 529 ms(PLD=1 525 ms)/5 224 ms(PLD=2 525 ms),TE=10 ms,帶寬=62.5 kHz,層厚=5 mm,層數=30,PLD=1 525 ms和2 525 ms,采集時間約4 min(PLD=1 525 ms)及5 min(PLD=2 525 ms),FOV=240 mm,激勵次數=3。采用3D SPGR序列采集CEMRA,TR=12 ms,翻轉角=20,帶寬=25 kHz,層厚=1.2 mm,視野=240 mm,矩陣=288×192,采集時間約4 min。
1.2.2數據后處理 采用GE AW4.6圖形工作站對雙PLD灌注數據進行處理,得到彩色ASL灌注圖和腦血流(cerebral blood flow ,CBF)圖。采用基于Matlab2013b軟件平臺的SPM8對灌注數據做包括頭部校正、空間標準化、數據歸一化和平滑等多種后處理得到標準化的CBF圖。參考Kim的方法[3],從自動解剖標記(automated antomical labeling,AAL)模板中提取的雙側大腦中動脈供血區的腦區圖(包括大腦皮層、軟腦膜及島葉的皮層)作為蒙片,并應用于上述CBF圖計算得到CBF值。參考Lyu等[4]的方法將PLD 1.5 s得到的CBF圖定義為早期到達流(即順向血流)灌注圖,而PLD 2.5 s得到的CBF圖是早期到達血流、晚期到達血流和晚期到達逆向血流灌注的組合。PLD 1.5 s時的平均CBF值代表早期到達血流的灌注值,晚期到達逆向血流灌注值 =(病灶側平均PLD 2.5 s的CBF-病變側PLD 1.5 s的平均CBF)-(對側PLD 2.5 s的CBF-對側PLD 1.5 sD的CBF),晚期到達逆向血流灌注值/正常側PLD 2.5s的平均CBF×100% = 晚期到達逆向血流比率(late-arriving retrograde flow proportion,LARFP),LARFP代表側支血流代償能力;而患側PLD 1.5 s的CBF值/正常側PLD 2.5 s的平均CBF×100% =早期到達血流比率(early-arriving flow proportion,EAFP)。
使用自動圖像后處理系統(iSchemaView RAPID)計算MRI彌散和灌注掃描的缺血體積[5-6]。基于推注造影劑后從近端血管最大程度顯影到腦組織最大程度顯影的延遲時間(Tmax),系統自動計算出Tmax值不同的低灌注區域的體積,包括Tmax>4 s、Tmax>6 s、Tmax>8 s和Tmax>10 s,并自動獲得低灌注指數比(hypoperfusion intensity ratio,HIR)(HIR定義為Tmax>10 s/Tmax>6 s),其代表低血區域內的低灌注強度,是預測側支血流和腦梗死進展的指標[7-8](圖1)。
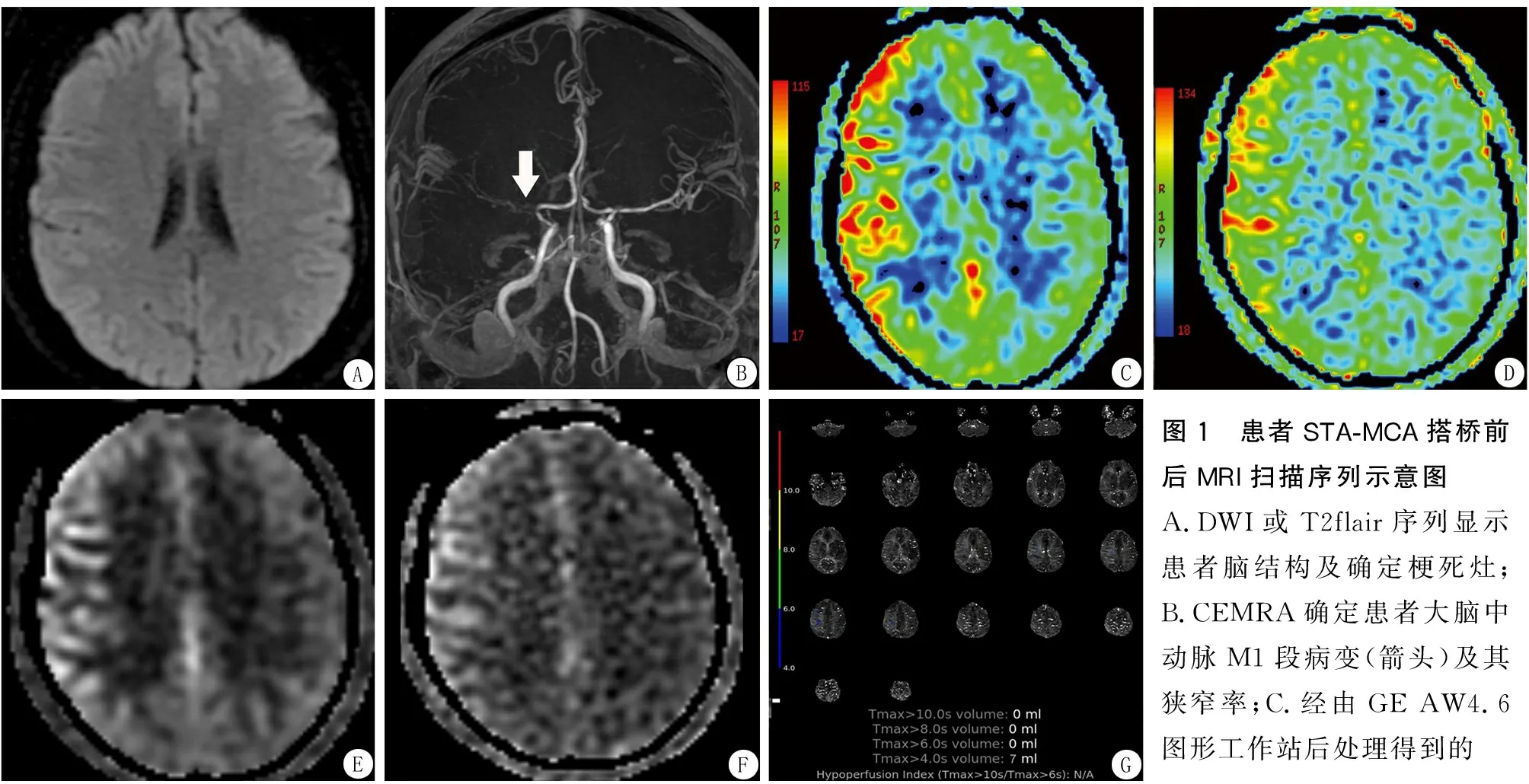
圖1 患者STA-MCA搭橋前后MRI掃描序列示意圖A.DWI或T2flair序列顯示患者腦結構及確定梗死灶;B.CEMRA確定患者大腦中動脈M1段病變(箭頭)及其狹窄率;C.經由GE AW4.6圖形工作站后處理得到的
1.3血管狹窄率確定 本研究采用Owen法[9]測量病變側MCA的M1段狹窄率:血管狹窄率=(1-狹窄段直徑/正常段直徑)×100。其中狹窄段直徑是指狹窄大腦中動脈M1段管腔最窄部分的直徑,正常段直徑代表病變側大腦中動脈M1段正常部分管腔的直徑。
1.4神經功能評分 無論此前是否做過神經功能評分,在MR檢查前的當日為患者記錄美國國立衛生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)評分。
1.5統計學方法 應用SPSS 25.0統計軟件分析數據,對患者的四個指標(EAFP、LARFP、HIR及NIHSS評分)進行配對樣本t檢驗,所有數據均行Shapiro-Wilk正態性檢驗,對服從正態分布的數據進行配對t檢驗,對不服從正態分布的數據進行Wilcoxon符號秩檢驗。P<0.05為差異有統計學意義。
2 結 果
搭橋術前及搭橋術后的EAFP、LARFP、HIR及NIHSS評分差異均有統計學意義(P<0.05),見表1,圖2。
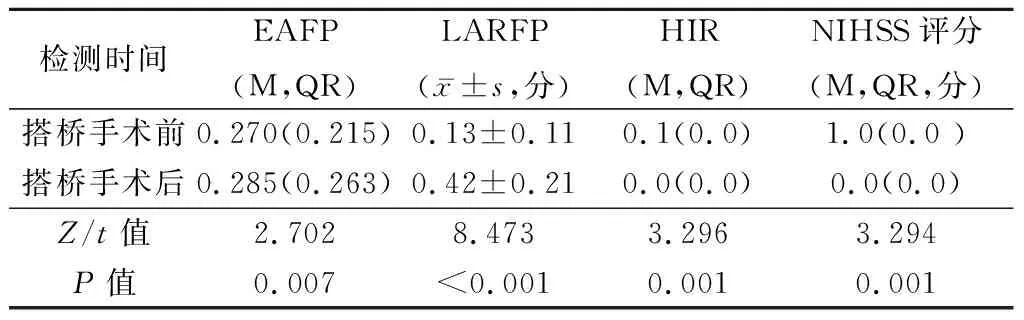
表1 患者搭橋手術前、后EAFP、LARFP、HIR及NIHSS評分
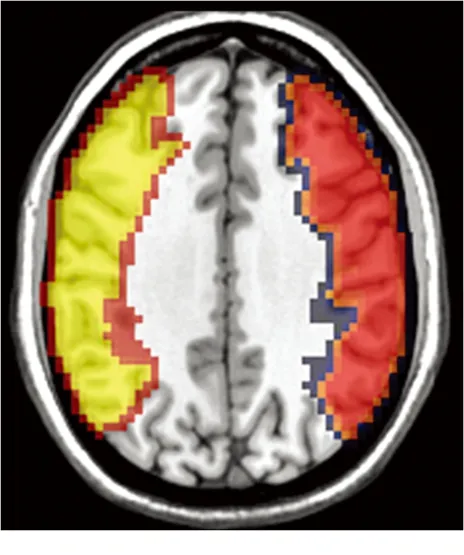
圖2 從AAL模板中提取的全腦雙側MCA區域蒙片的示意圖
3 討 論
多PLD的3D pCASL成像可以無創地將顱內的血流進行分類,量化主要受血管狹窄影響的順向血流和主要受側支循環影響的側支血流,而且可重復性強,這種量化血流的研究方法特別適合研究腦血流側支循環的狀態。STA-MCA手術是一種通過顱外動脈分支吻合顱內動脈狹窄主干遠端動脈分支,進而對顱內動脈供血區進行顱外-顱內血流代償的手術模式,研究報道,它可以使嚴重血流動力學失調患者的卒中風險降低54%[10]。使用如本研究中的多PLD的3D pCASL成像,來量化大腦中動脈M1段狹窄患者STA-MCA手術前、后的血流動力學變化是一個新的嘗試,可以發現搭橋手術對目標供血區腦組織順向與側支血流灌注產生的影響,進而對搭橋手術為患者腦血流動力學的改善帶來的收益進行精細的量化。
EAFP可以評估目標腦區內的早期到達血流的比率,單側大腦中動脈M1段嚴重狹窄對下游血流灌注所造成的最直接影響就是順向血流的減少,通過溶栓或者支架植入等直接改善狹窄的治療方式可以直接改善順向血流,但是在本研究中發現搭橋術中遠端分支血管的吻合同樣也會改善順向血流,本研究采用的兩個PLD分別是1.5 s和2.5 s,PLD 1.5 s時流入目標腦區的血流由于M1段的嚴重狹窄,會明顯減少,搭橋術后隨著遠端吻合動脈的開通,高流量的顱外動脈血流逆向流入大腦中動脈供血的目標腦區,雖然流速比M1段正常流入的血流速要低,流量要少,但是一部分血流也會在1.5 s以前經顱外動脈吻合支進入大腦中動脈供血區,所以會表現為EAPF的明顯增加,這與部分開通了M1段的狹窄管腔效果類似,只不過進入腦區的血流方向不同,更準確的說與正常的大腦中動脈供血方式比較這部分血流應該叫做以逆向流動方式早期流入供血區腦實質內的順向血流,當然,對這部分血流需要做進一步的研究來明確這種形式的順向血流與正常M1段的順向血流的差別。
STA-MCA手術的重要目標就是改善缺血腦區的腦血流儲備(cerebralvascular reserve,CVR)順向血流及側支血流的改善是CVR的改善的重要組成部分,但是目前還沒有很好的方法來準確地量化CVR的改善,本研究通過3D pCASL量化了順向和側支血流,通過Lyu的方法測量得到了LARFP,可以近似代表側支血流的狀態,本研究顯示,STA-MCA手術前后的LARFP有了明顯的改善,值得一提的是,對于單側大腦中動脈或者頸內動脈嚴重狹窄患者病變血管下游的腦組織具有一定的代償能力,這種代償能力的強弱及構成比較復雜,它可能與先天發育、血管狹窄病變形成的時間及腦血管病變的類型等等因素有關[11-12]。參照Lyu的方法,將病變側的血流分為早期到達血流,早期到達順向血流和晚期到達逆向血流,LARFP反映的就是其中的晚期到達逆向血流的比率,這一部分血流在理論上屬于純側支血流,STA-MCA術后LARFP的明顯提升完全來自PLD 1.5 s到2.5 s之間的這部分側支血流,這樣就量化了手術后患者的側支血流提高的比重。這部分血流與患者腦血管的先天發育情況及手術橋血管的部位也會存在一定的關系,但通過本研究表明,STA-MCA手術對提升患者病變腦區的側支血流具有重要意義。
除了采用Lyu的方法,本研究還使用Rapid自動灌注分析軟件對患者術前和術后的血流進行了量化比較。Rapid灌注分析軟件是目前唯一被美國食品藥物監督管理局批準的用于評估腦梗死進展及評價腦血流儲備的全自動分析軟件,它可以對顱內血流進行自動量化分類,并進行多個指標的測量分析,基于上述技術及相關的背景,本研究將3D pCASL與Rapid灌注分析軟件相結合來分析腦動脈搭橋術前后患者腦血流的改變。腦血管狹窄下游的腦組織并非完全按照程序化的模式進入腦損傷過程,研究表明很多患者無論是急性還是慢性腦缺血發生后會有自發的再灌注過程,這個過程也是側支血流及患者臨床預后的重要因素。HIR是預測缺血后腦組織的側支血流、缺血半暗帶及腦梗死損傷進展的指標,也是判斷治療風險的指標[13-16],本研究中手術前、后HIR的顯著差異表明無論是否存在核心的梗死區,術后Tmas>6 s的低血流灌注的腦區體積都較術前有所減少,STA-MCA手術降低了腦缺血進一步進展為腦梗死的風險。當然,Rapid灌注分析更多地應用在溶栓治療及其療效的評價中[17-18],但是通過研究表明對于很多慢性動脈血管閉塞的患者,仍然適合,但這種應用有一定的局限性,如對于存在血流動力學異常的慢性閉塞或狹窄患者,血流指標可能會超過Tmax的閾值,這有高估低灌注狀態的風險。但是針對本研究中患者的自身對照結果,HIR的改善足可以說明患者側支血流的改善和梗死進展風險的減低,這也是STA-MCA搭橋手術的收益所在。
通過EAFP、LARFP和HIR這三個指標的改善,患者的臨床癥狀得到了明顯的改善,NIHSS評分也在術前與術后有了不同程度的好轉,綜上所述,STA-MCA手術對單側大腦中動脈M1段狹窄患者腦血流灌注的改善是非常明顯的。
本研究的局限性:①樣本量小;②因為對諸如STA-MCA手術產生出血及再灌注損傷的研究還存在爭議,所以術后腦出血和高灌注綜合征的患者未納入本研究;③如前所述個體腦血流灌注存在差異,基于文獻的量化計算方法存在一定的局限性,PLD 1.5 s也可能包含一部分側支血流,而PLD 2.5 s測量的CBF并不完全為側支血流;另外,定量方法是假定病變側大腦中動脈供血區理想灌注狀態與患者正常側相同,但是患者正常側的血流灌注也可能存在變化;④部分患者病變血管下游腦血流緩慢造成的動脈到達偽影(artery transmit artifact,ATA)可能會影響興趣區的CBF值測量。
盡管仍需要進一步更大規模的研究,但通過本研究的數據表明,采用這種分類量化顱內動脈狹窄下游腦區的腦血流的方法,可能會作為對諸如STA-MCA手術這樣的針對顱內動脈狹窄或閉塞患者治療方法進行較為準確評估的手段,為臨床治療和患者預后的評價做重要的參考。

