AccuContour和United Imaging軟件自動勾畫胸部危及器官
曹世鵬,王大獎,王驍踴,陳天祿,沈九零,劉 暉,4*
(1.西藏大學理學院,3.宇宙線教育部重點實驗室,西藏 拉薩 850000;2.武漢大學中南醫院腫瘤放化療科,湖北 武漢 430071;4.武漢大學物理科學與技術學院,湖北 武漢 430072)
現代加速器的發展和強度調控放射治療的運用使放射治療(簡稱放療)中的輻射靶區劑量越來越趨于精準,這就要求對于勾畫目標及危及器官(organ at risk,OAR)需要有較高精確度,對目標體積和OAR進行精確的空間描述,在使腫瘤細胞獲得高度適形輻射劑量的同時保護健康組織,防止急性放射損傷及相關并發癥。傳統人工勾畫OAR方法耗時、費力,且觀察者內和觀察者間均存在差異[1]。隨著計算機算法的發展,大量自動勾畫軟件被開發出來[2],目前自動和半自動勾畫已達到較高精度,且可重復性強[3-4];主要包括基于圖譜的自動勾畫方法[5-6]和基于人工智能的自動勾畫方法[7-8],其臨床表現不盡相同[9]。本研究評價AccuContour和United Imaging軟件自動勾畫胸部OAR的差異。
1 資料與方法
1.1 數據來源 病例來源于癌癥影像檔案館(The Cancer Imaging Archive,TCIA)的公開數據集(http://doi.org/10.7937/K9/TCIA.2017.3r3fvz08.),包括來自3個機構的60例非小細胞肺癌患者(每個機構各20例),其中男33例,女27例,年齡37~92歲,共60個數據集。本研究以來自其中24例(男10例、女14例)的24個數據集作為測試數據集,每個數據集包括一組DICOM CT圖像文件和一個DICOM RTSTRUCT文件。胸部軸位CT掃描參數:層厚1 mm/2.5 mm/3 mm,層數103~279,FOV 50 cm×50 cm,重建冠狀位及矢狀位圖像,重建矩陣512×512。DICOM RTSTRUCT文件提供用于評估分割性能的手動勾畫輪廓;OAR包括心臟、左肺、右肺、食管和脊髓。由1名主任醫師對手動勾畫的輪廓進行質量檢查,并加以編輯,使其盡可能符合RTOG 1106輪廓指南[10]。所選數據集均未用于開發兩種待評估軟件。
1.2 自動勾畫軟件 AccuContour 3.0自動勾畫軟件由Manteia數據科技有限公司開發,為基于人工智能深度學習的自動勾畫軟件,通過建立圖像分割模型,并基于一定量的訓練數據集對模型進行訓練;對訓練所得模型的驗證參數進行分析,選取訓練效果最佳的訓練模型作為最終的OAR自動勾畫模型。
United Imaging勾畫軟件由上海聯影智能醫療科技有限公司開發,是基于聯影智能自主研發的分割算法開發研制的自動勾畫系統,支持全自動分割OAR和靶區,完成以大量訓練數據集進行的訓練后投入臨床使用。上述2種軟件均由軟件公司訓練完成,并獲得正版授權許可。
1.3 評估參數 采用MIM 6.7.14軟件,獲取勾畫時間、豪斯多夫距離(Hausdorff distance,HD)、形狀相似性指數(dice similarity coefficient,DSC)及平均最小距離(mean distance to agreement,MDA);以測試數據集中人工勾畫的OAR輪廓作為“金標準”,評價自動勾畫OAR輪廓的準確性。
HD用于度量體積輪廓中2個輪廓(A和B)之間的最大失配程度;二維平面中,HD為2個子集之間最近點所有距離中的最大值,對輪廓之間個別部位的差異尤為敏感,其值越小,代表勾畫效果越優[11],見公式(1)。DSC用于度量標準體積重疊,通過計算2個輪廓(A和B)之間相互重疊部分的體積與2個輪廓體積之和的比值來描述輪廓之間的重合程度,其值越大代,表勾畫效果越優[2,11],見公式(2)。MDA是代表每個體素從一個結構(A)表面到另一個結構(B)表面的平均最短距離的幾何參數[12],理想情況下MDA=0,見公式(3)。

(1)

(2)
MDA(A,B)=

(3)
1.4 統計學分析 采用SPSS 26.0統計分析軟件。以±s表示服從正態分布的計量資料,采用配對t檢驗比較各參數差異;以中位數(上下四分位數)表示不服從正態分布的計量資料,采用Wilcoxon秩和檢驗比較各參數差異。P<0.05為差異有統計學意義。
2 結果
2.1 AccuContour軟件 平均勾畫時間(37.271±6.166)s;食管和脊髓的DSC較低,中位數分別為0.692和0.767,且MDA中位數>2.0 mm;心臟和左、右肺DSC中位數均>0.9,左、右肺MDA中位數<2.0 mm,心臟平均MDA稍高,為(2.385±0.747)mm;HD中位數在心臟最低(15.003 mm),在脊髓最高,為45.248 mm,見表1。自動勾畫的心臟和肺與輪廓手動勾畫輪廓的重合度較好;食管、脊髓勾畫效果相對較差,手動勾畫輪廓中,脊髓下緣延伸至L2下緣或脊髓最下端,而自動勾畫方法對于下端層面勾畫不足,僅顯示胸椎范圍內的脊髓,見圖1。
2.2 United Imaging軟件 平均勾畫時間為20.333±1.195)s;食管和脊髓的DSC較低,中位數分別為0.790和0.789,且脊髓MDA中位數>3.0 mm;心臟平均DSC>0.8,其平均MDA稍高,為(3.434±1.106)mm;左、右肺DSC中位數均>0.9,且MDA<2.0 mm;食管的HD中位數最低(11.898 mm),脊髓最高,為46.572 mm,見表1。自動勾畫的心臟邊界中包含更多血管層面;肺部的自動勾畫與手動勾畫邊界重合度好,但未排除肺部氣管和腫瘤;自動勾畫對于食管上下界的識別不穩定,輪廓勾畫效果稍差;自動勾畫脊髓效果較差,上緣超出手動勾畫包含的全部脊髓范圍較多,見圖1。

圖1 患者男,非小細胞肺癌 A~C.依次為AccuContour軟件(藍色)與手動勾畫(紅色)的軸位(A)、矢狀位(B)及冠狀位(C)胸部CT圖像中的OAR;D~F.依次為United Imaging軟件(黃色)與手動勾畫(紅色)的軸位(D)、矢狀位(E)及冠狀位(F)胸部CT圖像中的OAR
2.3 差異分析 United Imaging軟件勾畫時間明顯短于AccuContour軟件(t=-14.781,P=0.005)。2種軟件勾畫心臟的HD、DSC及MDA差異均有統計學意義(P均<0.05)。United Imaging軟件勾畫的左肺DSC明顯大于AccuContour軟件(P<0.05)、MDA明顯小于AccuContour軟件(P<0.05);AccuContour軟件勾畫的右肺HD明顯小于United Imaging(P<0.05)。2種軟件勾畫的食管HD、DSC及MDA差異均有統計學意義(P均<0.05),勾畫脊髓的各項參數差異均無統計學意義(P均>0.05),見表1。
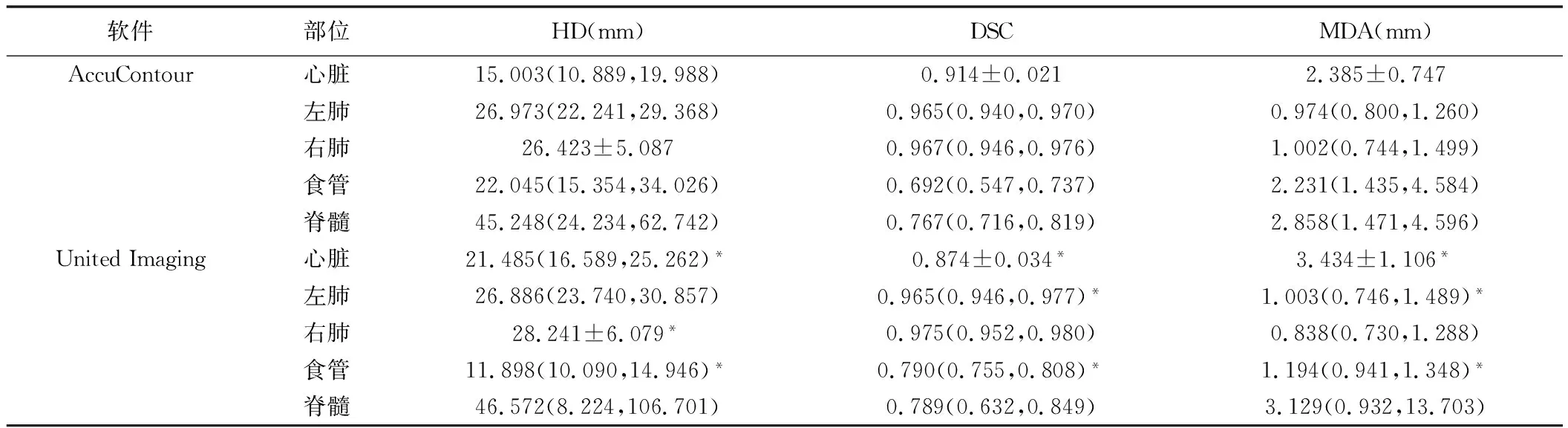
表1 AccuContour與United Imaging自動勾畫軟件勾畫OAR的準確度比較
3 討論
自動勾畫軟件的出現使得放療效率獲得大幅提升,但不同軟件之間勾畫結果的差異可能影響放療計劃中的劑量計算結果和對OAR的保護。勾畫體積的增多勢必造成對OAR可耐受劑量的高估。本研究結果顯示,2種軟件對肺部的勾畫效果最佳,DSC均>0.95,DSC>0.7即表明2個輪廓重復性尚可,分割效果可接受[13];2種軟件勾畫心臟的效果表現較好,但United Imaging自動勾畫的上邊界包含了更多的血管層面,與手動勾畫的上邊界符合度較差,平均MDA稍高為(3.434±1.106)mm。對比分析發現,AccuContour軟件勾畫心臟及右肺的效果優于United Imaging,United Imaging軟件勾畫左肺的效果優于AccuContour。
根據RTOG 1106指南[10],脊髓勾畫輪廓的上緣延伸至環狀軟骨的上方或環形軟骨下緣,下緣延伸至L2的下緣。2種軟件勾畫食管和脊髓的效果較差,HD均較高,AccuContour軟件自動勾畫食管的DSC為0.692,低于0.7;United Imaging軟件勾畫脊髓上下界普遍超出手動勾畫,AccuContour軟件勾畫脊髓上下界范圍則小于手動勾畫。脊髓的耐受量存在體積效應,脊髓勾畫過多或過少將造成體積效應的低估或高估。對比分析發現,United Imaging軟件勾畫食管的效果優于AccuContour;2種軟件勾畫脊髓效果無顯著差異。2種軟件勾畫邊界的差異可能受訓練數據集和勾畫算法的影響。因此,在自動勾畫軟件的訓練過程中,訓練數據集的選擇和處理顯得尤為重要。根據勾畫部位不同,結合勾畫指南精確確定訓練集中OAR的勾畫邊界可能將得到更好的訓練結果,進而減少對自動勾畫結果的手動編輯。
本研究中,United Imaging軟件耗時較AccuContour更少,但秒級的時間差別在臨床工作中實際意義較小,大部分結構的自動勾畫結果均需手動調整后才能用于臨床。因此,自動勾畫的軟件勾畫時間和所需的手動修改時間總和對評價勾畫軟件的勾畫能力更有意義,是未來需進一步探究的方向。
綜上,不同軟件的差異受軟件所用算法、訓練數據集以及訓練強度的影響,AccuContour3.0和United Imaging軟件自動勾畫效果在不同部位的表現存在差異且各有所長;二者勾畫肺部和心臟效果較好,食道和脊髓效果稍差。本研究缺乏定性評價研究,定性評價自動勾畫達到臨床可接受標準所需的編輯時間以及自動勾畫輪廓對劑量分布的影響是未來進一步探究的方向。此外,如何結合機構的需求選擇合適的軟件、結合機構內數據集和多機構數據集對自動勾畫軟件做進一步訓練也需進一步探討。

