α-1,6-巖藻糖基轉移酶的生物信息學分析
王子豪, 錢榮凱, 蘇林杰, 賈 寧, 孫欽儒
(1.西安交通大學醫學部, 西安 710061; 2.西安交通大學醫學部基礎醫學院, 西安 710061; 3.西安交通大學醫學部法醫學院, 西安 710061)
哺乳動物擁有復雜的基因表達調控機制,其中翻譯后修飾是重要的調控方式,可以快速改變蛋白質的生物學性質。蛋白質糖基化通過產生具有不同特性的多種糖蛋白極大地放大了蛋白質組的功能,在哺乳動物細胞的識別[1-2]、增殖[3]以及代謝活動[4]中均具有重要的作用。
大多數蛋白質通過14種不同糖基化途徑中的一種或多種進行修飾,包括N-糖基化、11種O-糖基化、C-甘露糖基化和GPI錨定蛋白,這些途徑在人類中涉及至少173種糖基轉移酶以及許多其他修飾聚糖的酶[5]。對于N-糖基化,糖鏈通過共價作用結合在目標蛋白的天冬酰胺殘基[6]。其中,核心巖藻糖糖基化是較常見的一種方式,由GDP-巖藻糖(GDP-fucose)作為供體,在α-1,6-巖藻糖基轉移酶(α-1,6-fucosyltransferase, FUT8)的催化下,將巖藻糖殘基共價連接至位于目標蛋白糖鏈核心最內側的N-乙酰氨基葡萄糖(GlcNAc),從而形成α-1,6-糖苷鍵,完成核心巖藻糖糖基化[7-8]。
多項研究表明,FUT8介導的核心巖藻糖糖基化與上皮組織再生、神經炎癥、乳腺癌及肺癌等多種疾病相關[9],細胞內的多種代謝及信息傳遞途徑受其調節。然而,FUT8的作用機制還不甚清楚,Wang等[10]認為FUT8可以調節表皮生長因子受體與其配體的親和力。另有實驗表明,抑制FUT8可導致細胞對促炎細胞因子(如IFN-γ和IL-6)的敏感性增加[11-12]。這些研究雖然探索了FUT8的部分作用,但是對于全面揭示FUT8的生物學特性還遠遠不夠,近年來的生物信息學的蓬勃發展為蛋白質結構和功能的研究打開新的大門。因此,現利用生物信息學分析fut8基因的結構及表達特點;分析FUT8的結構和功能特征、蛋白質作用網絡關系及其參與的蛋白質通路,為進一步研究該蛋白在肥胖及相關疾病、腫瘤轉移、炎癥及免疫和造血異常中的作用以及相應藥物的研發提供分子依據。
1 材料與方法
1.1 材料
所用fut8基因及其轉錄產物序列來自NCBI網站的GenBank數據庫。產物蛋白FUT8的一級序列信息源自NCBI網站的GenPept數據庫,空間結構數據來自PDB數據庫。
1.2 方法
通過ExPASy網站旗下ProtParam分析工具預測FUT8蛋白的理化性質;使用TMHMMServer和SignalP-5.0在線數據庫預測FUT8蛋白的跨膜區段和信號肽信息;使用Prabi數據庫下的SOPMA和GOR4兩種分析引擎推斷FUT8蛋白的二級結構元件;通過在線數據庫網站STRING研究蛋白質FUT8的分子相互作用關系(PPI分析),KEGG Pathway數據庫分析蛋白質通路(KEGG分析);利用BLAST在線工具進行蛋白序列比對并獲取保守位點,DNAMAN軟件繪制分子進化樹圖。
2 結果與分析
2.1 fut8基因結構及特點
人類fut8基因定位于14號染色體長臂2區3帶3亞帶(14q23.3),外顯子合計共16個,其中編碼序列含外顯子9個,其拼接關系如圖1所示。
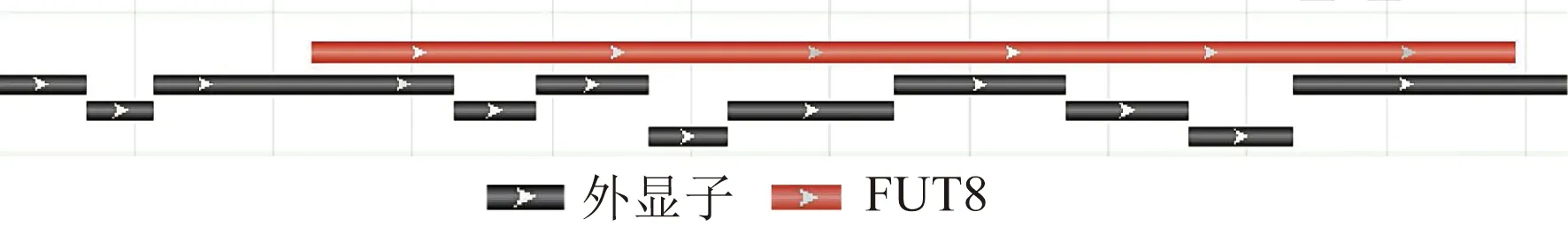
圖1 FUT8編碼序列外顯子拼接關系 Fig.1 FUT8 coding sequence exon splicing relationship
人類fut8基因轉錄產物共有7種,分別稱為變體1~6,其中變體6又根據長度不同分為兩種,除變體5為非編碼序列外,其余均編碼不同的同工酶。FUT8同工酶分a、b、c三種,各剪接變異體及其編碼產物如表1。變體1又稱為變體B6,全長3 895 bp,編碼較長的同工酶即同工型a,含氨基酸數575個,后文分析所用均為變體1及其翻譯產物同工酶a。
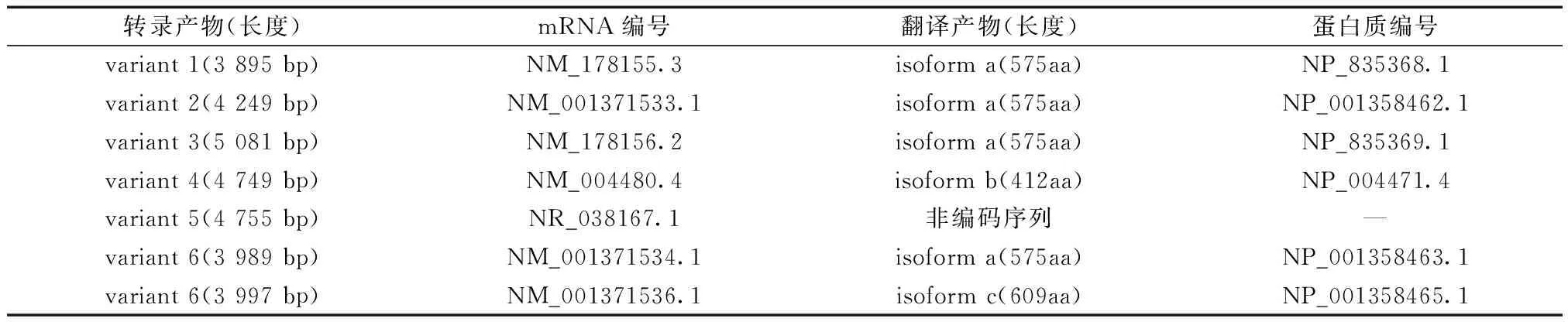
表1 各剪接變異體及其編碼產物關系Table 1 Relationship between splice variants and coding products
2.2 FUT8蛋白的理化性質分析
FUT8蛋白分子式為C2986H4636N838O856S17,原子總數9 333個,分子量為66 515.78 D,理論等電點7.36。其中酸性氨基酸殘基77個,堿性氨基酸殘基77個,為弱堿性蛋白質分子。亮氨酸為含量最豐富的氨基酸,占到整個氨基酸組成的9.7%。
FUT8在哺乳動物的網織紅細胞中半衰期為30 h,不穩定系數為42.22,因此認為是不穩定蛋白質。根據推斷,理論脂肪系數為84.56,平均親水性(GRAVY)達-0.551,故將FUT8認為是親水性蛋白質。
2.3 蛋白的跨膜區域分析
通過TMHMMServer在線分析預測,如圖2所示,FUT8蛋白序列存在理論跨膜區段6個。綜合考慮可信度最高的模型為單次跨膜結構,即由17個疏水氨基酸構成的由內向外的跨膜區段,范圍從第10~26位氨基酸,總得分2 561分。使用SignalP-5.0在線工具分析,FUT8不存在信號肽序列。
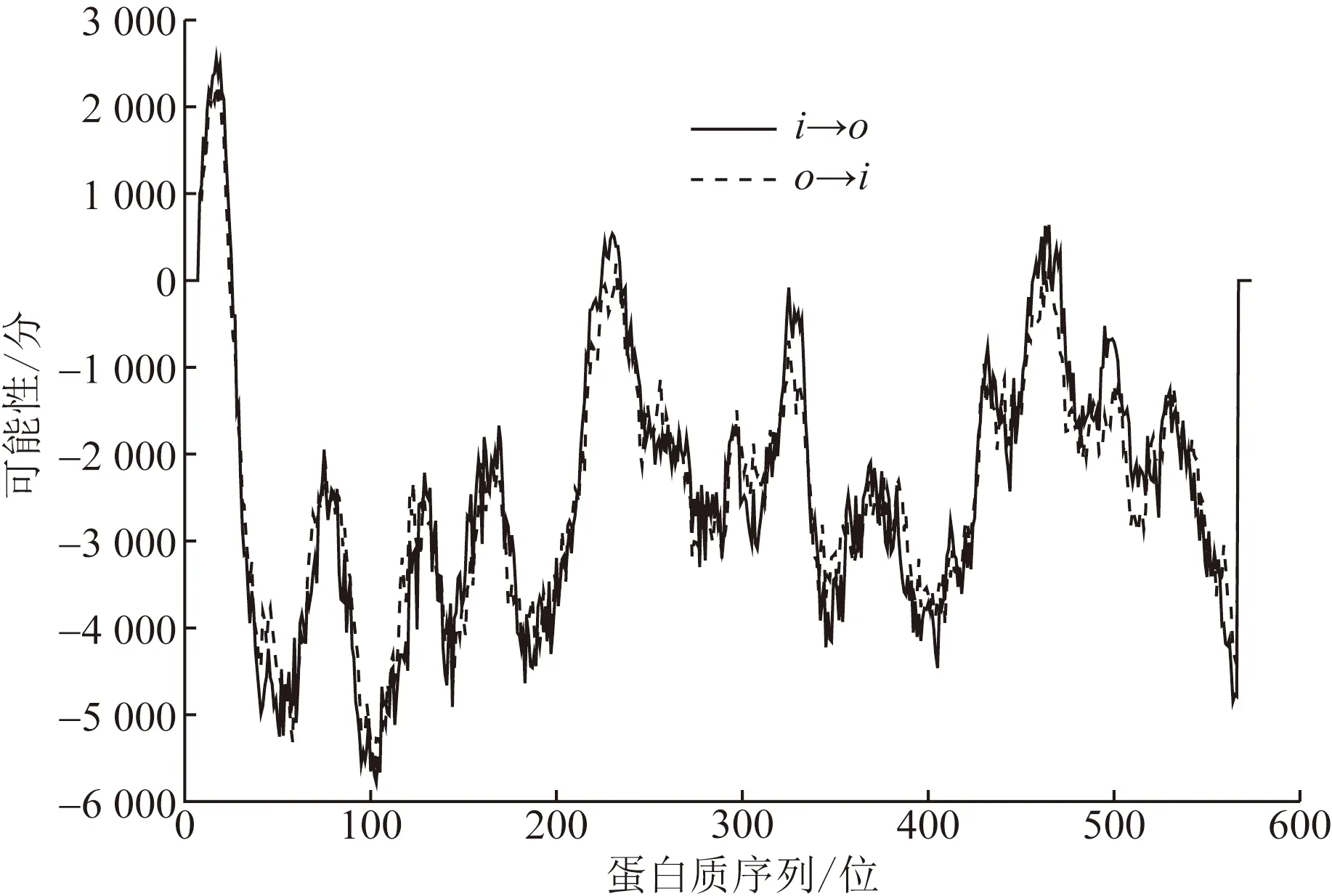
i→o為跨膜由內向外;o→i為跨膜由外向內圖2 FUT8蛋白跨膜區段分析結果Fig.2 Analysis of transmembrane segment of FUT8 protein
2.4 FUT8蛋白的空間結構分析
使用Prabi網站旗下SOPMA工具得出結果如圖3所示,該多肽鏈中α螺旋結構占48.00%,為最主要的結構元件,β片層占12.52%,β轉角占4.35%,無規則卷曲占35.13%。而GOR4工具沒有將β轉角納入考慮,認為在FUT8蛋白序列中α螺旋和β片層結構分別占32.17%和22.09%,無規則卷曲則占到了45.74%。

圖3 FUT8蛋白分子二級結構分析Fig.3 Secondary structure analysis of protein FUT8
FUT8的三級結構如圖4所示,共有4個結構域,分別為氨基端胞漿域、跨膜區、莖區以及羧基端催化域。
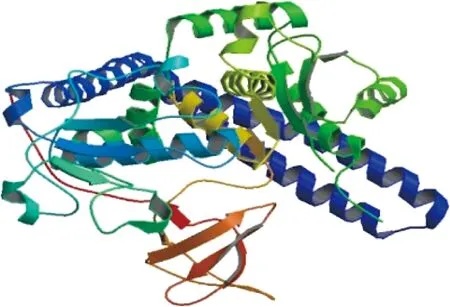
圖4 蛋白質分子FUT8的三級結構Fig.4 Tertiary structure of protein molecule of FUT8 protein
2.5 蛋白的分子相互作用分析
FUT8與B4GALT3、B4GALT1、MGAT3、MGAT4D、MGAT2等有著密切的互相聯系,如圖5所示。
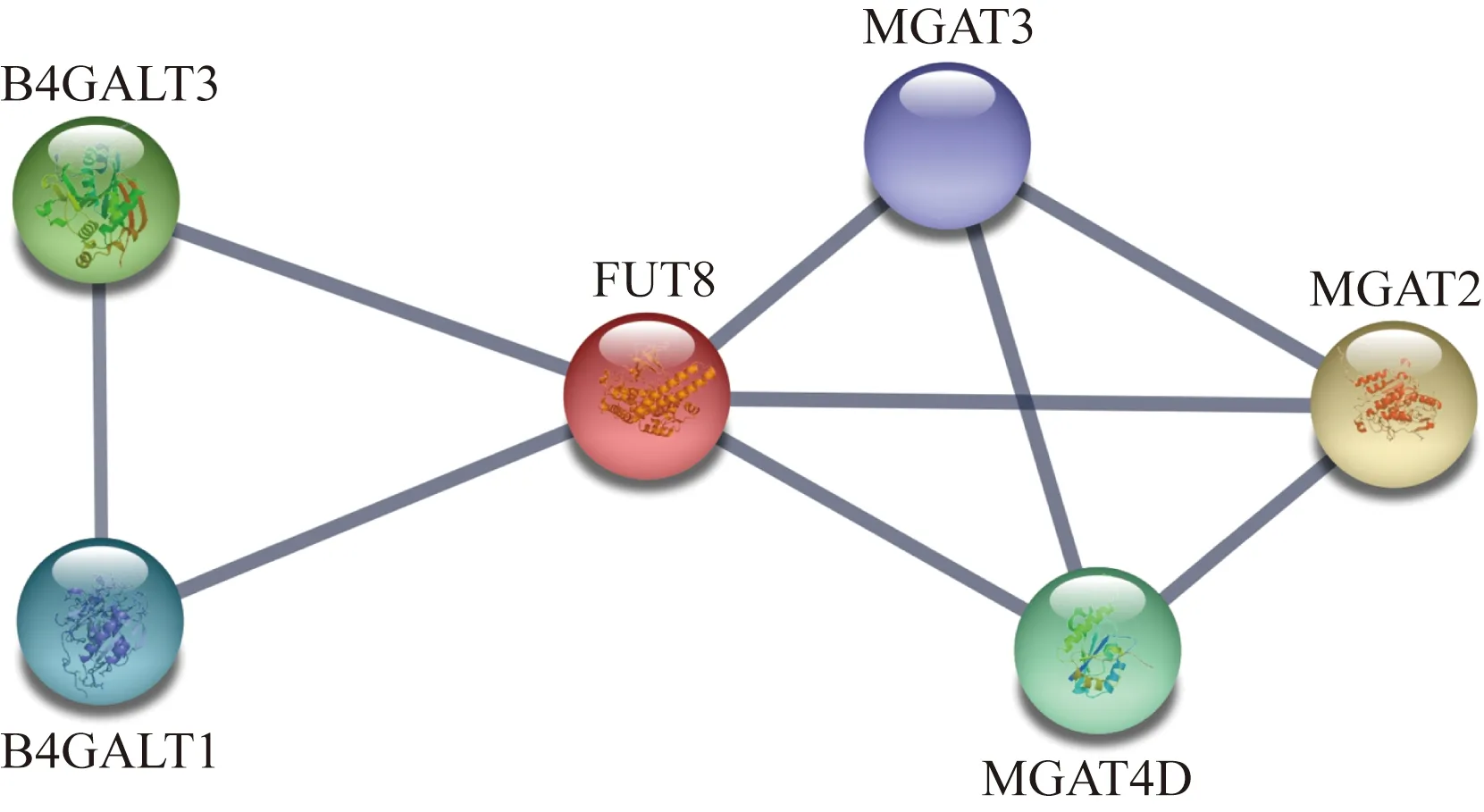
圖5 FUT8蛋白分子相互作用關系Fig.5 Protein-protein interaction (PPI) of FUT8 protein
B4GALT3又稱β-1,4-半乳糖基轉移酶3,負責在多種糖蛋白以及糖脂的糖鏈部分中添加較為復雜的N-連接寡糖鏈。
B4GALT1又稱β-1,4-半乳糖基轉移酶1,在哺乳期乳腺腺泡細胞高爾基復合體中催化乳糖的產生,同時參與其他N-連接寡糖鏈的形成。
MGAT3又稱β-1,6-N-乙酰氨基葡萄糖基轉移酶3(GnT-Ⅲ),參與糖鏈的生物合成和調節,催化N-乙酰氨基葡萄糖添加到N-連接糖鏈的三甘露糖核心上形成β-1-4糖苷鍵。是糖蛋白生物合成調控過程中的最重要的酶之一。
MGAT4D又稱α-1,3-甘露糖基糖蛋白4-β-N-乙酰氨基葡萄糖轉移酶,屬于糖基轉移酶54家族。定位于高爾基體中,在精母細胞和精子中高表達。
MGAT2又稱α-1,6-甘露糖基糖蛋白2-β-N-乙酰氨基葡萄糖轉移酶或N-乙酰葡糖氨基轉移酶Ⅱ,參與催化低聚甘露糖轉化為復雜N-聚糖的關鍵步驟。
2.6 蛋白質通路分析
聚糖不是主要的基因產物,與蛋白質相比,它們的合成是在沒有模板的情況下進行的。圖6展示了核心巖藻糖生物合成的三個步驟,首先進行的是N-連接糖蛋白前體的合成,隨后前體末端的幾個糖基將被逐漸水解,并裝配出糖鏈的核心結構,之后多種糖基轉移酶相繼將寡糖基轉移至核心結構上從而使糖基得以延長。FUT8則將巖藻糖殘基轉移至糖鏈核心最內側的N-乙酰氨基葡萄糖(GlcNAc)上,最終形成α-1,6-糖苷鍵。

圖6 核心巖藻糖基化形成過程 Fig.6 Core fucosylation formation process
2.7 FUT8的序列比對及保守性分析
通過對蛋白序列的比對分析,發現其在不同物種間高度保守,圖7和圖8分別展示了FUT8的保守結構域和分子進化樹。人與黑猩猩FUT8蛋白序列幾乎完全相同,與大鼠、小鼠相似度高達96.7%和96.5%,與雞、熱帶爪蟾及東方果蠅FUT8蛋白序列相似度分別為93.9%、90.1%和46.1%。

圖7 FUT8蛋白序列保守位點Fig.7 Protein sequence conserved site of FUT8
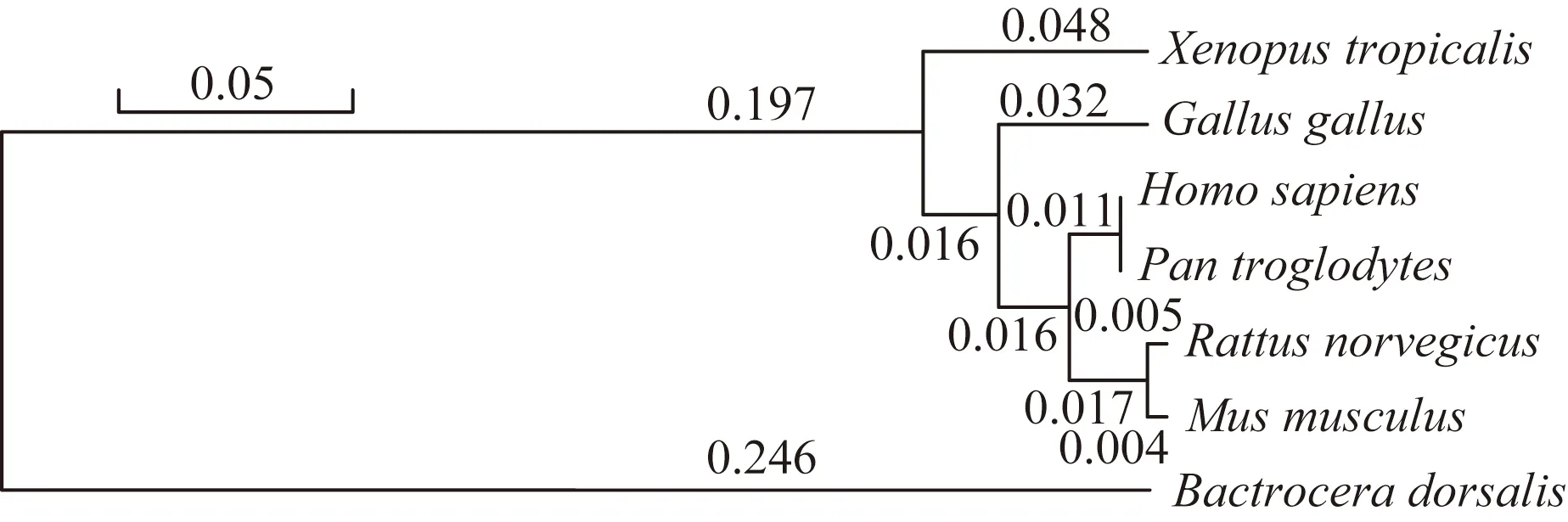
圖8 FUT8蛋白分子進化樹Fig.8 The phylogenetic tree of FUT8
3 討論
FUT8是哺乳動物體內唯一的N-連接的核心巖藻糖基轉移酶[13],本研究利用生物信息學分析方法,得知人fut8基因位于14號染色體長臂2區3帶3亞帶,編碼序列共有外顯子9個,轉錄產物共有剪接變異體5種,其中最主要的變體長度為3 895 bp,其翻譯產物含氨基酸575個,為弱堿性、親水性的蛋白質,細胞內不穩定,存在由內向外的跨膜區段,α螺旋是最主要的二級結構元件。序列比對發現,從非哺乳動物到人的不同物種中FUT8蛋白高度保守,且其在不同哺乳動物間的差別較其他巖藻糖轉移酶小[14],因此推測FUT8較其他巖藻糖轉移酶分化晚。
FUT8與多種蛋白質及受體相互作用,廣泛參與調節細胞內的多種代謝及信息傳遞途徑。蛋白分子的相互作用分析結果顯示,FUT8與B4GALT1、B4GALT3,以及MGAT2、MGAT3、MGAT4D的作用密切相關。B4GALTs是一類進化保守的半乳糖基轉移酶,作為穿膜蛋白定位于高爾基/反面高爾基網狀結構,參與蛋白折疊、細胞相互作用和免疫抵抗等生物過程[15-16]。最近的研究發現,FUT8與B4GALT1都可以通過糖基化免疫球蛋白G(IgG)而調節其作用[17],具體機制還有待于進一步的實驗驗證;體外實驗證下調FUT8的表達,同樣可通過改變IgG的糖基化進而對炎癥疾病產生影響[18]。MGAT2是三酰甘油在體內吸收和積累途徑中的關鍵酶,此過程在肥胖及其相關疾病的發生中起重要作用[19];FUT8與MGAT2均參與尿素轉運蛋白A-1(UT-A1)的糖基化,從而調節腎的尿素轉運活性,與糖尿病人滲透性利尿癥狀的減輕有關[20]。MGAT3可以抑制上皮-間充質轉化,從而抑制腫瘤的轉移[21];FUT8和MGAT3的高表達均可易化急性髓性白血病細胞(KG1a細胞)對缺氧的敏感性而啟動p53依賴性細胞凋亡[22]。全基因組關聯分析也發現fut8和MGAT4D的編碼基因mgat4d均與高血壓的發生相關[23-24],提示這兩者之間可能存在密切聯系。這些結果表明,FUT8與B4GALTs、MGATs可能具有協同作用,具體機制還需要進一步的研究證明。
利用生物信息數據庫及工具成功獲取人FUT8蛋白的理化性質、理論跨膜域信息、立體結構,以及其與多種蛋白通路及其的相互作用網絡,為深入未來進一步研究FUT8在肥胖及相關疾病、腫瘤轉移、炎癥及免疫和造血異常中的作用提供重要的理論依據。

