鹽酸丙美卡因滴眼液處方工藝研究
文強,徐小彬
1.江西珍視明藥業有限公司,江西 撫州 344000;2.江西省藥品檢查員中心贛北藥品檢查所,江西 上饒 334100
鹽酸丙美卡因滴眼液為眼科手術及眼科檢查的表面麻醉用藥,原研生產企業為美國Allergan 公司。本論文中研究處方參照美國Allergan 公司研制生產的商品名為OPHTHETIC?的鹽酸丙美卡因滴眼液的說明書。本論文中規格參照美國Allergan 公司研制生產的商品名為OPHTHETIC?的鹽酸丙美卡因滴眼液和美國 Alcon 公司研制生產的商品名為ALCAINE?的鹽酸丙美卡因滴眼液。
1 儀器與試藥
1.1 儀器
島津LC-10ATVP 泵,島津SPD-10AVP 檢測器,TL-9900 色譜數據工作站,ST3100 酸度計,MS205DU 電子天平,OM815 微量冰點滲透壓儀,LDZH-100KBS 立式蒸汽壓力滅菌器,NDJ-1 旋轉式黏度計,S312 數顯恒速攪拌器,SC-1513 數控超級恒溫槽,RXZ 型智能人工氣候箱。
1.2 試劑試藥
鹽酸丙美卡因(安徽省慶云醫藥化工,批號181101,藥用級別,含量98.6%),磷酸二氫鉀(分析純,北京益利精細化學品公司),庚烷磺酸鈉(色譜純進口),三乙胺(色譜純,進口),甲醇(色譜純,北京益利精細化學品公司),苯扎氯銨(泰柯棕化公司,批號180502,藥用級別),甘油(浙江遂昌惠康藥業,批號181003,藥用級別),氯化鈉(江蘇省勤奮藥業,批號180503,藥用級別),氫氧化鈉(成都華邑藥用輔料制造有限公司,批號180501,藥用級別)。
2 處方工藝依據
2.1 規格的制定
本品的規格參照美國Allergan 公司研制生產的商品名為OPHTHETIC?的鹽酸丙美卡因滴眼液和美國Alcon 公司研制生產的商品名為ALCAINE?的鹽酸丙美卡因滴眼液。OPHTHETIC?和ALCAINE?的規格均為每15 mL 含75 mg 鹽酸丙美卡因,故確定本品的規格為每15 mL 含75 mg 鹽酸丙美卡因。
2.2 處方工藝的篩選與確定
美國Allergan 公司研制生產的商品名為OPHTHETIC?的鹽酸丙美卡因滴眼液的說明書中指出其制劑處方組成中輔料有苯扎氯銨、甘油、氯化鈉、鹽酸溶液/氫氧化鈉溶液和水。其中,苯扎氯銨作為抑菌劑[1],甘油作為增稠劑[2],氯化鈉作為等滲劑,鹽酸溶液/氫氧化鈉溶液起到調節溶液pH的作用[3],水為溶劑。參照OPHTHETIC?的鹽酸丙美卡因滴眼液的處方組成,并結合理論滲透壓的計算[4],分別設計處方如下,見表1。
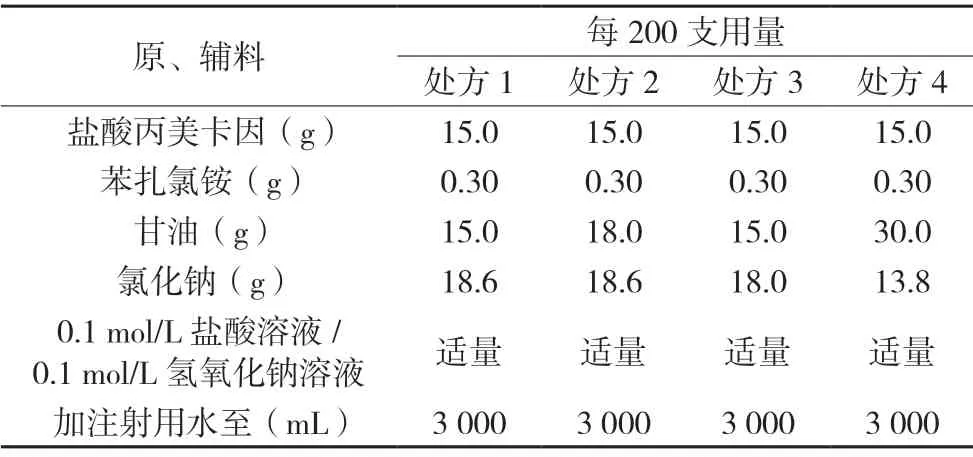
表1 鹽酸丙美卡因滴眼液處方篩選[5]
初步工藝:稱取處方量的原輔料于適量的注射用水中,攪拌至完全溶解,用0.1 mol/L 鹽酸溶液或0.1 mol/L 氫氧化鈉溶液調節溶液pH,定容。
2.2.1 理論滲透壓計算和實際滲透壓的檢測 根據毫滲透壓摩爾濃度計算公式:
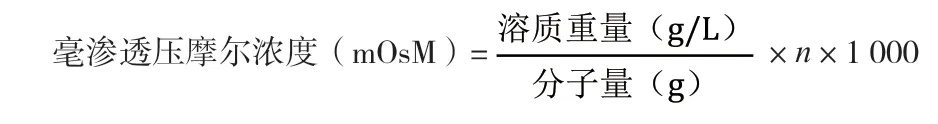
可計算上述4個處方的滲透壓,滲透壓計算結果見表2。
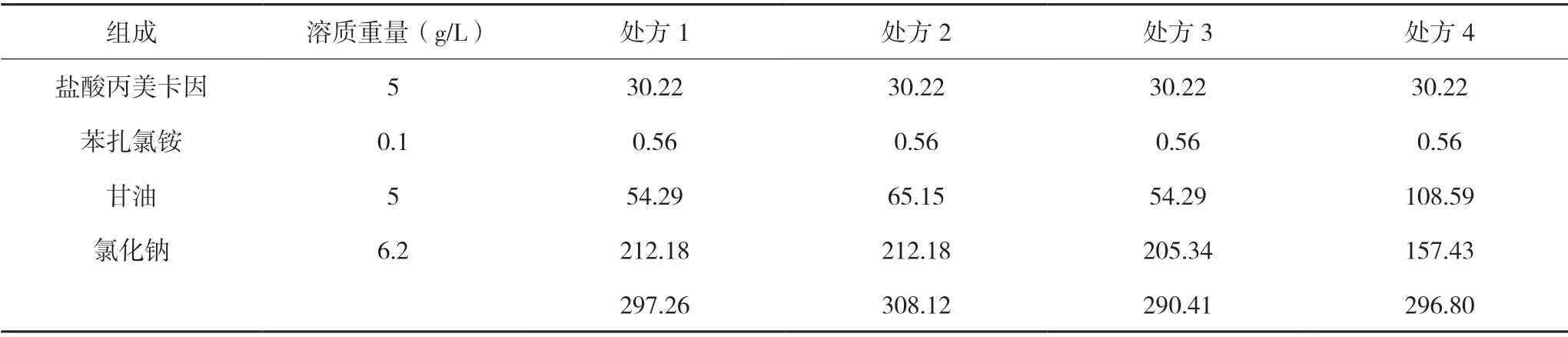
表2 處方1至處方4理論滲透壓計算結果(mOsM)
由于已知正常等滲范圍約為280 mOsM~310 mOsM,因此根據以上計算結果可知,4個處方的理論滲透壓基本等滲,處方1 是正常滲透壓的1.00 倍(血漿滲透壓平均值為298 mOsM),處方2 是正常滲透壓的1.03 倍,處方3 是正常滲透壓的0.97 倍,處方4 是正常滲透壓的1.00 倍。
根據稀溶液的依數性,冰點相同的溶液具有相同的滲透壓。因此,可以通過測定樣品的冰點,來考察其滲透壓。樣品和國外產品(ALCAINE?)的冰點測定結果見表3。
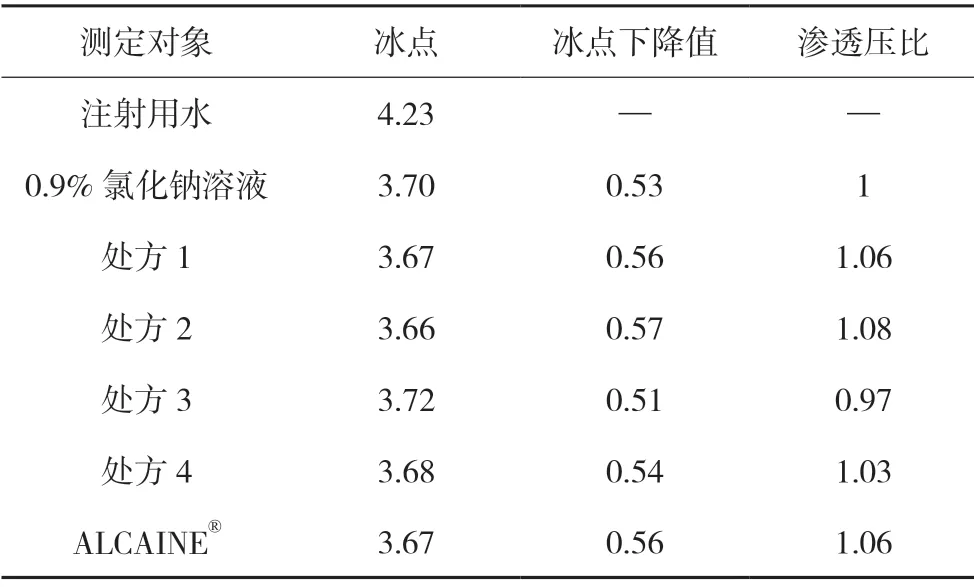
表3 冰點測定結果
由上述測定結果可知:處方1 的滲透壓約為0.9%氯化鈉溶液的1.06 倍,處方2 的滲透壓約為0.9%氯化鈉溶液的1.08 倍,處方3 的滲透壓約為0.9%氯化鈉溶液的0.97 倍,處方4 的滲透壓約為0.9%氯化鈉溶液的1.03 倍,國外產品(ALCAINE?)的滲透壓約為0.9% 氯化鈉溶液的1.06 倍,均滿足眼球能適應的滲透壓范圍(相當于濃度為0.6%~1.5%的氯化鈉溶液),但處方1、2 和4 的滲透壓與國外產品更接近。
2.2.2 pH 的考察 測定美國Alcon 公司研制生產的商品名為ALCAINE?的鹽酸丙美卡因滴眼液的pH,結果為4.95。參照測得的國外產品pH 值范圍,結合滴眼劑的PH 值對主藥的溶解性、穩定性及眼黏膜的影響因素[3],鹽酸丙美卡因在弱酸性溶液中的溶解性和穩定性更佳,另一方面也考慮到正常人眼可耐受pH 為5~9,從而確定本品pH 約為5.0。
2.2.3 黏度的測定 取本品適量,用NDJ-1 型旋轉式黏度計1 號轉子60 r/min,測試溫度為20 ℃±0.1 ℃,以旋轉式黏度計測定[4]。樣品和國外產品(ALCAINE?)的黏度測定結果見表4。

表4 黏度測定結果
根據黏度測定結果可知,處方1~處方4 的黏度和國外產品的黏度相當,但處方1、3 的黏度與國外產品的黏度更接近。
綜合以上pH 考察結果、理論滲透壓計算結果、實際滲透壓的測定結果以及黏度的測定結果,確定處方1 為最終處方。
3 影響因素試驗
參照藥物穩定性試驗指導原則[4],采用確定的處方和工藝制備一批樣品,批號為190501,批量為500 支,進行制劑的影響因素試驗,包括高溫60 ℃試驗、高溫40 ℃試驗、高溫30 ℃試驗和強光照射試驗(4 500 lx±500 lx)。于第5 天和第10 天分別取樣,進行檢測。結果見表5。
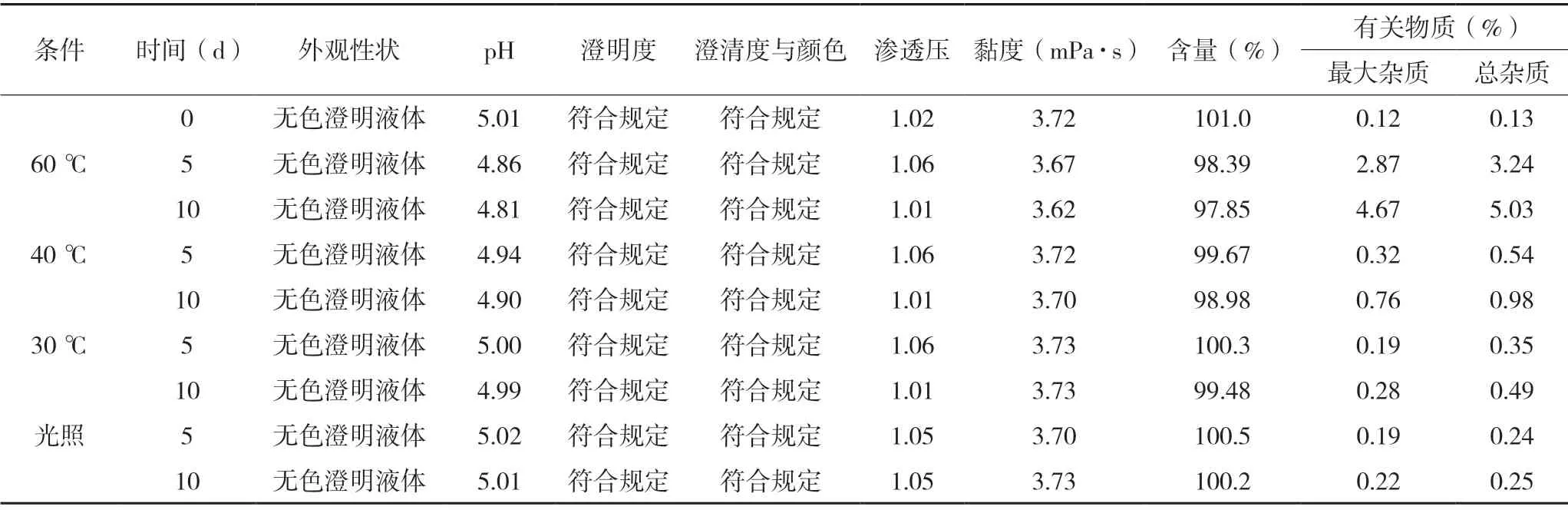
表5 鹽酸丙美卡因滴眼液影響因素試驗結果
結果表明:鹽酸丙美卡因滴眼液在高溫60 ℃條件下放置10 d 后,pH 和黏度明顯降低,有關物質明顯增長,含量下降,其余各項指標無明顯變化,說明本品在高溫60 ℃條件下不穩定;在高溫40 ℃條件下放置10 d 后,pH 明顯降低,有關物質明顯增長,其余各項指標無明顯變化,說明本品在高溫40 ℃條件下不穩定;在高溫30 ℃、強光照射(4 500 lx±500 lx)條件下放置10 d 后,有關物質有增長,其余各項指標無明顯變化。初步確定該產品需低溫避光保存。
4 低溫熱循環試驗
為模擬本品在運輸及貯存過程中可能遇到的低溫、高溫條件[7],對190501 樣品進行低溫熱循環試驗,內容包括三次循環,每次在2 ℃~8 ℃放置2 d,然后在40 ℃加速條件下考察2 d。結果見表6。

表6 低溫熱循環試驗考察結果
樣品經低溫熱循環試驗后,有關物質略有增長,其余各項穩定性指標無明顯變化。樣品在上述反復低溫、高溫條件下穩定性較好。
5 制劑的安全性評價[8]
根據新(西)藥審批對滴眼液的要求,評價鹽酸丙美卡因滴眼液對家兔眼是否有刺激作用/腐蝕作用及其程度,為臨床用藥提供科學依據。采用影響因素試驗樣品,即批號190501 樣品,每5 min 滴眼一次,每次2 滴,連續5 次給予家兔鹽酸丙美卡因滴眼液滴眼,通過肉眼觀察和熒光素試驗,與0.9%生理鹽水對照組比較無明顯差異,均未見本品對角膜、虹膜和結膜產生刺激或腐蝕作用。本試驗結果表明,鹽酸丙美卡因滴眼液連續滴眼不引起家兔眼刺激性,也不引起角膜潰瘍。臨床前安全性試驗結果表明,本品的安全性良好。
6 放大試驗及處方工藝驗證
采用確定的處方和制備工藝,進行三批放大試驗,每批2 000 支,批號分別為190501、190502 和190503。按實際制備的合格成品量與理論產量計算,收率分別為86.10%,86.00%,85.70%。三批放大樣品的檢查結果見表7。
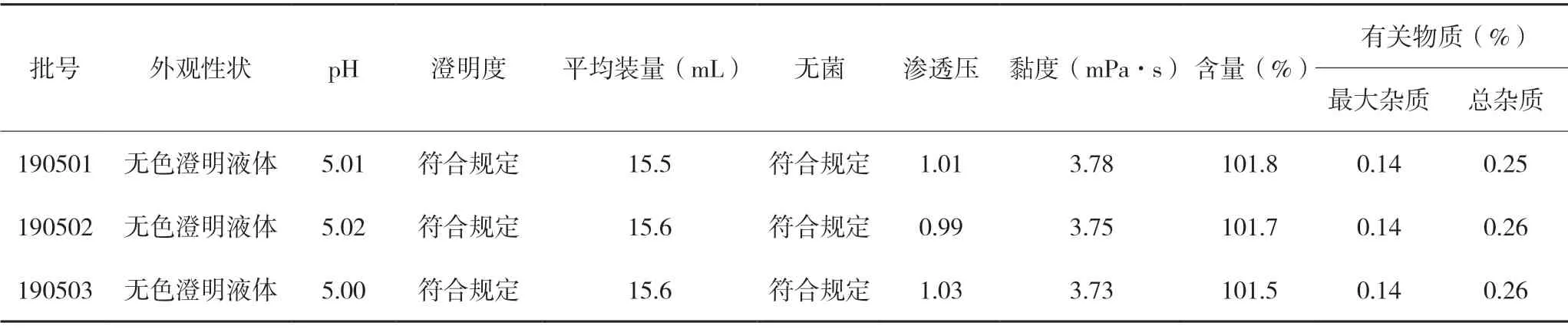
表7 三批放大樣品質量檢查結果
以上結果表明,三批放大樣品各項檢查結果均合格,平均裝量均不少于標示裝量的90%,且批與批之間重現性好,說明制劑的組方合理,工藝穩定,適合放大生產。
7 處方和工藝
依據上述試驗最終確定鹽酸丙美卡因滴眼液的處方和工藝如下。
7.1 處方
鹽酸丙美卡因滴眼液,規格:15 mL:75 mg,即每15 mL 含75 mg 鹽酸丙美卡因。處方如下。

7.2 制備工藝
稱取處方量的氯化鈉、甘油、苯扎氯銨和鹽酸丙美卡因于12 000 mL(全量體積的80%)注射用水中,攪拌至完全溶解,得溶液Ⅰ。0.1 mol/L 鹽酸溶液或0.1 mol/L氫氧化鈉溶液調節溶液ⅠpH至5.0,得溶液Ⅱ。將溶液Ⅱ補加注射用水至15 000 mL(全量體積),攪拌均勻后,再用0.1 mol/L 鹽酸或0.1 mol/L 氫氧化鈉溶液調節溶液pH 至5.0,得溶液Ⅲ。溶液Ⅲ經0.22 μm 濾膜除菌過濾,得中間成品溶液。中間成品溶液經檢驗合格后,灌裝,壓塞擰蓋。成品檢查合格后貼標簽,包裝。
8 討論
本次研究鹽酸丙美卡因滴眼液的處方和工藝,主要是從滴眼劑的等滲調節、黏度選擇、PH 調節、抑菌劑選擇以及制劑的穩定性、安全性等各方面進行試驗考查和數據分析,最終基本確定了鹽酸丙美卡因滴眼液的處方和工藝,后序還需通過對樣品的長期穩定性試驗、加速試驗和對比試驗,用更完整的數據進一步確定該處方工藝的組方合理性、工藝穩定性和質量可靠性。

