超聲造影技術診斷肝硬化結節癌變風險及微小肝細胞癌的價值
高杰 王珂 張娜 劉曉閣
流行病學調查顯示肝細胞癌(HCC)存在早期診斷率和根治率均較低特點[1],成為HCC治療方案確定和預后的重要影響因素。彩色多普勒超聲作為HCC重要的影像檢查手段,已在臨床普及[2]。但對于早期微小肝細胞癌(sHCC)病灶,彩色多普勒超聲具有較高的漏診率,敏感度低[3],難以滿足臨床需求。超聲造影(CEUS)灌注時相分析技術能實時定量反映肝實質血流情況[4],這為動態監測肝組織病理變化提供了依據,有助于腫瘤病灶的早期檢出。劉瀟等[5]也將其用于肝細胞癌與肝轉移癌的鑒別,但臨床少有關于CEUS灌注時相分析在肝硬化結節(CN)癌變演變和sHCC早期診斷中的研究。本研究隨訪記錄不同病理階段CN患者CEUS表現,分析CEUS灌注時相分析技術診斷不同肝硬化病理分型和sHCC的準確性。
資料與方法
一、臨床資料
選取2018年2月至2020年2月醫院收治的127例CN患者作為研究對象,男性74例,女性53例;年齡(59.3±18.7)歲;體質指數(21.3±2.0)kg/m2。肝硬化與CN診斷均滿足指南標準[6]。排除標準:①患者耐受性差,未能配合完成穿刺檢查者;②HCC腫瘤直徑>2.0 cm者或已發生遠處轉移者;③合并有甲肝、丙肝者;④患者病歷資料丟失不全者。
二、隨訪方法
采用電話問診與入院復診相結合的方法進行隨訪。每2周電話隨訪1次,注意記錄患者癥狀表現、飲食及康復訓練狀態,并給予必要指導。每3~6個月入院復診1次,行CEUS或肝穿刺檢查,記錄檢查結果。
三、 CEUS檢查方法
采用Philips HD7彩色多普勒超聲診斷系統檢查,配凸陣探頭,頻率4.0~6.0 MHz,造影劑為SonoVue(意大利Braccoon公司),采用靜脈快速團注法將造影劑制成微泡混懸液。檢查時患者取左側臥位,囑患者屏氣,先行常規二維超聲掃描,記錄病灶位置、大小、形態及回聲情況。再啟動CEUS模式,經肘靜脈注射造影劑1.6~2.4 mL,實時動態觀察灌注過程,根據病灶位置,探查病變特點,記錄造影圖像。記錄動脈期、門脈期及延遲期的CEUS灌注影像模式[7],增強方式有:Ⅰ型,高-低-低;Ⅱ型,高-等-等;Ⅲ型,高-等-低;Ⅳ型,等-等-等;Ⅴ型,偏低-等-等;Ⅵ型,低-等-等;Ⅶ型,低-等-低;Ⅷ型,低-低-低。采用配套定量分析軟件記錄相關參數,寶庫上升時間(RT)、達峰時間(TTP)及平均通過時間(MTT)。
四、穿刺病理活檢
采用18G活檢針,在CEUS引導下選擇最佳路徑進行穿刺,穿刺前常規消毒,麻醉起效后穿刺,穿刺時避開大血管和重要臟器,取得病灶組織后,福爾馬林固定送檢。根據國際工作組織肝臟病變規范標準[8],將肝組織病理結果分為CN、低度增生不良結節(LGDN)、高度增生不良結節(HGDN)及sHCC,以直徑≤2 cm為sHCC。
五、 統計學分析
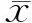
結 果
一、患者病理和超聲結果
127例患者隨訪8~32個月,平均(16.6±5.4)個月。最后一次穿刺病理結果顯示,127例患者中,CN者38例,LGDN者32例,HGDN者26例,sHCC者31例。CN、LGDN、HGDN及sHCC四組不同病灶的回聲表現比較,差異均無統計學意義(χ2=1.272,P=0.973),見表1。

表1 不同病理患者聲像特點比較[n(%)]
二、不同病理特征肝硬化患者CEUS指標比較
CN、LGDN、HGDN及sHCC不同病理特征階段患者TTP、MTT及RT水平比較,差異均有統計學意義(P<0.05)。各組間兩兩比較,差異均有統計學意義(P<0.05),見表2。

表2 不同病理特征肝硬化患者CEUS指標比較(s)
三、不同病理階段患者CEUS灌注模式
CEUS檢查顯示RN、LGDN、HGDN及HCC患者增強灌注模式比較,差異有統計學意義(χ2=178.346,P=0.000),見表3。

表3 不同病理階段患者CEUS灌注模式比較[n(%)]
四、CEUS判斷sHCC的價值分析
以TTP、MTT及RT為檢驗變量,以是否為sHCC為狀態變量,繪制ROC,見圖1,分析結果顯示TTP、MTT及RT對判斷sHCC均具有一定應用價值(P<0.05),見表4。TTP、MTT及RT聯合預測概率判斷sHCC的AUC為0.802(SE=0.047,95%CI=0.710~0.895,P=0.000),敏感度為0.935,特異度為0.561。

圖1 CEUS指標判斷sHCC的ROC分析

表4 CEUS指標判斷sHCC的ROC分析結果
討 論
研究認為肝硬化癌變經歷再生結節、不典型增生及sHCC幾個病理階段,早期監測肝硬化結節病理演變過程對HCC防治至關重要。肝內占位性病變在常規二維超聲下多表現為高回聲,但不能有效鑒別病變結節性質[9]。CEUS是目前影像科較為成熟的造影成像技術,CEUS灌注時相分析技術實現了對肝實質病變組織微血管病變的動態監測,對肝內結節異常血流信息具有較高的敏感度[10],進而為判斷肝硬化結節性質提供依據。
結節內正常肝動脈血流減少和新生腫瘤血管血流增加是肝硬化再生結節向sHCC演變的主要病理特點[11]。因而CEUS檢查結果可見LGDN和HGDN在三期均以低密度和等密度增強為主,這與本研究結果一致。而病變進展至sHCC階段,其血供由肝動脈和門靜脈提供,且以肝動脈血流為主[12]。因而CEUS檢查可見動脈期高增強,門脈期和延遲期低增強。本研究也發現,sHCC患者中,Ⅰ類CEUS灌注增強模式占77.4%。另外,31例sHCC患者中有2例表現為高-等-等,5例為高-等-低增強灌注模式,這可能是與微小肝細胞癌病灶的分化程度有關,分化程度良好的肝細胞癌對微泡攝取能力優于低分化癌細胞,這部分病變組織內腫瘤新生微血管尚不完善,因而缺乏典型的HCC表現。此類病變組織的鑒別對工作人員技術水平要求高,也可結合增強MRI或組織活檢進行確診[13]。
肝硬化癌變過程可通過血流動力學特點的改變得到體現[14]。為進一步探討CEUS在sHCC早期檢出率中的價值,本研究采用定量分析法探討CEUS指標判斷sHCC的敏感度。隨著肝硬化結節向LGDN和HGDN演變,纖維間隔逐漸在肝實質內形成,原有肝內微循環遭到破壞,使肝內血管網減少[15],影響TTP水平。另外,HCC血供90%由肝動脈提供,隨著新生腫瘤血管的形成,癌組織內肝動脈血供逐漸增多[16],這使得TTP、MTT均逐漸縮短。因而,肝硬化病變結節內TTP、MTT指標的變化有助于sHCC的早期檢出。本研究也發現,TTP、MTT及RT對sHCC早期檢出均有一定應用價值,但AUC值均低于0.75。這可能是因由肝硬化結節至sHCC的病理改變不足以引起各項指標的顯著性差異[17]。而三項聯合檢測則有助于sHCC的早期檢出。本研究結果也證實三項聯合檢測判斷sHCC風險的AUC達0.802,提示CEUS定量分析有助于提高sHCC早期檢出率,這對HCC早期防治,改善預后具有重要價值。
綜上,CEUS有助于鑒別肝硬化結節不同病理演變階段的病理特征,利用CEUS監測肝硬化結節病變過程,有助于早期篩查sHCC。

