菊三七相關肝竇阻塞綜合征臨床結局相關影響因素分析
邵幼林 張鎖才 吳劍明 謝靜 龍春梅 鄭婷婷 柳龍根
肝竇阻塞綜合征(hepatic sinusoidal obstruction syndrome,HSOS),也稱作肝小靜脈閉塞病,是由各種原因導致的肝血竇、肝小靜脈和小葉間靜脈內皮細胞水腫、壞死、脫落進而形成微血栓,引起肝內淤血、肝損傷和門靜脈高壓的一種肝臟血管性疾病。肝毒性吡咯里西啶生物堿(hepatotoxic pyrrolizidine alkaloids,HPAs)存在于菊三七等開花植物中,是引起菊三七相關肝竇阻塞綜合征(菊三七-HSOS)的物質基礎[1]。我國報道的菊三七-HSOS逐年增加,但對于其預后影響因素仍不清晰,本研究從患者發病前服用菊三七、飲酒和發病情況、發病過程中的癥狀體征、入院檢查及治療用藥等分析患者的預后,期望有一定的臨床指導意義。
資料與方法
一、研究對象
2005年8月至2016年1月在常州市第三人民醫院住院的臨床診斷為菊三七-HSOS患者55例,男性46例,36~74歲,平均(57.87±8.27)歲;女性9例,57~70歲,平均(64.22±5.09)歲。患者診斷符合2017年HSOS南京標準[2]。排除布加綜合征、病毒性肝炎、自身免疫性肝病、非酒精性脂肪性肝病和遺傳代謝性肝病患者。
二、研究方法
根據患者120天臨床結局分為存活組和死亡組,比較兩組患者發病前服用菊三七、飲酒等病史,以及入院時癥狀體征、檢查項目(肝腎功能、生化采用Olympus AU2700全自動生化分析儀檢測)、iMELD、住院并發癥、治療用藥,分析低分子肝素鈉與菊三七-HSOS患者120天預后的關系,分析菊三七-HSOS患者120天預后的影響因素。iMELD=3.78×ln[TBil(μmol/L)÷17.1]+11.2×ln[INR]+9.57× ln[Cr(μmol/L)÷88.4] + 6.43+(0.3×年齡)-(0.7×Na)+100[3]。
三、統計學分析
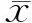
結 果
一、患者服用菊三七情況
所有患者均有服用菊三七史,共17例患者可以清楚說明菊三七使用量,有 1~2片/天泡水服用,有總量 750 g泡酒1月服完,有總量3 500 g泡酒分3年服完等,故患者日服用菊三七劑量差異極大,難以估計。服用菊三七方式:菊三七泡酒37例,菊三七泡水12例,煎服4例,打粉沖服2例。服用菊三七的原因:腰腿關節痛18例,保健37例。服用菊三七時長(3天至十多年):≤2月32例,≥3月23例(多為間斷服用)。停用菊三七與發病時機:發病后不及時停用菊三七(5~60天) 12例,發病立即停用菊三七24例,停用菊三七后延遲發病(延遲7天~9個月) 18例。生存或隨訪時間7天至6.8年。
二、患者一般情況
根據患者120天臨床結局分為存活組和死亡組,存活組主訴天數、服用菊三七時長、服用菊三七至發病天數、飲酒量和飲酒年限分別為:30.00(30.00)d、60.00 (160.00)d、60.00 (225.00)d、50.00 (187.50)g和1.00 (30.00)年,而死亡組分別為20.00 (27.50)d、52.50(315.00)d、52.50(340.00)d、(169.44±156.37)g和20.00 (30.00)年,均無統計學差異。兩組患者既往肝病(HBsAg陽性/HBV DNA陰性3例,血吸蟲肝硬化1例)、高血壓病、糖尿病病史無統計學差異。
三、患者癥狀體征
患者入院時主要癥狀體征,包括乏力(96.36%)、食欲減退(96.36%)、腹脹(98.18%)、尿量減少(98.18%)、雙下肢水腫(25.45%)等,兩組無統計學差異,對于造血干細胞移植(hematopoietic stem cell transplantation)相關HSOS(HSCT-HSOS)比較特異的肝區疼痛(包括肝區隱痛和叩痛36.36%)也無統計學差異。死亡組反映慢性肝損傷表現的肝掌/蜘蛛痣發生率更高,可能與飲酒時間更長有關。住院期間死亡組肝性腦病發生率更高,而兩組間肝腎綜合征無統計學差異。見表1。
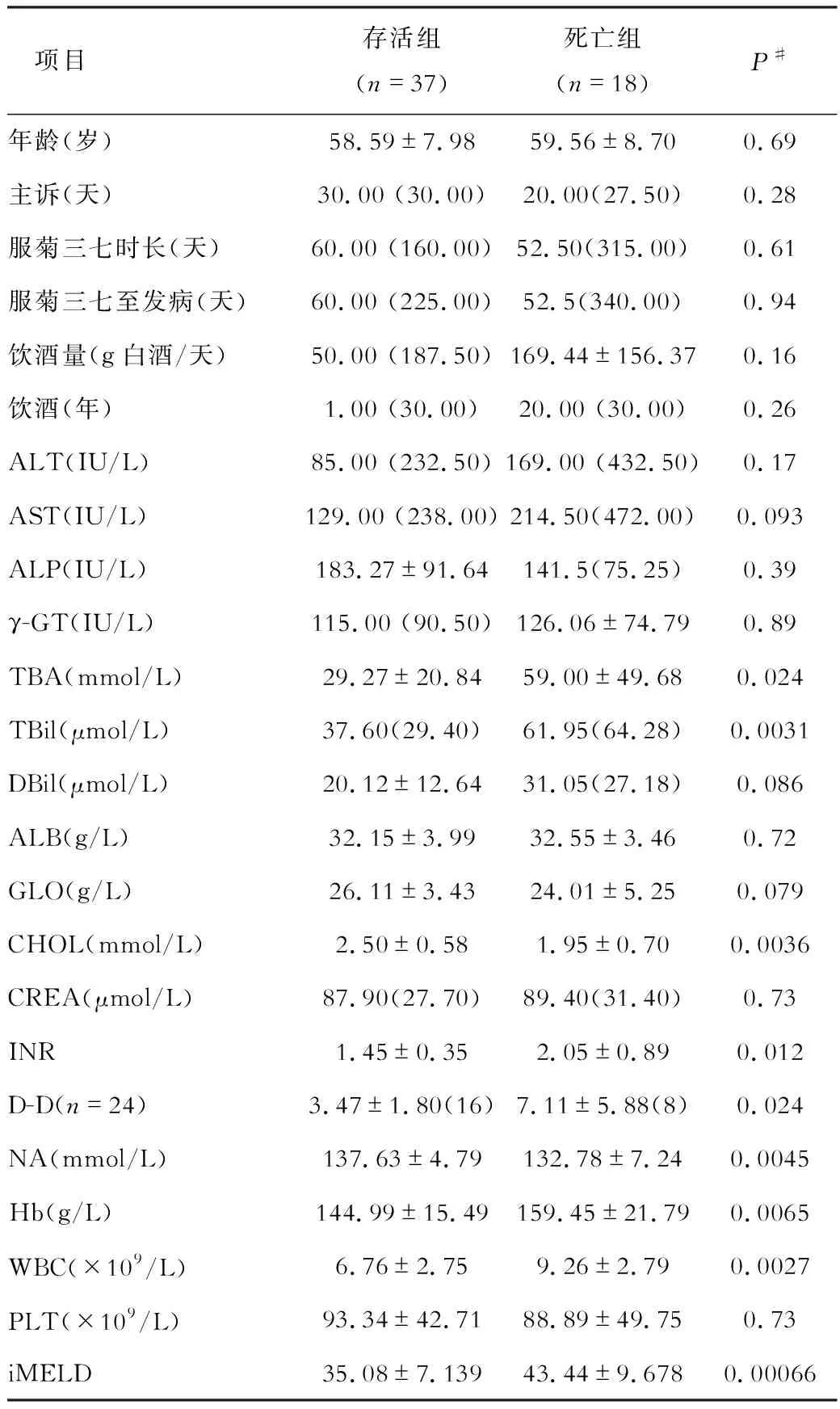
表1 兩組患者服菊三七、飲酒、發病情況和入院檢查比較*
四、患者入院檢查
兩組患者入院ALT、AST均為非正態分布,范圍分別為17~2 529 IU/L和31~1 308 IU/L,這可能與患者發病后是否及時就診有關,也體現了患者可能存在初期明顯體力下降、食欲減退而就診的發病模式,和初期癥狀不明顯直到腹脹才就診的發病模式,兩組間ALT、AST無統計學差異。兩組ALP無統計學差異,但死亡組TBil、DBil和TBA更高,反映病情可能更嚴重。死亡組反映肝臟合成指標的CHOL和INR結果更差,而ALB無統計學差異,考慮與本院治療菊三七-HSOS中均輸注較多血漿和人血白蛋白有關。死亡組WBC更高,提示感染、內毒素血癥可能。死亡組Hb更高,可能與門靜脈壓力增加導致門靜脈流速減慢、腹水形成,進一步引起有效血容量減少和血液濃縮有關。由于本院從2012年開展D-D二聚體檢查,故檢查患者為24例,死亡組患者入院時D-D二聚體更高。死亡組iMELD評分更高(表2)。所有患者CT或MRI符合典型HSOS表現。2010年之前病例中12例行肝活組織檢查,符合HSOS病理組織表現。
表2 二組患者服菊三七方式、主要癥狀體征和治療用藥比較(%)
五、使用低分子肝素鈉與預后的關系
發病前服用菊三七、飲酒和發病情況,發病過程中的癥狀體征、入院檢查及治療用藥中多項指標在存活組和死亡組間存在差異(表1和表2)。這些指標中可作為發病后干預手段的主要是治療,而存活組和死亡組的治療中只有低分子肝素鈉使用率存在統計學差異,分別為59.46%和22.22%,P=0.009 4,其余治療無統計學差異(表2)。采用Kalpan-meier生存曲線分析發現是否使用低分子肝素鈉與患者120天預后顯著相關,P=0.006 1(圖1)。
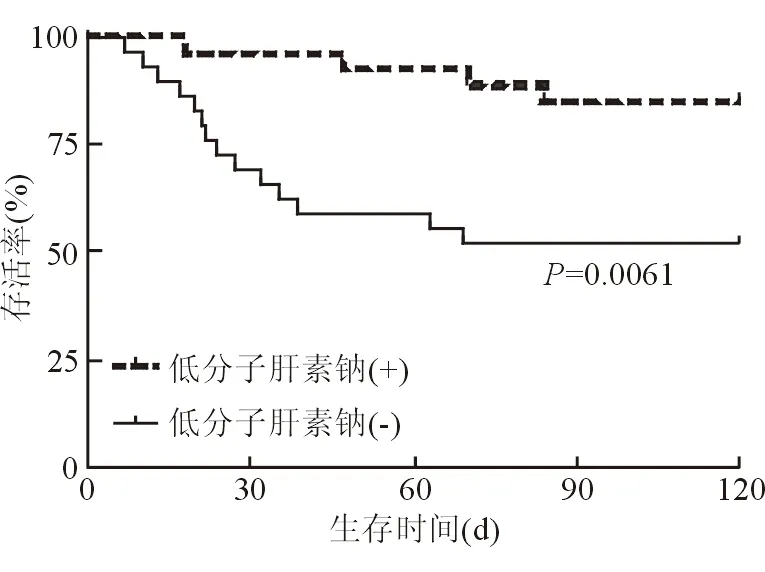
圖1 Kalpan-meier生存曲線分析低分子肝素鈉與菊三七-HSOS患者120天預后的關系
六、菊三七-HSOS患者臨床結局的影響因素
采用單因素Cox回歸分析顯示存活組和死亡組間有17項指標存在統計學差異(表3)。由于iMELD已包含INR、Na、TBil信息,而DBil為TBil近似指標,故這些指標不進入多因素Cox回歸分析。最終13項指標進入多因素Cox回歸分析,結果顯示服用菊三七時長、尿量減少、肝掌/蜘蛛痣、低分子肝素鈉、CHOL、Hb、iMELD與菊三七-HSOS患者臨床結局相關(表3)。它們預測菊三七-HSOS 120天預后的AUROC分別為0.54、0.53、0.65、0.69、0.71、0.72、0.76。其中iMELD、Hb和CHOL存在一定的預測效能,AUROC>0.70;低分子肝素鈉和肝掌/蜘蛛痣的預測效能較差,0.60
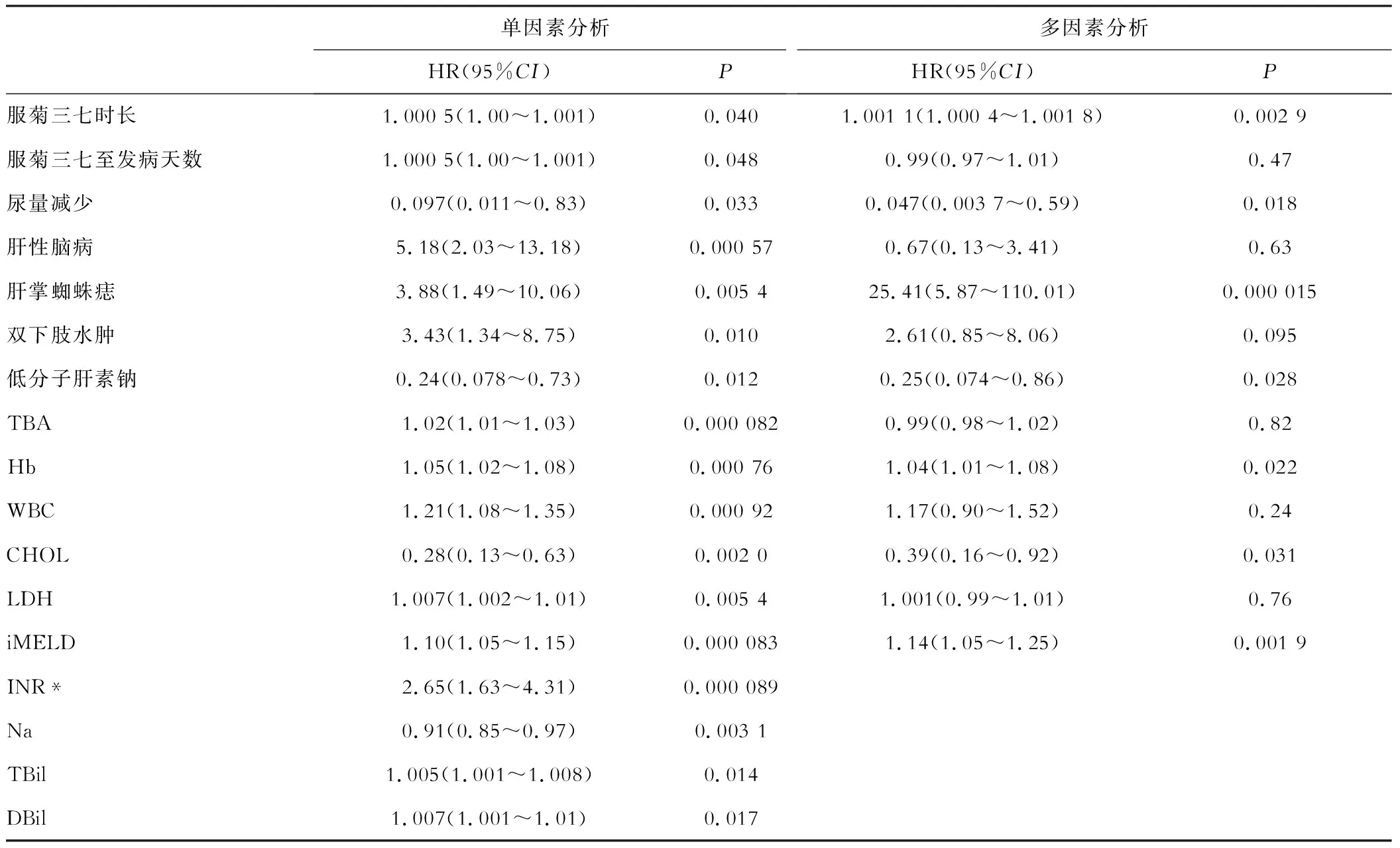
表3 Cox回歸分析菊三七-HSOS患者臨床結局相關影響因素
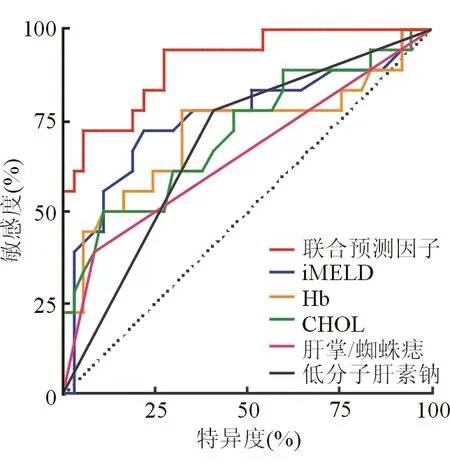
圖2 預測菊三七-HSOS 120天預后的AUROC曲線
討 論
HSCT是常見的可預測HSOS的主要病因,這類患者診斷可以參考最新修訂的HSOS成人和兒童診斷和嚴重程度標準[4-5]。另一類HSOS的誘因為服用HPAs[6]。目前,全球PA-HSOS報道超過10 000例[7]。世界各地3%的開花植物(6 000多種)中已發現660個不同結構的PAs及其N-氧化物,這些植物大多數屬于菊科、紫草科、蘭科和豆科,其中一半PAs具有肝毒性[7]。
我國PA-HSOS主要是服用菊三七所致[2]。近年菊三七-HSOS逐漸增加,鑒于菊三七-HSOS不像HSCT-HSOS一樣能被及時發現,且兩者的臨床表現差異明顯。故本研究診斷采用我國的吡咯生物堿相關HSOS診斷和治療專家共識意見(2017年,南京)[2]。盡管我國報道的菊三七-HSOS較多,但分析菊三七-HSOS預后影響因素的報道較少。
在蘇南地區菊三七-HSOS患者菊三七來源多為食用者自行種植,部分患者將其作為傷藥“三七”使用,更多的患者單純地用其“保健”。服用方法多種多樣,服用菊三七日劑量和期限差別極大,常難以通過臨床服用菊三七史清晰知曉。這點與HSCT-HSOS形成巨大反差,后者在移植起始即可以監測并可使用藥物預防,以減少其發生率和嚴重程度[8]。而菊三七-HSOS患者多數直到發病才停用菊三七、甚至有患者發病后仍繼續服用菊三七2個月,直至腹脹難忍而就醫時才停用。近年來,許多文章報道在各種食物中檢測到PA,包括蜂蜜、牛奶、肉、蛋、茶和沙拉[7]。這些隱蔽存在的PA為預防、診斷和治療HSOS造成極大的困難。在缺乏PA攝入史的情況下,如果臨床高度懷疑HSOS,可行肝活檢或檢測血清PA。
本研究發現患者可能存在兩種發病模式:①初期存在明顯體力下降、食欲減退而就診的發病模式,這時轉氨酶明顯升高(ALT>5×UNL,20例);②初期癥狀不明顯直到腹脹才就診的發病模式,這時轉氨酶輕度升高或正常(ALT<2×UNL,22例)。這或相似于PA-HSOS的分期,后者根據病程和臨床表現的不同特點,大體上分為急性期/亞急性期、慢性期[9]。
肝區疼痛是HSCT-HSOS較為突出的特征[4],2017年HSOS南京標準也納入了肝區疼痛指標,本研究中僅36.36%患者存在肝區疼痛,但基本都存在腹脹和尿量減少(98.18%)。這與我國菊三七-HSOS的全國多中心臨床調研分析中97.07%患者存在腹水相近[10]。病理學是診斷HSOS的金標準,本院在2005至2010年對12例服菊三七后發生肝損傷患者行肝活檢檢查,其組織學符合典型HSOS表現,這為醫院診斷HSOS積累了寶貴的經驗。近年,在沒有肝活檢的情況下,依據病史和典型的影像學表現基本能做出臨床診斷[10],避免了肝活檢的潛在風險,作為肝病臨床中心或是可取的選擇。筆者現通過小鼠驗證了菊三七不同部位PA的肝毒性,這為下一步開展臨床應用提供了理論支撐[1]。
對癥支持、維持內環境穩態、腸道穩態、減少并發癥是治療HSOS的基礎,本研究中患者使用了大量的血漿和人血白蛋白注射液,這可為長期治療爭取更多時間。HSOS典型病理表現為以肝腺泡Ⅲ區為主的肝竇內皮細胞腫脹、損傷、脫落,肝竇顯著擴張充血;肝細胞不同程度的腫脹、壞死,紅細胞滲入狄氏間隙,肝內小靜脈管壁增厚,管腔狹窄、閉塞,無纖維化表現或僅見匯管區輕度纖維增生[2]。結合實驗室檢查中血小板減少和D-D二聚體升高等凝血功能異常,HSOS似乎可以理解為肝臟局部DIC樣病變,而抗凝、清除血栓是治療DIC的關鍵。去纖苷是一種具有抗血栓及促進纖溶作用的單鏈寡核苷酸混合物,是唯一被證明可有效預防和治療HSCT-HSOS的藥物,安全有效劑量為25 mg/(kg·d),持續使用至少14天或達到完全反應[11]。目前,沒有使用去纖苷治療菊三七-HSOS的經驗,且與HSCT-HSOS可以預防和早期用藥不同,菊三七-HSOS半數以上入院時已是晚期。本研究治療使用的多種藥物中唯有低分子肝素鈉使用率在存活和死亡組間存在統計學差異。王軼等[12]研究也發現,抗凝治療可提高菊三七-HSOS治愈率,抗凝-經頸靜脈肝內門體靜脈分流術階梯治療可進一步提高臨床治愈率。
本研究中采用單因素Cox回歸分析發現眾多因素與菊三七-HSOS 120天預后相關,但進入多因素分析時發現iMELD、Hb、CHOL、低分子肝素鈉、肝掌/蜘蛛痣、尿量減少和服菊三七時長與之有關。終末期肝病模型(model for end-stage liver disease,MELD)是對終末期肝病短期、中期病死率進行有效預測的工具,能預測經頸靜脈肝內門體靜脈分流術患者的存活率,為肝移植肝源分配提供依據[13]。整合的MELD(integrated model of end-stage liver disease,iMELD)是將年齡和血清鈉整合到MELD的預測模型,其較MELD有更高的預測價值[14]。HSOS患者Hb升高反映了門靜脈壓力升高導致腹水、有效血容量減少和血液濃縮,而血液濃縮有可能反過來再加重肝小靜脈閉塞和門靜脈壓力。CHOL在重癥肝病中反映肝臟合成能力,明顯降低提示預后不佳。將iMELD、Hb、CHOL、低分子肝素鈉和肝掌/蜘蛛痣整合為聯合預測因子,其AUROC=0.91,進一步提高了對菊三七-HSOS患者120天預后的預測能力。
總之,近年來菊三七-HSOS患者正在增加,患者間存在巨大的異質性,由于PA存在的形式復雜多樣,不能提供明確病史的患者可能被漏診。患者常因逐漸增加的腹脹慢性病形式就診,少數以明顯的乏力和消化道癥狀急性病形式就診。低分子肝素鈉抗凝治療可提高患者120天生存率。入院時的聯合預測因子可用于患者120天預后評估。但本回顧性研究病例數較少、年度跨度大、醫師對疾病的認識存在差異,期待多中心前瞻性研究提供更充實的循證依據。

