烏鱧爛身病病原的分離鑒定及病理組織觀察
`喻大鵬,唐懷慶,丘金珠,宋海霞,梁富,夏洪麗,宋長江*,魯義善
(1.廣東海洋大學 深圳研究院,廣東 深圳 518108;2.廣東海洋大學 水產學院,廣東 湛江 524088;3.深圳海水經濟動物種苗健康評價公共技術服務平臺,廣東 深圳 518108;4.廣東省水生動物健康評估工程技術研究中心,廣東 深圳 518108;5.中山市農產品質量安全檢驗所,廣東 中山 528437)
烏鱧Channaargus隸屬于鱧亞目鱧科鱧屬魚類,是中國淡水養殖重要品種之一,其具有出肉率高、抗應激性強、營養價值高等特點,同時具有較高的藥用價值[1]。2019年中國漁業統計年鑒顯示,全國烏鱧產量高達459.277 t,但隨著養殖規模和密度的不斷擴大,水體環境持續惡化,導致該魚發育遲緩,免疫力降低,各種病害頻發,其中烏鱧爛身病尤為嚴重,給烏鱧養殖產業發展造成了極大障礙[2]。目前,已報道引起爛身癥狀的病原菌有擬態弧菌Vibriomimicus[3]、嗜水氣單胞菌Aeromonashydrophila[4]、維氏弧菌Vibrioharvey[5]、絲囊霉菌Aphanomycesinvadans[6]和維氏氣單胞菌Aeromonasveronii[7]等。
維氏氣單胞菌隸屬于氣單胞菌科弧菌屬革蘭氏陰性厭氧菌,廣泛分布于自然界中,是一種人-魚共患致病菌[8],不僅能引起人類敗血癥、傷口繼發性感染、腸胃炎及腦膜炎,還能感染斑點叉尾鮰Ietaluruspunetaus[9]、黃顙魚Pelteobagrusfulvidraco[10]、加州鱸Micropterussalmoniodes[11]、卵形鯧鲹Trachinotusovatus[5]、泥鰍Misgurnusanguillicaudatus[12]、黃鱔Monopterusalbus[13]、鰻鱺Anguillajaponica[14]、團頭魴Megalobramaamblycephala[15]和懷頭鲇Silurussoldatovi[16]等多種魚類,給水產養殖產業造成了巨大經濟損失。
2020年3月,在中山某烏鱧親魚養殖場出現大量患病烏鱧,體表多處出現爛身癥狀,沿岸浮頭,無規則游動,食欲廢絕。烏鱧爛身病在中國珠江三角洲地區發現已久,且在春季低溫反潮季節持續發病,有些地區發病周期甚至延長至10月底,這對烏鱧養殖業造成了嚴重影響。調查發現,發病烏鱧養殖基地存在養殖密度過大、投喂分布集中、水質惡化等現象,這些因素都有可能導致烏鱧爛身發生。本研究中,作者從患病烏鱧病灶處分離到一株優勢菌,通過16S rRNA測序、生理生化鑒定、藥敏分析等試驗,對烏鱧爛身病病原菌特征進行了分析,并對該菌株感染后的組織病理變化進行了觀察,最后通過回歸感染試驗確認該菌株為爛身病的主要病原,獲得的結果能為烏鱧爛身病的防治提供理論依據,對烏鱧的健康養殖也具有一定的實踐指導意義。
1 材料與方法
1.1 材料
患病烏鱧來源于廣東中山某親魚養殖場。試驗所用健康烏鱧魚苗(體長7~10 cm)購自惠州某烏鱧魚苗養殖場,暫養于實驗室養殖桶,14 d后用于攻毒試驗,暫養期間水溫控制在28 ℃,每日投喂一次。
常規使用培養基、革蘭氏染色試劑盒、細菌生理生化鑒定試劑盒、藥敏片等均購自廣東環凱微生物科技有限公司。
1.2 方法
1.2.1 病癥觀察 眼觀患病烏鱧體表癥狀,并記錄;隨后解剖患病烏鱧體表皮膚、鰓絲、腸道等器官并用相機拍照記錄。取病灶周圍黏液進行水浸片觀察,排除寄生蟲和真菌感染后,進行下一步細菌分離純化。
1.2.2 病原菌分離純化 用體積分數75%的乙醇對患病烏鱧體表消毒,將瀕死與剛死亡的患病烏鱧在無菌操作臺進行解剖和初步臨床診斷,并對體表病灶部位進行劃線分離,28 ℃培養箱中培養10 h,挑取長勢與形態規格相似的單個菌落進行擴大培養,并進行后續鑒定分析。
1.2.3 病原菌鑒定
1)革蘭氏染色。參考革蘭氏染色試劑盒方法步驟,在無菌條件下進行染色及形態觀察。
2)生理生化鑒定。按照細菌生理生化鑒定試劑盒說明書,將培養好的菌液添加到生化鑒定管中,于37 ℃下培養24~48 h后觀察并記錄結果。
3)細菌的16S rRNA序列及其系統發育分析。按照基因組DNA提取試劑盒方法,提取純化菌株DNA,利用生工生物工程(廣州)股份有限公司合成的16S rRNA通用引物27F:AGAGTTTGATCMGGCTCAG和1492R:GGTTACCTTGTTACGACTT 進行PCR擴增,產物經20 g/L瓊脂糖電泳檢測無誤后,送至生工生物工程(廣州)股份有限公司進行測序并構建系統發育樹。
1.2.4 人工回歸感染試驗 將此前分離到的疑似病原菌活化,28 ℃下培養12 h,用于后續人工回歸感染試驗。參考黃浦江等[17]的方法,使用無菌PBS將菌液濃度分別調節至2.0×107、2.0×106、2.0×105、2.0×104CFU/mL,腹腔注射魚體,每尾注射100 μL,每組30尾,對照組注射等量無菌PBS,接種后連續觀察一周,每天記錄烏鱧發病情況,參考黃浦江等[1]方法計算半致死濃度(LD50),連續觀察期間出現死亡病例,及時分離并鑒定病原菌。
1.2.5 病原菌藥敏試驗 參考黃浦江等[17]的方法, 選取30種抗生素藥敏片對致病菌進行藥敏試驗(判斷依據為WS/T125—1999)。
1.2.6 組織病理檢驗 患病烏鱧體表使用體積分數75%的乙醇進行消毒,取體表病灶處代表性樣品,切塊置于體積分數4%的組織細胞固定液中,送至武漢塞維爾生物(廣州)科技有限公司進行組織病理制片。
2 結果與分析
2.1 患病烏鱧病癥觀察
眼觀患病烏鱧體表主要病變為爛身(圖1),體表鱗片脫落(圖1A),體表多處出現潰瘍灶(圖1B),鰓蓋處可見糜爛血塊(圖1C),尾部存在少量出血點(圖1D)。解剖觀察體內感染情況,發現其腹腔有黃色積液,內部組織未見異常。
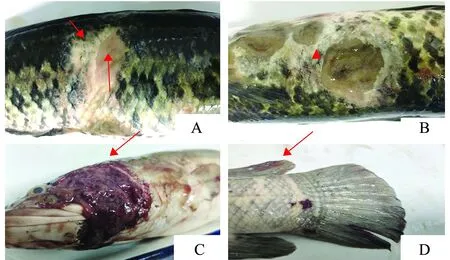
A—體表鱗片脫落(↑);B—體表潰瘍灶(▲);C—鰓蓋糜爛(↑);D—尾部出血點(↑)。
2.2 病原菌的分離與革蘭氏染色
從患爛身病烏鱧病灶處分離到一株優勢菌,命名為ZS20200317。隨后對該菌株進行革蘭氏染色鑒定,發現該菌為革蘭氏陰性菌。顯微鏡下觀察該菌呈短桿狀,邊緣光滑整齊。
2.3 序列分析及系統發育樹的構建
用細菌16S rRNA通用引物擴增菌株ZS20200317的16S rRNA基因, 并將其測序結果進行拼接,隨后與GenBank數據庫中已公布的其他菌株的16S rRNA基因序列進行比對,發現菌株ZS20200317與已知維氏氣單胞菌一致性最高,為98.5%。選取NCBI中部分維氏氣單胞菌16S rRNA 序列,并利用Mega 5.2軟件,采用N-J法構建系統進化樹,結果顯示,菌株ZS20200317與維氏氣單胞菌KC166864聚為一支,親緣關系最近(圖2)。
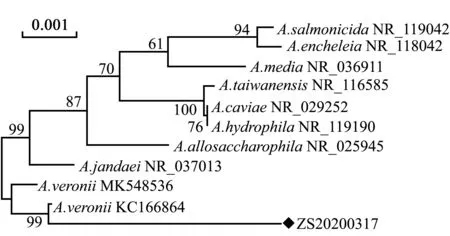
◆,分離菌株ZS20200317。◆,Isolated bacterial strain SZ20200317.
2.4 分離株的生理生化鑒定
分離株ZS20200317經生理生化鑒定顯示(表1),該菌的賴氨酸脫羧酶、氧化酶、VP試驗、MR等生理生化反應為陽性,可利用覃糖、甘露醇、葡萄糖、蔗糖,不能分解乳糖,能直接生長在半固體瓊脂上,三糖鐵試驗無法分解乳糖,產H2S氣,該分離菌與本實驗室分離的維氏氣單胞菌的生理生化特性基本一致。

表1 分離菌的生理生化鑒定結果
綜合形態學觀察、革蘭氏染色、16S rRNA及生理生化特性結果,可鑒定菌株ZS20200317為維氏氣單胞菌。
2.5 藥敏試驗
菌株ZS20200317對30種抗生素藥物敏感性結果顯示(表2),該菌株對氨芐西林、苯唑西林、羧芐西林、青霉素G、麥迪霉素、萬古霉素和克林霉素7種藥物耐受;對新霉素、呋喃唑酮和復方新諾明中度敏感;對頭孢他啶、多粘菌素B、四環素等20種藥物敏感。

表2 藥敏試驗結果
2.6 人工回歸感染試驗
健康烏鱧在回歸感染7 d內各組死亡情況見表3,感染期間,發現部分染病烏鱧活力減弱,食欲廢絕,感染4 d后,高濃度組(2.0×107CFU/mL)回歸感染烏鱧全部死亡,無菌PBS對照組健康無死亡,這表明菌株ZS20200317對烏鱧有較強的致病性。同時,從回歸感染瀕死烏鱧體內再次分離細菌,發現重新分離到的病原菌與自然分離病原菌相同,這表明,本次自然分離菌株ZS20200317為此次烏鱧爛身病的疑似致病菌。
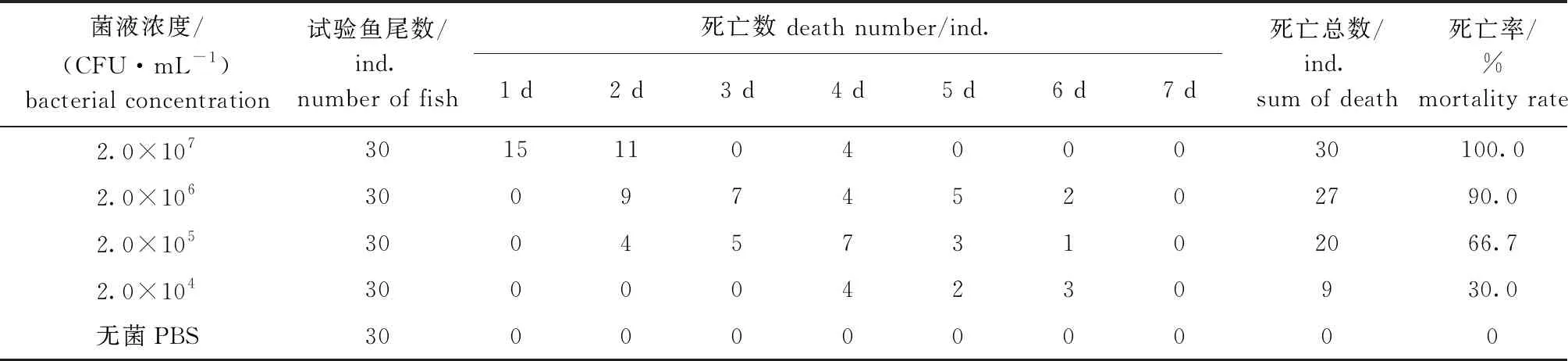
表3 烏鱧腹腔注射感染試驗結果
使用SPSS 12.0軟件進行統計學分析后,計算得到菌株ZS20200317的LD50為7.25×104CFU/mL。
2.7 組織病理學觀察
觀察自然患病烏鱧爛身病的病理組織切片,眼觀體表病灶處從外到內可見皮膚鱗片脫落,表皮壞死消失,真皮層泛紅,圖3為自然患病烏鱧健康肌肉與病灶處肌肉組織H.E染色病理切片。病灶處肌肉組織中出現大量嗜酸性粒細胞和淋巴細胞浸潤,肌細胞核溶解消失(圖3B),并出現壞死脫落(圖3C),部分肌纖維溶解,邊界不清(圖3D)。
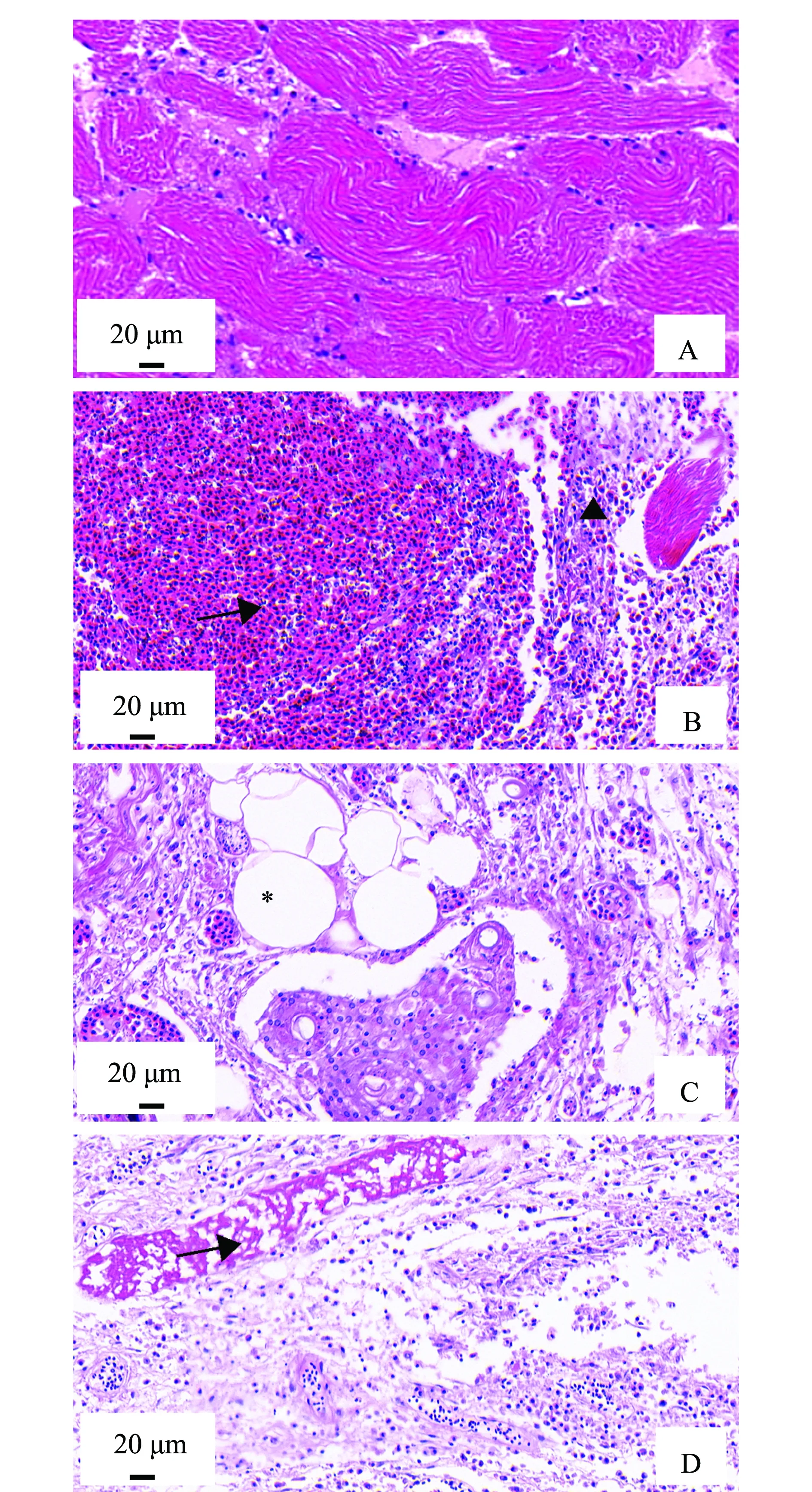
A—健康肌肉組織; B—肌肉組織大量嗜酸性粒細胞和淋巴細胞浸潤(↑), 肌纖維壞死,核溶解(▲); C—肌肉糜爛, 組織滲出壞死,出現炎癥細胞,肌細胞壞死脫落(*) ; D—肌纖維變性溶解,邊界不清(↑)。
3 討論
3.1 烏鱧爛身病病原診斷
目前,有關魚類體表疾病研究報道較多,本研究中患病烏鱧體表出現潰爛壞死癥狀,與云斑尖塘鱧Oxyeleotrismarmoratus[4]、大口黑鱸Micropterussalmoides[18]、鱧Channamaculata[6]和卵形鯧鲹Trachinotusovatus[5]爛身病的臨床癥狀相同,主要表現為鰭條損傷、肌肉糜爛、體表出現大量出血點等癥狀。根據以往研究表明[4,6,10,12,19-20],引起魚類爛身病病原很多,其中大口黑鱸爛身病的病原是嗜水氣單胞菌,卵形鯧鲹爛身病的病原是哈維氏弧菌QT520,絲囊霉菌則是引發冬春季鱧爛身病的主要病原,均與本研究中分離獲得的病原不同。將本研究中分離純化致病菌,進行16S rRNA 序列同源性比對及構建系統進化樹,發現其與維氣氏單胞菌具有98.5%的一致性,初步將該菌確定為維氏氣單胞菌。回歸感染試驗驗證了維氣氏單胞菌為引發本次爛身病的病原。
3.2 烏鱧爛身病病原菌的致病性與致病機理
王旭等[20]研究表明,維氏氣單胞菌主要感染體表肌肉及肝、腎等內臟器官,細菌通過體表病灶侵入其他組織,且細菌在其他組織中大量繁殖,引發進一步繼發感染并導致死亡;楊移斌等[21]研究發現,從西伯利亞鱘和施氏鱘分離的維氏氣單胞菌具有很強的致病性,人工感染96 h內的累計死亡率分別高達70%和80%;而劉亞等[22]對維氏氣單胞菌感染達氏鱘Acipenserdabryanus造成的組織病理觀察發現,其病理損傷多集中在肝臟和腸道等組織,肝臟是魚體重要解毒器官,腸道主要功能是吸收營養促進機體發育,功能性器官組織的損傷,導致機體免疫力下降更易發生繼發性感染而死亡。本研究中患病烏鱧病理損傷主要集中在體表,且體表肌肉病理切片結果顯示,其上皮細胞及皮膚結締組織壞死脫落,大量炎性細胞聚集,這與常藕琴等[6]對冬春季鱧體表潰瘍的組織病理觀察相似。
值得一提的是,本試驗中初期使用維氏氣單胞菌人工感染健康烏鱧,尚未出現明顯爛身癥狀,但2 d內出現大量死亡,隨后降低感染濃度,延長養殖周期,結果均不理想,依然無法復制爛身癥狀。在絲囊霉菌回歸感染健康冬春季鱧時,也同樣無法復制自然患病癥狀[6]。以往研究表明[4,20-21,23],爛身病可能不是由某一種病原引起,而是由于魚類體表損傷使得水體中的病原菌能突破體表黏膜免疫后在局部繁殖,繼而擴大損傷部位加劇感染,出現爛身及潰瘍癥狀,最后細菌通過血液循環系統進入體內并大量繁殖,產生大量毒素造成機體死亡。但本研究中用維氏氣單胞菌進行人工回歸感染試驗后,可以從患病個體中重新分離到該菌株,用SPSS 12.0軟件進行統計分析,顯示菌株ZS20200317的LD50為7.25×104CFU/mL,具有較強致病性,為爛身病病原。
3.3 烏鱧爛身病的預防及控制方法
本試驗中藥敏試驗顯示,維氏氣單胞菌對氯霉素、頭孢他啶、頭孢氨芐、頭孢唑林、頭孢拉定、頭孢呋辛、頭孢哌酮、丁胺卡那、頭孢曲松、哌拉西林、多西環素、卡那霉素、慶大霉素、四環素、米諾環素、氧氟沙星、諾氟沙星、環丙沙星、紅霉素、多粘菌素B等20種抗生素具有敏感性,這些試驗結果能為該病治療提供參考。然而其中氯霉素、氧氟沙星、諾氟沙星是中國農業農村部禁用獸藥,嚴禁使用,在實際養殖過程中可以參考藥敏結果中其他非禁用抗生素,嚴格按照劑量添加,嚴禁私自使用其他藥物,同時做好日常消毒管理工作。
防控該病的主要方法是:1)通過調節水質保持養殖水體清潔;2)烏鱧生性兇猛,養殖過程中,可按照魚體大小分揀后進行養殖,同時降低放養密度,避免因搶食造成魚體受傷;3)定期清塘清淤,使用生石灰和漂白粉等對水體進行消毒;4)確保餌料干燥新鮮,按量投喂,減少殘餌對水體的污染;5)適量使用“三黃散”(黃芩、黃檗、大黃、大青葉等)拌料投喂烏鱧,調節水質的同時也可預防爛身病暴發。
4 結論
1)從廣東中山某養殖場患病烏鱧中分離到一株優勢菌株ZS20200317,經過形態學、生理生化特征及16S rRNA 基因序列比對,將該菌株確定為維氣氏單胞菌。
2)維氣氏單胞菌ZS20200317對烏鱧的LD50為7.25×104CFU/mL,具有較強致病性,屬于強毒株型。
3)分離菌株ZS20200317對頭孢他啶、頭孢氨芐、頭孢唑林和頭孢拉定等20種抗生素藥物敏感,對氨芐西林、苯唑西林、羧芐西林、青霉素G、麥迪霉素、萬古霉素和克林霉素等7種藥物具有耐藥性。

