膜醭畢赤酵母對侵染蘋果的擴展青霉拮抗作用研究
茍心怡,高子晗,田 真,張 婷,岳田利
(西北大學 食品科學與工程學院,陜西省食品安全風險識別控制技術研究中心,陜西省營養健康食品個性制造工程實驗室,陜西省食品安全與營養健康創新轉化平臺,西安 710069)
蘋果在采后儲運和出售過程中,常面臨機械損傷和真菌侵染的問題,從而引發變質腐敗和經濟損失[1]。擴展青霉(Penicilliumexpansum)是存在于多種水果中的產毒霉菌,是蘋果腐爛過程中最重要的病原菌之一。其次生代謝物展青霉素是一種危害人類身體健康的真菌毒素[2]。目前,蘋果青霉病防治方法常采用化學方法和物理方法。化學方法主要利用化學殺菌劑控制采后病害,但由于過量的殘余農藥,不益于人體健康與生態環境。物理方法如脈沖法、臭氧法,由于價格昂貴不能普遍應用[3]。而生物防治在果實采后病害方面不斷取得突破,開始逐步替代化學殺菌劑和物理殺菌方法。在已有研究中,酵母的生物防治劑效果較好[4]。Cao等[5]研究發現Pichiacaribbica通過爭奪空間和養分來有效防治擴展青霉引起的蘋果采后青霉病;Zhang等[6]發現Pichiamembranefaciens對油桃的根霉病有顯著的生物防治功效,通過誘導相關的防御酶活性提高油桃的抗病性;Sun等[7]研究表明Rhodosporidiumpaludigenum的細胞壁通過增強相關防御酶活性以及PR蛋白(PR1-like、endoGLU9、endoCHI-like和PR4)的基因表達有效防治梨果實青霉病。酵母因其對環境安全,且存在良好的抗逆性,在病原菌防治方面成效顯著。
蘋果的采后病害主要由致病真菌引發,擴展青霉侵染不僅導致果實的腐敗還改變水果中揮發性有機化合物(VOC)的釋放。在感染的蘋果果實中,揮發性化合物的類型和含量會發生變化[8]。相關報道主要通過GC-MS對接種病原菌的蘋果進行檢測[9-10]。頂空氣相色譜-離子遷移譜(HS-GC-IMS)技術結合氣相色譜的簡單便捷與離子遷移譜的高分辨率、高靈敏度等特點,樣品不用前處理,檢測時間短,現已應用到橄欖油等級、火腿摻假,蜂蜜產地等方面的食品檢測[11],相對于GC-MS更具應用優勢。有關酵母控制蘋果采后青霉病基于HS-GC-IMS識別檢測方面的相關研究卻鮮見報道。
本試驗探究不同濃度的膜醭畢赤酵母細胞懸浮液對擴展青霉在體外和蘋果上的抑制效果,并通過HS-GC-IMS檢測膜醭畢赤酵母抑制擴展青霉引起的蘋果青霉病的揮發性物質,為蘋果采后青霉病的生物防治提供理論依據,也為GC-IMS應用于早期非視覺檢測蘋果中病原菌感染以及預后方面提供應對思路。
1 材料與方法
1.1 材 料
1.1.1 供試菌株 膜醭畢赤酵母(Pichiamembranifaciens)和擴展青霉(PenicilliumexpansumLPH10)保存于西北大學食品科學與工程學院,膜醭畢赤酵母懸浮液和LPH10孢子懸液制備按照蔡孟軒等[12]方法。
1.1.2 試驗載體 供試‘紅富士’蘋果采自陜西洛川,取大小均一,無磕碰,顏色外觀大致相同的蘋果作為試驗材料。隨機挑選蘋果,于體積分數為1% NaClO溶液浸潤1 min后,用無菌水洗滌后在室溫下風干。
1.1.3 培養基P.expansumLPH10:PDA培養基,膜醭畢赤酵母:YPD肉湯的配制參考文獻[13-14]。
1.2 試驗設計
1.2.1 膜醭畢赤酵母對擴展青霉的牛津杯抑菌試驗 牛津杯抑菌試驗采用劉冬梅等[15]方法,稍作改進。將10 mL PDA與100 μL擴展青霉LPH10孢子懸浮液(105CFU/mL)混合加入9 mm一次性培養皿作為第一層,隨后將無菌牛津杯置于該層,待再次倒入的PDA凝固后移出,將108、107、106CFU/mL的250 μL膜醭畢赤酵母懸浮液加入瓊脂孔中,置于28 ℃培養箱培養5 d后,測量并記錄抑菌圈直徑。
1.2.2 膜醭畢赤酵母對擴展青霉孢子萌發率和芽管長度的抑制 抑制孢子萌發率和芽管長度試驗參照閆巖等[16]方法,稍作改進。將50 mL馬鈴薯葡萄糖PDB肉湯裝入250 mL錐形瓶,分別加入1 mL不同濃度(108、107、106CFU/mL)的膜醭畢赤酵母細胞懸浮液,以無菌蒸餾水作為對照,同時將1 mL 濃度為107CFU/mL 的LPH10孢子懸液分別加入膜醭畢赤酵母和無菌水處理的錐形瓶中,置于28 ℃,75 r/min搖床培養12 h。顯微鏡觀察與計數參照趙新貝等[17]方法。
1.2.3 膜醭畢赤酵母對擴展青霉生物量的影響 參照王艷玲等[18]方法,略作改動。分別將濃度為108、107、106CFU/mL的膜醭畢赤酵母細胞懸浮液加入到PDB肉湯培養基中,無菌水作為對照組(CK)。按照“1.2.2”方法處理,培養8 d,分別取第2、4、6、8天各組培養基中的菌絲體進行抽濾,無菌蒸餾水清洗,60 ℃烘干4 h后稱量每組菌絲體干質量。
1.2.4 膜醭畢赤酵母對侵染蘋果的擴展青霉的拮抗抑制作用 將“1.1.2”中供試蘋果進行處理,在每個蘋果果實的赤道處用無菌針形成均勻的傷口(直徑3 mm,深度約2 mm)[19],并用微量注射器將30 μL不同濃度的膜醭畢赤酵母細胞懸浮液(108、107、106CFU/mL)分別接種至傷口部位,30 μL無菌蒸餾水作為對照組(CK)。2 h后,將濃度為5×104CFU/mL的LPH10孢子懸浮液30 μL在同一傷口部位接入,用保鮮膜將處理后的蘋果包裹后置于25 °C下培養,并維持較高的相對濕度(90%),于第2、4、6、8、10天統計蘋果的發病率和病變直徑,每組供試10個蘋果。
發病率=果實病孔數/接種總孔數×100%
1.2.5 基于HS-GC-IMS的膜醭畢赤酵母抑制蘋果擴展青霉侵染識別檢測 按照“1.2.4”方法進行蘋果接種,將蘋果分為2組,108CFU/mL的膜醭畢赤酵母拮抗組(P.M+LPH10)和對照組(LPH10),對培養至第10 天蘋果的接種部位進行取樣,取0.6 g蘋果組織于頂空瓶中,采用FlavourSpecR氣相離子遷移譜聯用儀進行檢測,具體測試條件方法參照文獻[20]并稍作調整。
1.3 數據處理
數據運用SPSS Statistics 19進行分析,origin 2018繪圖;GC-IMS部分通過儀器配套的GC-IMS Library Search軟件進行分析,并采用LAV中Gallery插件構建指紋圖譜。
2 結果與分析
2.1 膜醭畢赤酵母對擴展青霉的牛津杯抑菌試驗結果
由表1可知,106、107、108CFU/mL的酵母細胞懸浮液均對擴展青霉有抑制作用,且隨著濃度增大,拮抗效果越顯著。較低濃度的酵母106CFU/mL產生的抑菌圈僅有11.5 mm,而108CFU/mL的酵母懸浮液的抑菌圈直徑為25.4 mm,抑菌效果最明顯。
表1 膜醭畢赤酵母對擴展青霉在PDA上的抑制
2.2 膜醭畢赤酵母對擴展青霉孢子萌發率和芽管長度的抑制
圖1表明,28 ℃培養12 h后,不同濃度的酵母處理組的孢子萌發率和芽管長度均顯著低于CK組(P<0.05),與對照組相比,108、107、106CFU/mL酵母處理組萌發率分別減少64.0%、55.9%、49.5%,芽管長度分別減少31.05、27.14、24.24 μm。由此可知,108CFU/mL酵母細胞懸浮液對擴展青霉孢子萌發率和芽管長度的抑制最佳。酵母在PDB中抑制LPH10孢子萌發和芽管長度的結果與牛津杯試驗結果趨勢相似,即高濃度的膜醭畢赤酵母懸浮液所產生的抑菌效果最明顯。
2.3 膜醭畢赤酵母對擴展青霉生物量的影響
不同濃度的酵母細胞懸浮液對擴展青霉在PDB中的生長情況如圖2所示。28 ℃下培養至第8 天,與對照組相比,108、107、106CFU/mL酵母處理組的菌絲體干質量均顯著低于對照組(P<0.05),且分別減少0.398 g、0.339 g、0.312 g。通過對第2、4、6、8天的菌絲體干質量進行測量,可知酵母能顯著減少擴展青霉的生物量積累,酵母的濃度越大,抑制擴展青霉生長的效果越明顯,高濃度108CFU/mL的抑制作用最顯著(P< 0.05)。膜醭畢赤酵母通過抑制孢子的萌發來減少擴展青霉菌絲體的生長,進而降低LPH10生物量的積累,最終達到抑制其生長的目的。
2.4 膜醭畢赤酵母對侵染蘋果的擴展青霉的拮抗抑制作用
不同濃度的酵母對擴展青霉侵染引發的青霉病發病率情況如圖3所示,病變直徑如圖4所示。培養4 d,各處理組上升緩慢,且108CFU/mL、107CFU/mL處理組蘋果傷口部位均未發病。4 d至10 d,對照組上升急劇,而108CFU/mL酵母處理組維持平緩。培養10 d,對照組發病率和病變直徑分別為92.2%、18.5 mm,108CFU/mL酵母處理組的發病率為10.6%,病變直徑為8.73 mm,較對照組分別減少81.6%、9.77 mm,明顯抑制了蘋果青霉病的產生。各酵母處理組蘋果的發病率、病變直徑均顯著低于對照組(P<0.05),其中108CFU/mL處理對減小病變直徑及抑制擴展青霉感染的效果更佳。高濃度的膜醭畢赤酵母接種在蘋果上可以快速生長且覆蓋于傷口部位,爭奪營養空間,使LPH10無法正常利用營養資源,從而抑制LPH10的生長與生物量的積累,最終表現出對蘋果青霉病良好的防治功效。
2.5 基于HS-GC-IMS的膜醭畢赤酵母抑制蘋果擴展青霉侵染識別檢測
2.5.1 膜醭畢赤酵母抑制侵染蘋果的擴展青霉揮發性化合物分析 采用GC-IMS對培養10 d的蘋果(圖5)進行上樣分析。酵母抑制侵染蘋果的擴展青霉的氣相離子遷移色譜如圖6所示,紅色基準線右側的每一個點與一種特征性揮發物一一對應,白色表示濃度較低,而紅色則是濃度較高的表現。酵母拮抗組(P.M+LPH10)相比對照組(LPH10),除了RIP峰兩側的點變多,即揮發性化合物增加,也可以明顯看出信號峰顏色深淺的變化。通過構建擴展青霉感染蘋果與膜醭畢赤酵母作為生物防治劑控制蘋果采后青霉病的指紋圖譜,比較各揮發性化合物組分之間含量差異(圖7),總共定性出揮發性有機物38種(表2),主要由11種特征性酯類及23種醇醛化合物構成,酯類化合物是蘋果中的主要揮發性成分,同時還包括3種酸類化合物和苯乙烯。本試驗中,對照組中2,3-戊二酮、3-甲基-3-丁烯-1-醇、2-甲基丁醇、1-丁醇、苯甲醛含量比酵母拮抗組升高。已有研究表明,擴展青霉感染紅富士蘋果會導致丁醇、苯甲醛、3-甲基丁醛、苯乙烯水平升高[21],本研究結果與此相似。此外,對照組LPH10中苯乙烯、6-甲基-5-庚烯-2-酮、丙酸乙酯、3-甲基丁酸含量明顯高于酵母拮抗組,這幾種化合物可作為蘋果青霉病的揮發性標志物。且酵母處理組并未檢測出苯乙烯,可知被擴展青霉侵染過的蘋果經膜醭畢赤酵母拮抗后并未發生腐敗。
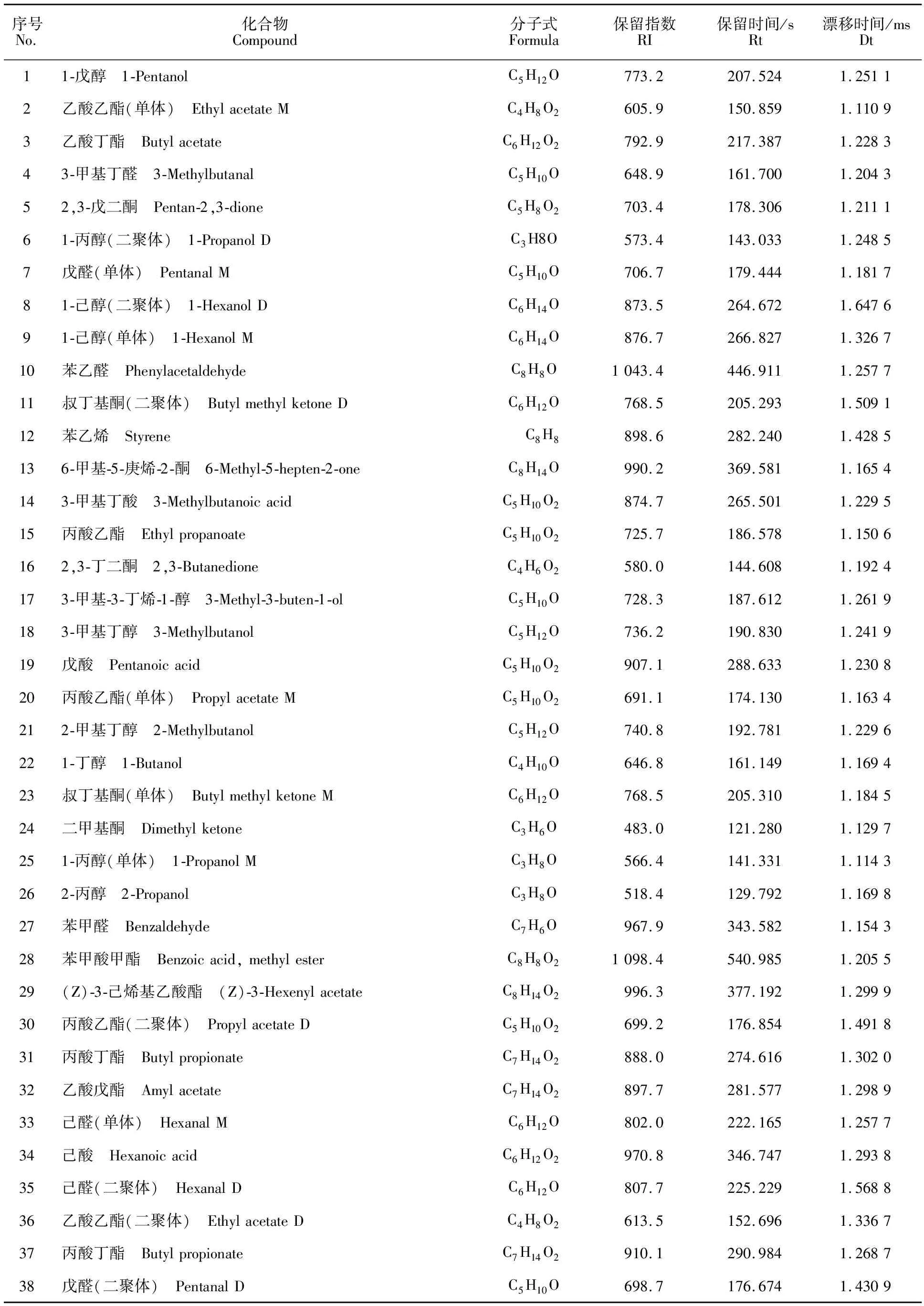
表2 蘋果中膜醭畢赤酵母抑制擴展青霉侵染產生的揮發性化合物
3 討論與結論
在真菌病原體、果實和生物拮抗劑之間的相互作用過程中,拮抗酵母可通過多種作用方式發揮防治功效,包括爭奪營養空間,形成生物膜,產生殺傷毒素和揮發性有機化合物,誘導果實抗性等[22]。競爭是一種有效的生物防治機制,當拮抗酵母在爭奪空間的過程中,通常具有快速生長和形成胞外多糖囊的優勢,這種多糖囊可以促進其粘附在水果表面,形成覆蓋整個傷口區域的生物膜,從而抑制病原菌的生長[23-25]。劉程惠等[26]研究表明,Candidarailenensis對3種腐敗霉菌皆表現出拮抗作用,且109CFU/mL的C.railenensis的拮抗作用最佳。而本研究膜醭畢赤酵母濃度為108CFU/mL時即可達到較顯著的防治效果。閆巖等[16]研究發現Debaryomyceshansenii能抑制柑橘青霉病的發生,在108CFU/mL濃度時抑菌圈的直徑為20.6 mm,而本研究中108CFU/mL膜醭畢赤酵母產生的抑菌圈直徑為 25.4 mm,高于D.hanseni的抑菌直徑。He等[27]研究中經茉莉酸酯增強的Meyerozymaguilliermondii組相比較對照組,孢子萌發率減少了 53.5%,而本研究中108CFU/mL處理組減少 64.0%,抑制效果更明顯。蘋果接種試驗,培養10 d,108CFU/mL酵母拮抗組的發病率較對照組減少81.6%,隨著接種酵母濃度的增大,發病率降低。分析由于高濃度的膜醭畢赤酵母快速生長并覆蓋蘋果的傷口部位,爭奪營養與空間(如碳水化合物、氮、氧)[28],從而抑制擴展青霉的生長繁殖。
蘋果腐敗時揮發性化合物會發生變化。研究報道,苯乙烯是擴展青霉感染蘋果時產生的主要揮發物之一,來源于發酵、成熟、貯藏或分解過程中的微生物代謝,由于其強烈的刺激性氣味會產生不良影響[29-31]。GC-IMS檢測揮發性化合物時無需對樣品進行前處理,檢測線低至ppb級[32],可以對樣品進行快速檢測。本試驗中應用頂空氣相色譜-離子遷移譜聯用技術分別對只接種了擴展青霉和先接入膜醭畢赤酵母再接種擴展青霉的蘋果進行分析,發現苯乙烯只在對照組中檢測出,酵母拮抗組并未檢測出,可以作為蘋果腐敗的預后標志物。結果表明,108CFU/mL膜醭畢赤酵母細胞懸浮液能有效抑制擴展青霉孢子萌發率和芽管長度,并抑制其生物量積累;接種在蘋果上,高濃度組的酵母抑制擴展青霉的生長,并顯著降低了發病率和病變直徑。膜醭畢赤酵母作為生物防治劑可以有效防治蘋果采后青霉病,同時通過GC-IMS技術可以實現早期快速檢測蘋果中發生的病原菌侵染,及時采取措施,從而減少水果采后腐敗帶來的損失。

